Термическое разложение бензоатов и аминобензоатов Mn (II), Co (II), Ni (II), Cu (II)
Автор: Толстогузов Д.С., Жеребцов Д.А., Белов К.Н., Вяткин Г.П.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
В статье рассматриваются основные способы получения углеродных композитных наноматериалов и выделяется метод термолиза как один из основных методов. Для понимания сущности процессов термического разложения как метода синтеза углеродных наноматериалов был рассмотрен термолиз ароматических карбоксилатов марганца (II), кобальта (II), никеля (II) и меди (II). В статье подробно рассматривается методика синтеза этих карбоксилатов металлов в простых условиях. Процесс термического разложения производился в двух средах (воздушная как окислительная и аргоновая как нейтральная) для сравнения получаемых продуктов. Для подробного изучения процессов разложения карбоксилатов марганца (II), кобальта (II), никеля (II) и меди (II) использовались методы термического анализа (ТГ и ДСК) на синхронном термоанализаторе Netzsch 449 Jupiter. Для изучения морфологии и состава продуктов применялись методы рентгенофазового анализа, оптической и сканирующей электронной микроскопии и рентгенофлуоресцентного микроанализа. Использовались приборы: рентгеновский дифрактометр Rigaku Ultima IV и сканирующий электронный микроскоп с приставкой элементного микроанализа Jeol JSM-7001F. Также были предложены механизмы процессов, протекающих при термическом разложении ароматических карбоксилатов марганца (II), кобальта (II), никеля (II) и меди (II). Для более точного определения состава продуктов синтеза карбоксилатов марганца (II), кобальта (II), никеля (II) и меди (II) и более точного описания процессов термического разложения этих солей также были подвергнуты термическому разложению и соответствующие ароматические карбоновые кислоты. В приложении к статье представлены термограммы ароматических карбоксилатов марганца (II), кобальта (II), никеля (II) и меди (II).
Аминобензоаты, переходные металлы, термический анализ, карбонизация, продукты термолиза
Короткий адрес: https://sciup.org/147244631
IDR: 147244631 | УДК: 544.01+ | DOI: 10.14529/chem240221
Текст научной статьи Термическое разложение бензоатов и аминобензоатов Mn (II), Co (II), Ni (II), Cu (II)
Термическое разложение карбоксилатов металлов является одним из основных методов получения углеродных композитных материалов [1–3]. В результате термического разложения ароматических карбоксилатов металлов образуется углеродная матрица, в которую включены наночастицы оксидов металлов либо металлов. В работах [4, 5] описываются процессы разложения соединений Mn(II) с образованием оксидов. Так, при нагреве до 460 °С и двухчасовой выдержке образуется MnO [4], при нагреве до 600 °С образуется смесь оксидов Mn 2 O 3 , Mn 3 O 4 [5]. В работах [6–8] описывается подробный процесс термолиза карбоксилатов Co, Ni, Cu. Показано, что при разложении карбоксилатов Со образуется углеродная полимерная матрица из карбоксилатного аниона и выделяется элементный Со, то же происходит и с карбоксилатами Ni. Процессы разложения производили при температурах до 400 °С. Также показано, что при нагревании до 500 °С выделившийся Со взаимодействует с СО 2 с образованием СоО. В работе [8] при разложении карбоксилатов Ni образуется смесь металлосодержащих продуктов: Ni и NiO. Авторы [9–13] изучали процессы термического разложения ацетатов, оксалатов, малонатов, сукцинатов, малеатов и фумаратов Mn(II), Co(II), Ni(II), Cu(II). При этом, в основном, образовывались оксиды MnO, CoO, NiO, Cu 2 O. Нагрев производился до температур 400–500 °С. Побочными продуктами являлись СО и СО 2 . В некоторых случаях образовывались Mn 3 O 4 , Co, Ni, Cu, Cu 2 O·CuO [10, 13]. В указанных работах термическое разложение производилось со скоростью 10 °С/ мин. Работы [14–19] описывают процессы термического анализа карбоксилатов Mn, Co, Ni, Cu до оксидов металлов. Однако в работах [15, 18] также указывается возможность восстановления до металлического состояния. Авторами [20–28] были изучены и описаны процессы термолиза разных карбоксилатов разных металлов (Cr, Fe, Co, Ni, Cu, Cd) до оксидов металлов. Были установлены температуры получения оксидов металлов. Основной интервал температур получения оксидов металлов (Cr 2 O 3 , NiO, Fe 2 O 3 , CoO, Co 3 O 4 , CuO, ZnO, CdO) соответствует 500–800 °С. В нашей работе проведено исследование термического разложения продуктов при нагревании до 900 °С в двух атмосферах: воздух и Ar.
Экспериментальная часть
Для проведения работы были синтезированы карбоксилаты (бензоаты, антранилаты, п -аминобензоаты, м -аминобензоаты) марганца (II), кобальта и меди (II) по методике [29]. Для синтеза использовались химически чистые MnCl 2 ·4H 2 O, CoCl 2 ·6H 2 O, CuCl 2 ·2H 2 O, бензоат Na, антраниловая, м -аминобензойная и п -аминобензойная кислоты, NaOH. В качестве растворителей использовались вода и 1,4-диоксан. Соли переходных металлов и NaOH растворяли в воде, а кислоты растворяли в 1,4-диоксане при нагревании до 80 °С. Растворы NaOH и кислоты смешивали в стехиометрическом соотношении для получения однозамещенного карбоксилата натрия. Бензоат натрия растворяли в 1,4-диоксане при нагревании до 80 °С. Выход продукта реакций составлял 60–80 %. Реакции протекали мгновенно, растворы карбоксилатов марганца (II)
приобрели слабоокрашенный коричневый цвет, растворы карбоксилатов кобальта (II) окрашивались в красный цвет. В течение нескольких суток происходило испарение растворителя при комнатной температуре. Затем полученные продукты перекристаллизовывали из горячего 1,4-диоксана для очистки от NaCl.
Полученные карбоксилаты были исследованы на синхронном термическом анализаторе Netzsch STA 449F1 Jupiter. Предварительно была произведена оценка чистоты полученных соединений методом рентгенофлуоресцентного анализа на рентгеновском энергодисперсионном спектрометре Oxford INCA X-max 80, а также методом рентгенофазового анализа на рентгеновском порошковом дифрактометре Rigaku Ultima IV. Термическое исследование проводилось в корундовом тигле при нагревании образцов массой от 15 до 20 мг в интервале температур от 30 до 900 °С в двух вариантах атмосферы в печи термоанализатора: воздух и Ar. Скорость нагрева везде составляла 10 К/мин. После термолиза солей фазовый состав продуктов их разложения изучался методом рентгенофазового анализа, морфология металлооксидных фаз – методом сканирующей электронной микроскопии на микроскопе Jeol JSM-7001F, а их состав – на рентгеновском энергодисперсионном спектрометре Oxford INCA X-max 80.
Результаты и обсуждение
Анализ химического состава карбоксилатов металлов выявил в них незначительную примесь NaCl, которая не превышала 1 масс. %. В основном тексте представлены две термограммы. Состав продуктов термолиза и их морфология также представлены в основном тексте статьи.
Термический анализ карбоксилатов металлов (II) подробно рассмотрен на термограммах разложения бензоата Со (II) для двух атмосфер (рис. 1 и 2).
Подробный анализ термического разложения бензоата кобальта (II) в интервале температур от 25 до 900 °С в атмосферах аргона и воздуха.
Процессы разложения соли протекают в четыре ступени в атмосфере воздуха и в пять ступеней в атмосфере Ar. В процессе термического разложения в случаях (Ar) и (воздух) в интервале температур от 60 до 130 °С происходит потеря массы образца величиной 12,77 % (Ar) и 12,87 % (воздух) (по кривой ТГ) при испарении бензойной кислоты. Испарение является эндотермическим процессом, величина которого составляет –345,3 Дж/г (Ar) и –353,1 Дж/г (воздух) (по кривой ДСК).
На второй ступени наблюдается потеря массы образца величиной 3,29 % (Ar) и 3,20 % (воздух) от исходной массы при температурах 130–170 °С (Ar) и 130–165 °С (воздух). На третьей ступени в интервале температур 170–465 °С (Ar) и 165–465 °С (воздух) происходит плавление с разложением образца соли. При этом наблюдается наличие двух эндотермических пиков для обеих атмосфер. На четвёртой ступени наблюдается потеря массы образца величиной 9,54 % (Ar) и 9,98 % (воздух) от исходной массы при температурах 465–690 °С (Ar) и 465–900 °С (воздух). На пятой ступени наблюдается привес массы образца для случая (Ar). Он составляет 1,81 % при 690–900 °С. К этому моменту окисление образца заканчивается, поэтому продуктом является Co 3 O 4 .
Общая потеря массы образца составляет 78,78 % (Ar) и 79,01 % (воздух) от исходной массы образца. Можно заключить, что протекающие процессы очень схожи, поэтому схожими будут и продукты термического распада.
Основными твёрдыми продуктами термического распада этой соли являются Со (100 %) для случая (Ar) и Со 3 O 4 (100 %) для случая (воздух), согласно результатам рентгенофазового анализа. Свободного кристаллического углерода не обнаружено, поэтому можно сделать вывод, что углеродный остаток от карбоксилатного аниона перешёл в аморфный углерод твёрдого продукта термолиза. Дифрактограмма твёрдых продуктов термолиза бензоата Со (II) представлена на рис. 3 и 4.
Методом сканирующей электронной микроскопии был проведён анализ продуктов термолиза бензоата кобальта (II).
Как видно по изображениям, продукты термолиза имеют сферическую форму (рис. 5 и 6). В случае (Ar) это срощенные друг с другом сферы размером 0,3–0,6 мкм, в случае (воздуха) это сферы размером 0,2–0,6 мкм.
Как видно из рис. 3, часть сфер находится на поверхности аморфного углерода. Также наблюдается равномерное распределение сферических частиц по поверхности аморфного углерода, однако большее их количество находится в структуре аморфного углерода.
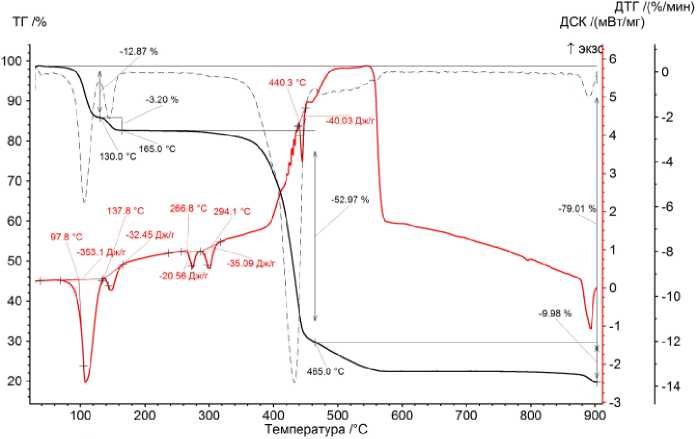
Рис. 1. Кривые ТГ-ДСК термического распада бензоата Co (II) при нагревании образца в атмосфере воздуха
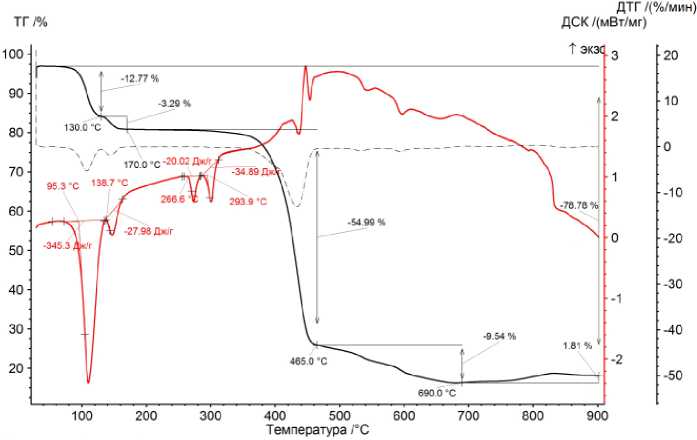
Рис. 2. Кривые ТГ-ДСК термического распад бензоата Co (II) при нагревании образца в атмосфере аргона
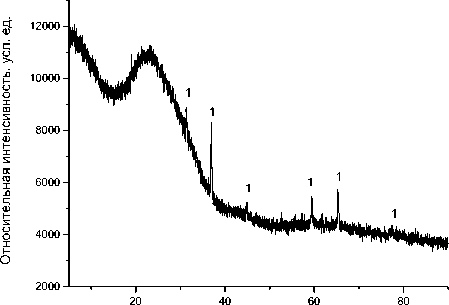
Рис. 3. Дифрактограммы твёрдых продуктов термического распада бензоата Со (II) при 900 °С в атмосфере воздуха. 1 – Со 3 O 4
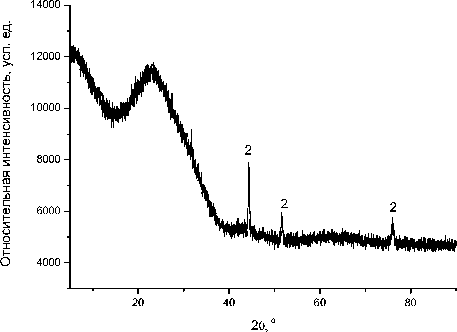
Рис. 4. Дифрактограммы твёрдых продуктов термического распада бензоата Со (II) при 900 °С в атмосфере аргона. 2 – Со

Рис. 5. Морфология продуктов термолиза Рис. 6. Морфология продуктов термолиза бензоата кобальта (II) после разложения при 900°С бензоата кобальта (II) после разложения при 900 °С в атмосфере воздуха в атмосфере аргона
В табл. 1 показаны основные особенности термического разложения солей на воздухе.
Описание термического разложения карбоксилатов металлов в атмосфере воздуха
Таблица 1
|
Соль |
Общая потеря массы, % / количество ступеней; теплоты процессов |
Температурные интервалы разложения (потеря массы на каждой ступени) |
Характеристика продуктов термолиза |
|
1 |
2 |
3 |
4 |
|
антранилат Mn (II) |
73,97 / 4; Эндотермический процесс разложения карбоксилата Mn до карбоната Mn: –219,4 Дж/г. Экзотермический процесс горения продукта при температурах 300–720 °С |
100–215 °С: испарение непрореагировав шей кислоты (–11,22 %), 215–395 °С: разложение карбоксилата до карбоната (–31,11 %), 395–725 °С: разложение карбоната до MnО (–30,65 %), 725–900 °С: образование стеклоуглерода, окисление MnО до Mn3О4 (–0,97 %) |
95 % Mn 3 O 4 , ОКР: 9,65 нм. Размер частиц: 0,4–5 мкм |
|
м -амино- бензоат Mn (II) |
80,19 / 5; Экзотермический процесс горения продукта при температурах 440–580 °С |
40–270 °С: испарение непрореагировавшей кислоты (–8,01 %), 270–370 °С: образование и выделение азотсодержащих продуктов (–5,33 %), 370–465 °С: разложение карбоксилата до карбоната (–24,67 %), 465–580 °С: разложение карбоната Mn до MnO (–37,46 %), 580–900 °С: образование и стабилизация стеклоуглерода, окисление MnО до Mn3О4 (–4,72 %) |
97 % Mn 3 O 4 , ОКР: 19,07 нм. Размер частиц: 0,3–0,6 мкм |
|
п -амино- бензоат Mn (II) |
74,01 % / 5; Эндотермический процесс при 160 °С: –38,67 Дж/г. Эндотермический процесс при 615,2 °С: –20,52 Дж/г. Экзотермический процесс горения при температурах 320– 600 °С |
40–121 °С: потеря адсорбированной воды (–9,42 %), 121–180 °С: испарение непрореагировав шей кислоты (–6,61 %), 180–370 °С: разложение карбоксилата до карбоната (–22,07 %), 370–630 °С: разложение карбоната Mn и формирование Mn3O4 и MnO2 (–26,08 %), 630–900 °С: формирование и стабилизация стеклоуглерода (–8,96 %) |
87 % Mn 3 O 4 , ОКР: 45,2 нм. 8 % MnO 2 ОКР: 5,9 нм. Размер частиц: 0,06–2 мкм |
Окончание табл. 1
|
1 |
2 |
3 |
4 |
|
бензоат Co (II) |
79,01 % / 4; Эндотермический процесс испарения кислоты при 97,8 °С: –353,1 Дж/г и 137,8 °С: –32,45 Дж/г. Последовательный эндотермический процесс при 266,8 °С (–20,56 Дж/г) и 294,1 °С (–35,09 Дж/г). Эндотермический процесс при 440,3 °С: –40,03 Дж/г. Экзотермический процесс горения пробы при 380–560 °С |
60–130 °С: (–12,87 %), 130–165 °С: (–3,20 %), Оба процесса отображают испарение непрореагировавшей кислоты, 165–465 °С: разложение карбоксилата и формирование Со 3 О 4 (–52,97 %), 465–900 °С: формирование стеклоуглерода (–9,98 %) |
98 % Со 3 О 4 , ОКР: 42,37 нм. Размер частиц: 400– 600 нм |
|
антранилат Co (II) |
73,65 % / 3; Экзотермический процесс горения пробы при 280–610 °С. Эндотермический процесс при 372,1 °С: –504,2 Дж/г Экзотермический процесс при 593,5 °С: 571,3 Дж/г |
60–465 °С: испарение непрореагировавшей кислоты и разложение карбоксилата до карбоната (–49,65 %), 465–595 °С: разложение карбоната до оксида (–24,74 %), 595–900 °С: частичное восстановление оксида Со до элементного Со (+0,74 %) |
88 % Со 3 О 4 , ОКР: 21,1 нм, 3 % Со, ОКР: 90,8 нм, 10 % графита, ОКР: 1,629 нм. Размер частиц: 40–60 нм |
|
п -амино- бензоат Co (II) |
79,87 % / 6; Эндотермический процесс при 139 °С: –395,5 Дж/г. Эндотермический процесс при 295,8 °С: –115,9 Дж/г. Экзотермический процесс горения пробы при 360–660 °С |
60–180 °С: испарение непрореагировавшей кислоты (–9,81 %), 180–270 °С: разложение карбоксилата с выделением аммиака (–2,77 %), 270–375 °С: дальнейшее разложение карбоксилата до карбоната (–17,55 %), 375–520 °С: разложение карбоната (–34,18 %), 520–625 °С: образование СоО (–17,03 %), 625–900 °С: окисление СоО до Со 3 О 4 (+1,47 %) |
98 % Со 3 О 4 , ОКР: 3,31 нм. Размер частиц: 10– 400 нм |
|
бензоат Ni (II) |
79,81 % / 5; Эндотермический процесс при 105 °С –376,8 Дж/г. Эндотермический процесс при 394,4 °С: –245,8 Дж/г. Экзотермический процесс горения пробы при 420–520 °С |
60–150 оС: испарение непрореагировавшей кислоты (–12,77 %), 150–230 °С: (–10,7 %), 230–315 °С: (–3,39 %), 315–470 °С: (–53,47 %), Процессы разложение аниона и образование NiO, 470–900 °С: формирование стеклоуглеродного остатка |
100 % NiO, ОКР: 49,8 нм. Размер частиц: 40– 100 нм |
|
п- амино- бензоат Ni (II) |
81,5 % / 4; Эндотермический процесс при 101 °С. Экзотермический процесс при 280–620 °С |
60–185 °С: испарение непрореагировавшей кислоты (–16,35 %), 185–420 °С: –33,52 %, 420–595 °С: –32,93 %, Процессы разложения карбоксилатного иона и образование NiO. 595–900 °С: формирование стеклоуглерод ного остатка (+ 1,3 %) |
100 % NiO, ОКР: 50 нм. Размер частиц: 150–400 нм |
|
п -амино- бензоат Cu (II) |
77,73 % / 6; Экзотермический процесс горения пробы при 260–620 °С |
60–180 °С: испарение непрореагировавшей кислоты (–3,95 %), 180–235 °С: разложение карбоксилата с выделением аммиака (–5,13 %), 235–325 °С: разложение карбоксилата до карбоната (–33,5 %), 325–600 °С: разложение карбоната (–31,86 %), 600–700 °: (+2,0 %), 700–900 °С: (–5,28 %). Оба процесса характеризуются образованием продукта термолиза: СuO |
100 % СuО, ОКР: 78,7 нм. Размер частиц: 2–10 мкм |
В табл. 2 показаны основные особенности термического разложения солей в аргоне.
Описание термического разложения карбоксилатов металлов в атмосфере аргона
Таблица 2
|
Соль |
Общая потеря массы, % / количество ступеней; теплоты процессов |
Температурные интервалы разложения |
Характеристика продуктов термолиза |
|
1 |
2 |
3 |
4 |
|
антранилат Mn (II) |
66,14 / 3; Эндотермический процесс при 351,4 °С |
100–205 °С: испарение непрореагировавшей кислоты (–12,20 %), 205–390 °С: разложение карбоксилата до карбоната (–33,80 %), 390–900 °С: разложение карбоната до MnО (–20,10 %) |
90 % MnO, ОКР: 33,76 нм. Размер частиц: 0,4–3 мкм |
|
м -амино-бензоат Mn (II) |
59,1 / 4; Эндотермический процесс при 329,7 °С: –194,9 Дж/г |
100–280 °С: испарение непрореагировавшей кислоты (9,39 %), 280–370 °С: образование и выделение азотсодержащих продуктов (3,59 %), 370–560 °С: разложение карбоната до MnО (33,12 %), 560–900 °С: образование и термическое разложение стеклоуглерода (13,01 %) |
97 % MnO, ОКР: 21,35 нм. Размер частиц: 0,03–0,6 мкм |
|
п -амино-бензоат Mn (II) |
54,05 % / 5; Эндотермический процесс при 160 °С: –37,54 Дж/г. Эндотермический процесс при 394,6 °С: –16,75 Дж/г. Эндотермический процесс при 614,8 °С: –8,64 Дж/г |
60–130 °С: потеря адсорбированной воды (4,89 %), 130–180 °С: испарение непрореагировавшей кислоты (6 %), 180–268 °С: образование и выделение азотсодержащих продуктов (8,2 %) 268–449 °С: разложение карбоксилата до карбоната (24,94 %), 449–900 °С: образование окислов марганца и формирование стеклоуглерода (9,86 %) |
42 % Mn 3 O 4 , 50 % MnO ОКР: 16 нм. Размер частиц: 0,06–0,25 мкм |
|
бензоат Co (II) |
78,78 % / 5; Эндотермический процесс испарения кислоты при 95,3 °С: –345,3 Дж/г и 138,7 °С: – 27,98 Дж/г. Последовательный эндотермический процесс при 266,6 °С (–20,02 Дж/г) и 293,9 °С (– 34,89 Дж/г) |
60–130 °С: (–12,77 %), 130–170 °С: (–3,29 %), Оба процесса отображают испарение непрореагировавшей кислоты, 170–465 °С: разложение карбоксилатного аниона (54,99 %), 465–690 °С: образование окислов Со (–9,54 %), 690–900 °С: восстановление окислов Со до Со и формирование стеклоуглерода (1,81 %) |
95 % Со, ОКР: 19,74 нм. Размер частиц: 250–620 нм |
|
антранилат Co (II) |
66,53 % / 4; Эндотермический процесс при 387,6 °С: –452,5 Дж/г. Эндотермический процесс при 573,8 °С: –23,14 Дж/г |
60–430 °С: испарение непрореагировавшей кислоты и разложение карбоксилата до карбоната (–40,46 %), 430–545 °С: разложение карбонатов до оксидов (–16,07 %), 545–595 °С: (–4,44 %), 595–900 °С: (–5,57 %), Оба процесса отображают образование графита и формирование стеклоуглерода |
34 % Со 3 О 4 , ОКР: 2,55 нм, 63 % графита, ОКР: 19,5 нм. Размер частиц: 20–300 нм |
|
п -амино-бензоат Co (II) |
69,71 % / 4; Эндотермический процесс при 137,3 °С: –472,3 Дж/г. Эндотермический процесс при 294,8 °С: –160,4 Дж/г. Эндотермический процесс при 493 °С: –101,6 Дж/г |
60–240 °С: испарение непрореагировавшей кислоты (–11,36 %), 240–385 °С: разложение карбоксилата до карбоната Со (–22,71 %), 385–545 °С: разложение карбоната Со (–31,24 %), 545–900 °С: формирование стекло углерода (–4,41 %) |
100 % Со, ОКР: 86,8 нм. Размер частиц: 30–400 нм |
Окончание табл. 2
|
1 |
2 |
3 |
4 |
|
бензоат Ni (II) |
82,7 % / 4; Эндотермический процесс при 105,3 °С: –397,8 Дж/г. Эндотермический процесс при 335,9 °С: –35,99 Дж/г. Эндотермический процесс при 378 °С: –140,3 Дж/г |
60–145 °С: испарение непрореагировавшей кислоты (–12,6 %), 145–220 °С: –9,89 %, 220–420 оС: –56,52 %, Протекает процесс разложения карбоксилата Ni. 420–900 °С: происходит частичное восстановление NiO до Ni (–3,06 %) |
96 % Ni, ОКР: 96,2 нм, 4 % NiO, ОКР: 39,8 нм. Размер частиц: 0,06–1,25 мкм |
|
п- амино- бензоат Ni (II) |
65,0 % / 4; Эндотермический процесс при 99,2 °С: –461,3 Дж/г |
60–155 °С: испарение непрореагировавшей кислоты (–14,79 %), 155–365 °С: –18,25 %, 365–550 °С: –23,66 %. Протекает процесс разложения карбоксилата Ni (II) до NiO. 550–900 °С: протекают процессы формирования стеклоуглерода, образование графита и восстановление NiO до Ni (–8,3 %) |
54 % графит, ОКР: 1,95 нм, 44 % Ni, ОКР: 14,59 нм, 2 % NiO, ОКР: 10 нм. Размер частиц: 50–200 нм |
|
п -амино-бензоат Cu (II) |
78,94 % / 4; Эндотермический пик при 264,2 °С: –193,5 Дж/г |
60–175 °С: (–3,76 %), 175–240 °С: (–10,62 %). Оба процесса отображают процесс испарения непрореагировавшей кислоты. 240–330 °С: процесс разложения карбоксилата (–44,74 %), 330–900 °С: разложение карбоксилата и формирование стеклоуглерода, также восстановление CuO до Cu2O и Cu (–19,82 %) |
28 % Cu 2 O, ОКР: 44,9 нм, 72 % Cu, ОКР: 23,6 нм. Размеры частиц: 0,4–1,5 мкм |
Анализируя полученные данные по термическому разложению карбоксилатов Mn (II), Co (II), Ni (II), Cu (II) (рис. 7–12) и анализу продуктов термолиза, можно сделать обобщение о том, что термическое разложение солей происходило ступенчато, потери массы при нагревании были неравномерны. В интервале температур от 60 до 200 °С происходила потеря остатка кислоты.
Количество ступеней термического разложения, исходя из данных таблицы, не зависит от характера газовой атмосферы над образцом. Для каждой соли можно выделить повторяемость в числе ступеней разложения. Получается, что на процесс термолиза карбоксилатов металлов влияет только строение органического аниона, т. е. в данном случае заместители в бензольном кольце. Для аминобензоатных анионов заместителем в ароматическом ядре является аминогруппа, поэтому есть интерес в изучении зависимости характера термического разложения от строения аминобензоатного аниона.
При нагревании некоторые образцы плавились в атмосфере аргона: антранилат Mn (351,4 °С), п -аминобензоат Mn (350,4 °С), п -аминобензоат Со (294,8 °С), бензоат Ni (394,4 °С), п -аминобензоат Ni (Ni (307,6 °C), п -аминобензоат Cu (264,2 °С). Также при разложении антранилата Со (в Ar и воздухе) и п -аминобензоата Ni (в Ar) было характерно образование графита. При дальнейшем нагреве происходил пиролиз карбоксилата с образованием аморфного углерода и формированием оксидов металлов или металлов (в случаях Cu и Ni).
Как можно наблюдать, для каждой соли характерны одинаковые процессы при термолизе в разных атмосферах. Для карбоксилатов, разлагавшихся в атмосфере воздуха, на кривой ДСК наблюдается процесс окисления. Он отображен в виде возрастания и убывания кривой функции (трапециедальная форма) отклика на кривой ДСК в интервале температур в среднем от 300 до 700 °С.
Общая потеря массы составляет от 59 до 83 % в атмосфере Ar, от 74 до 82 % – в атмосфере воздуха. Потеря массы на воздухе выше, чем потеря массы в Ar. Это означает, что разложение карбоксилатов металлов происходит до конца вплоть до образования окислов металлов и некоторого количества стеклоуглерода.
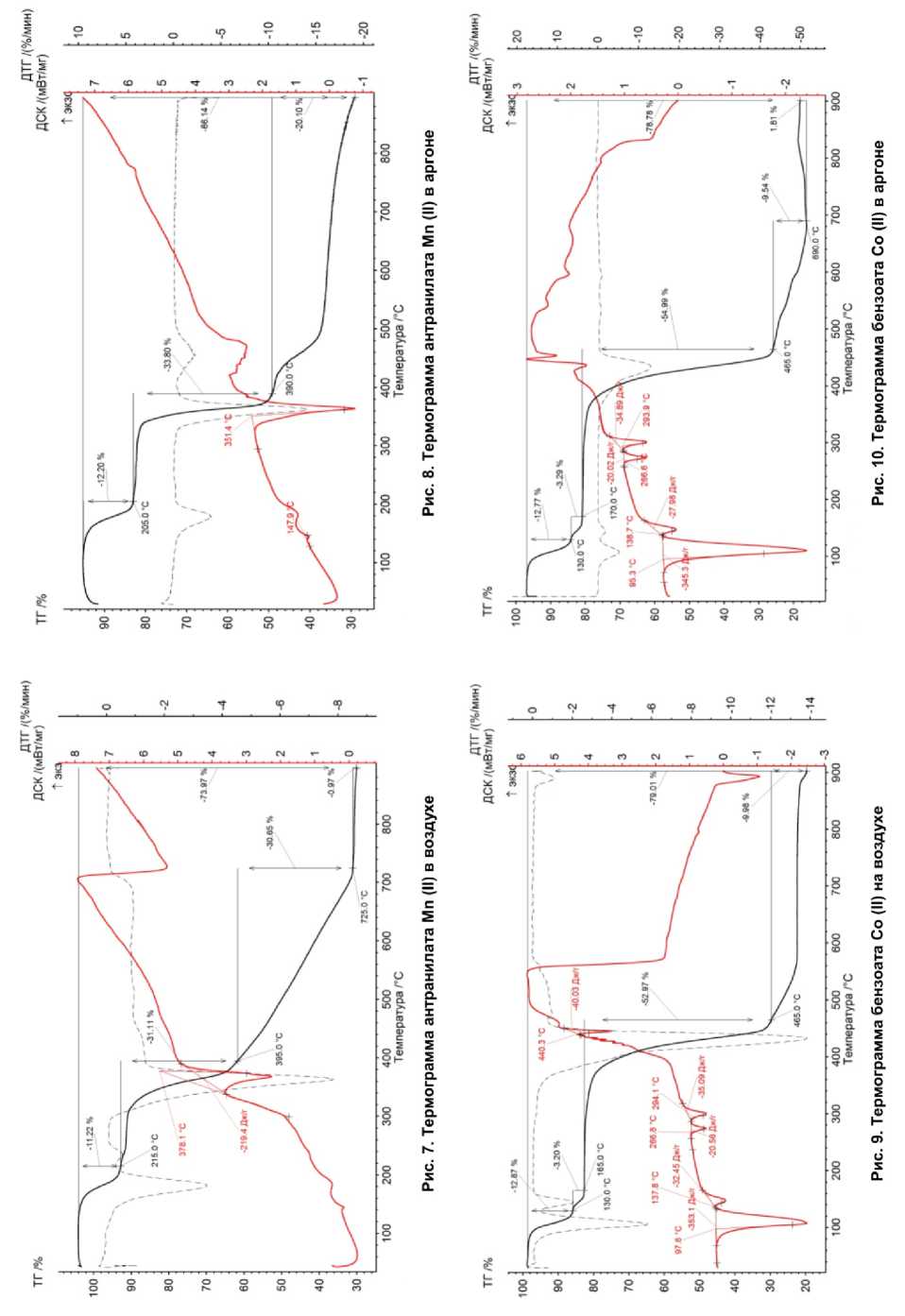
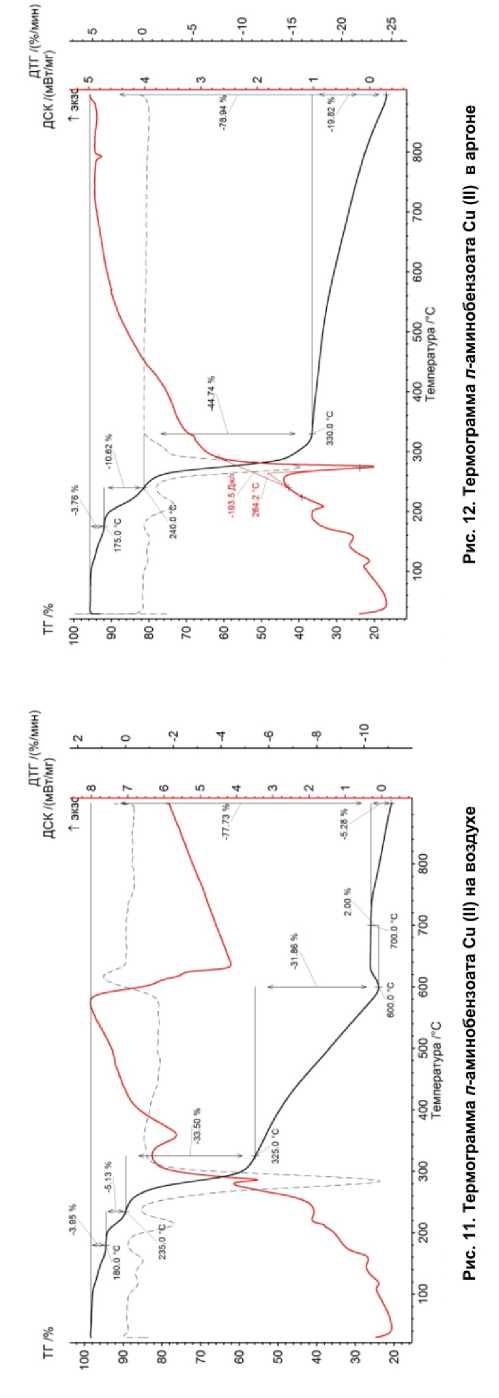
Размер области когерентного рассеяния находился в нанометровой размерности для некоторых композитных материалов. При термолизе антранилата Co, п -аминобензоата Co, бензоата Ni в атмосфере воздуха образовывались наночастицы оксидов металлов размером от 10 до 400 нм, при термолизе антранилата Co, п -аминобензоата Co, п -аминобензоата Ni – наночастицы оксидов металлов и металлов размером от 20 до 400 нм. В некоторых случаях продуктами термолиза были частицы металлов (в атмосфере Ar: бензоат и п-аминобензоат Co, бензоат и п -аминобензоат Ni, п -аминобензоат Cu), а не оксидов металлов. Это означает, что при термолизе образовывались частицы металлов, значит оксиды этих металлов способны легко диссоциировать на металл и кислород при нагревании.
Заключение
В результате анализа термического разложения рассмотренных ароматических карбоксилатов Mn (II), Co (II), Ni (II), Cu (II) были выявлены следующие закономерности. Во-первых, общая потеря массы на воздухе выше, чем в аргоне, при термолизе соли для большинства рассмотренных солей (кроме бензоатов Co, Ni и п -аминобензоата Cu, для которых потеря массы одинакова в обеих атмосферах). Во-вторых, число ступеней разложения не зависит от кислотного остатка соли и способности катиона металла при разложении образовывать прочную оксидную структуру. В-третьих, основные пики на кривых ДСК для одной соли в разных атмосферах повторяются. Небольшое различие наблюдается в температурах и энтальпии происходящих на рассматриваемых этапах процессов. Это свидетельствует о схожести протекающего термолиза независимо от атмосферы, в которой происходит разложение. В-четвёртых, состав продуктов разложения схож для термолиза в обоих условиях. Так, в случае с карбоксилатами Mn (II) продуктами были оксиды марганца Mn3O4 и MnO, в случае с карбоксилатами Co (II) продукты: Со и Со 3 О 4 , в случае с карбоксилатами Ni (II): NiO и Ni, в случае с карбоксилатами Cu (II): CuO, Cu 2 O, Cu. В атмосфере воздуха образуются высшие оксиды металлов, в атмосфере Ar – низшие оксиды металлов и металлы.
Образовавшиеся частицы твёрдых продуктов в матрице из аморфного углерода обладают наноразмерами и, обладая подвижностью при высокой температуре, агломерировали в более крупные частицы. Об этом свидетельствует различие между размерами ОКР и зерна, наблюдаемого в микроскоп.
Таким образом, подвергая термолизу бензоаты и изомерные аминобензоаты, можно обобщить, что величины потери массы, состав и характеристика продуктов термолиза не зависят от положения аминогруппы в бензольном кольце аниона соли. Процессы термического разложения рассмотренных солей одинаковы, по образующимся продуктам термолиза можно описать ход процесса. По величине размеров зёрен металлов и оксидов металлов можно заключить, что Co, Ni, Cu и их оксиды обладают склонностью к агломерации частиц, так как в основном размеры частиц находились в микрометровом диапазоне.
Список литературы Термическое разложение бензоатов и аминобензоатов Mn (II), Co (II), Ni (II), Cu (II)
- Ремпель А.А. // Успехи химии. 2007. Т. 76, № 5. С. 474. EDN: HEJRAV.
- Помогайло А.Д., Розенберг А.С., Джардималиева Г.И. // Успехи химии. Т. 80, № 3. С. 272. DOI: 10.1070/RC2011v080n03ABEH004079.
- Помогайло А.Д., Розенберг А.С., Джардималиева Г.И. // Российский химический журнал. 2009. Т. 53, № 1. С. 140. EDN: LKFLTD.
- Brown M.E., Dollimore D. Galwey A.K. // J. Chem. Soc., Faraday Trans. 1974. V. 70, No. 1. Р. 1316. DOI: 10.1039/F19747001316.
- Deng Y., Zhou Z. // Journal of Coordination Chemistry. 2009. V. 62, No. 5. Р. 778. DOI: 10.1080/00958970802376257.
- Jiang X., Chen L., Wei W., Lu L., Чуйко С.В. // Химическая физика и мезоскопия. 2009. V. 11. № 3. С. 322. EDN: PJIOCL.
- Семенов С.А., Мусатова В.Ю., Дробот Д.В., Джардималиева Г.И. // Журнал неорганической химии. 2020. Т. 65, № 1. С. 65–72. DOI: 10.31857/S0044457X20010146.
- Semenov S.A., Yu V., Musatova D.V., Dzhardimalieva G.I. // Russian Journal of Inorganic Chemistry. 2018. V. 63, No. 9. Р. 1217. DOI: 10.1134/S0036023618090164.
- Kretzschmar B.S.M., Assim K., Preuß A., Heft A. // RSC Adv. 2018. № 8. Р. 15632. DOI: 10.1039/c8ra02288g.
- Mu J., Perlmutter D.D. // Thermochimica Acta. 1981. V. 49. Р. 207. DOI: 10.1016/0040-6031(81)80175-X.
- Puzan A.N., Baumer V.N., Lisovytskiy D.V., Mateychenko P.V. // Journal of Solid State Chemistry. 2018. V. 260. P. 87. DOI: 10.1016/j.jssc.2018.01.022.
- Randhawa B.S., Gandotra K. // Journal of Thermal Analysis and Calorimetry. 2006. V. 85, No. 2. Р. 417. DOI: 10.1007/s10973-005-7120- y.
- Randhawa B.S., Kaur M. // Journal of Thermal Analysis and Calorimetry. 2007. V. 89, No. 1. Р. 251. DOI: 10.1007/s10973-005-7473-2.
- Пронин А.С., Семенов С.А. // Журнал неорганической химии. 2018. Т. 63, № 8. С. 1005. DOI: 10.1134/S0044457X18080196.
- Семенов С.А., Мусатова В.Ю. // Журнал неорганической химии. 2018. Т. 63, № 9. С.1195. DOI: 10.1134/S0044457X18090167.
- Siqueira A.P.C., Ionashiro E.Y., Bannach G., De Souza A.R., et al. // Thermochimica Acta. 2021. V. 698. P. 178892. DOI: 10.1016/j.tca.2021.178892.
- Luciano V.A., Perígolo D.M. // Fuel. 2020. V. 261. P. 116456. DOI: 10.1016/j.fuel.2019.116456.
- Sileo E.E., Morando P.I., Baumgartner W.C., Bless M.A. // Thermodinamica Acta. 1991. V. 184. P. 295. DOI: 10.1016/0040-6031(91)80031-d.
- Nunes W.D.G., Teixeir J. A., Ekawa B., do Nascimento A.L.C.S. et al. // Thermodinamica Acta. 2018. V. 666. P. 156. DOI: 10.1016/j.tca.2018.06.010.
- Dollimore D., Griffiths D.L. // Journal of Thermal Analysis. 1970. V. 2. Р. 229. DOI: 10.1016/0040-6031(82)85076-4.
- Gunnewiek R.F.K., Mendes C.F., Kiminami R.H.G.A. // Materials Letters. 2014. V. 129. P. 54. DOI: 10.1016/j.matlet.2014.05.026.
- Masoud M.S., Ali A.E., Elasala G.S., Kolkaila S.A. // Spectrochimica Acta. Part A: Molecular and Biomolecular Spectroscopy. 2018. V. 193, No. 15. P. 458. DOI: 10.1016/j.saa.2017.12.060.
- Bassi P.S., Randhawa B.S., Jamwal H.S. // Thermochimica Acta. 1983. V. 69. P. 367. DOI: 10.1016/0040-6031(83)80343-8.
- Bassi P.S., Randhawa B.S., Bilaspuri G.K. // Journal of Therrnal Analysis. 1986. V. 31. Р. 1007. DOI: 10.1007/BF02119254.
- Bassi P.S., Uppal P., Bilaspuri G.K. // Journal of Thermal Analysis. 1997. V. 49. P. 703. DOI: 10.1007/bf01996754.
- Sаnchez N.M., Klerk А. // Thermochimica Acta. 2018. No. 662. Р. 23. DOI: 10.1016/j.tca.2018.01.015.
- Kumar N., Kachroo P.L., Kant R. // Journal of Thermal Analysis. 1979. V. 17. Р. 81. DOI: 10.1007/bf02156600.
- Wanjun T., Donghua С. // Chem. Pap. 2007. V. 61, No. 4. Р. 329. DOI: 10.2478/s11696-007-0042-3.
- Фейизоглу А., Алтун О. // Известия вузов. Северо-Кавказский регион. Естественные науки. 2003. № 3. С. 58.


