Термическое разложение природных полисахаридов: хитина и хитозана
Автор: Кучина Юлия Анатольевна, Долгопятова Наталия Владимировна, Новиков Виталий Юрьевич, Коновалова Ирина Никандровна, Принцева Мария Юрьевна, Сагайдачный Вадим Александрович
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 1 т.18, 2015 года.
Бесплатный доступ
Приведены результаты термического анализа креветочного хитина и хитозана (исследованы образцы полисахаридов, отличающиеся по степени деацетилирования). Термический анализ проведен методом дифференциальной термогравиметрии и дифференциальной сканирующей калориметрии. Рассчитана энергия активации процесса термической деструкции хитина и хитозана.
Северная креветка, хитин, хитозан, полисахарид, термический анализ, энергия активации
Короткий адрес: https://sciup.org/14294786
IDR: 14294786 | УДК: 541.64:547.458.81
Текст научной статьи Термическое разложение природных полисахаридов: хитина и хитозана
Полисахарид хитин широко распространен в природе и относится к возобновляемым сырьевым ресурсам. Химическая модификация хитина позволяет получить качественно новые продукты с повышенной пищевой и биологической ценностью для различных областей применения.
В данной работе проведен термический анализ хитина и хитозана, выделенных из северной креветки, и изучено влияние степени деацетилирования этих полисахаридов на процесс их термического разложения.
2. Объекты и методы исследования
В качестве объектов исследования использовали креветочный хитин, который выделяли последовательным удалением белковой и минеральной частей из хитинсодержащего сырья: депротеинизацией в 4%-й NaON с промывкой водой, деминерализацией в 3,6%-й HCl с последующей промывкой водой. Хитозан получали деацетилированием хитина в 50%-й NaOH при 100 С в течение 30 мин с последующей промывкой водой ( Новиков и др. , 2012). Степень деацетилирования хитозана определялась методом обратного потенциометрического титрования хлороводорода, связанного с аминогруппами молекул хитозана. Потенциометрическое титрование проводилось с использованием иономера "Анион"-4151 (НПП "Инфраспак-Аналит", Россия) с шагом 0,1 см3.
Степень деацетилирования нерастворимых образцов хитина и хитозана определялась методом инфракрасной спектроскопии (в таблетках KBr). Предварительно образцы измельчали на мельнице TI -100 ( CMT Co. , Ltd ., Япония). Спектры поглощения записывали на инфракрасном спектрофотометре IR -420 ( Shimadzu , Япония) в диапазоне частот от 4000 до 400 см–1. Была выбрана опорная частота, которая составила для исследуемых образцов 1 655 см–1 ( Новиков и др. , 2012).
Термический анализ проводили методом дифференциальной термогравиметрии (ДТГ) и дифференциальной сканирующей калориметрии (ДСК) с использованием прибора синхронного термического анализа Netzsch STA 449 F 3 Jupiter . Термограммы снимали в следующих условиях: тигель корундовый, атмосфера – воздух, температурный интервал 40-600 С, скорость нагрева образцов 15 С / мин, масса навесок 20-25 мг.
Характеристики образцов хитина и хитозана и условия их получения приведены в таблице.
Таблица. Характеристика образцов хитина и хитозана
|
Номер образца |
Время обработки 50%-й NaOH, мин |
Степень деацетилирования, % |
|
1 |
5 |
10 |
|
2 |
10 |
55 |
|
3 |
20 |
60 |
|
4 |
40 |
66 |
|
5 |
60 |
66 |
3. Результаты и их обсуждение
На основе данных, указанных в таблице, были составлены графики, отражающие результаты исследования образцов 1-5 (скорость нагревания 15 °С/мин). Показатели, полученные в ходе термогравиметрического анализа (ТГ-кривые), приведены на рис. 1; дифференциальные термогравиметрические кривые (ДТГ-кривые) – на рис. 2; результаты дифференциальной сканирующей калориметрии (ДСК-кривые) – на рис. 3.
тг,«»
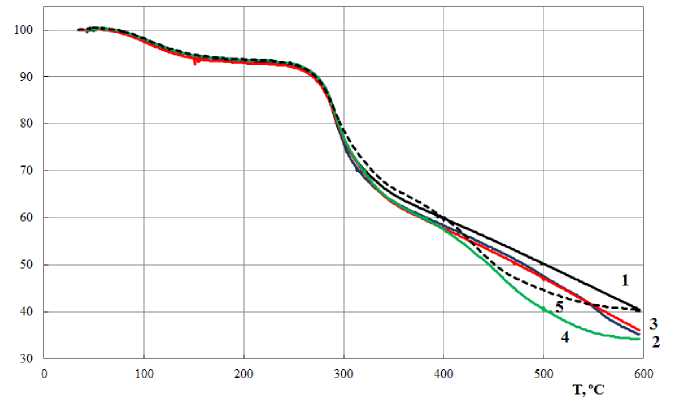
Рис. 1. Кривые потери массы при термическом разложении полисахаридов
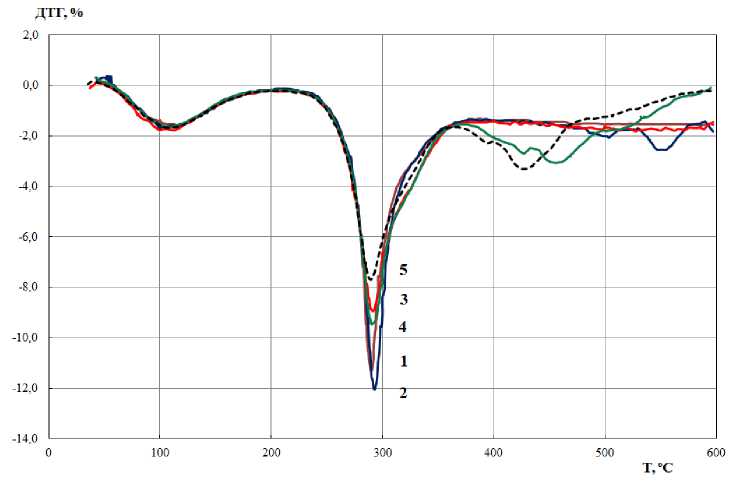
Рис. 2. Дифференциальные термогравиметрические кривые разложения полисахаридов
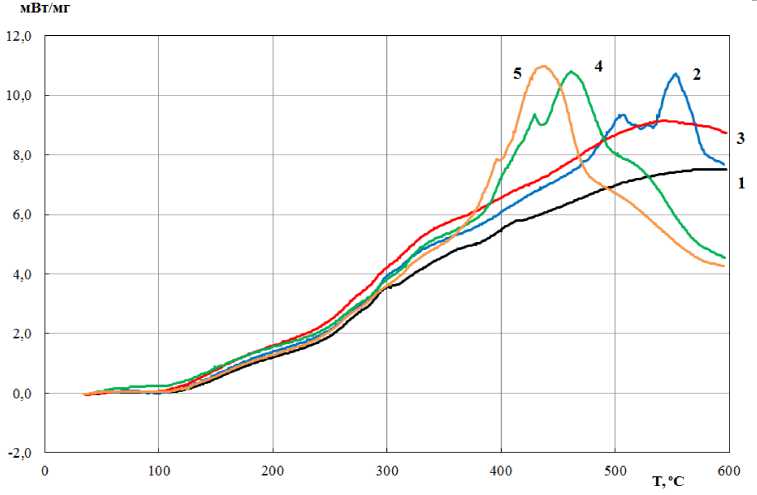
Рис. 3. Результаты дифференциальной сканирующей калориметрии
Известно, что вид кривых ТГ и ДТГ зависит от гетерогенного характера термического разложения, протекания различных химических реакций, разрушения водородных связей, конформационных и фазовых переходов ( Шестак , 1987). При термическом разложении, видимо, будет протекать процесс термоокислительной деструкции хитина и хитозана, сопровождающийся разрушением гликозидных и ацетамидных связей (рис. 4).
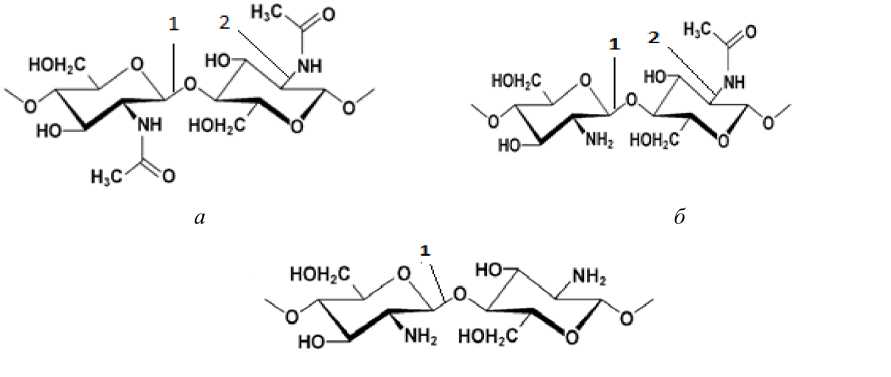
в
Рис. 4. Структурная формула хитина ( а ), частично деацетилированного хитина ( б ) и хитозана ( в ); 1 – гликозидные связи; 2 – ацетамидные связи
Данные, приведенные на рис. 1 и 2, свидетельствуют о том, что потеря массы в интервале температур 40-600 С происходит в три этапа. На кривых ТГ и ДТГ указаны два значения температуры, соответствующие максимальной скорости потери массы: 100-110 и 290-295 С. При температуре 100-110 С на кривых ДСК (рис. 3) имеется эндотермический пик, соответствующий удалению из образцов адсорбционной воды. При температуре 100-110 С потеря массы всех образцов составляет 5-10 %, скорость потери массы равна 1,5-2 % в минуту. Анализ ДТГ-кривых (рис. 2) показал, что десорбция связанной воды происходит до температуры 150-200 С. Этот факт можно объяснить затрудненностью разрыва водородных связей между молекулами воды и полярными функциональными группами полисахаридов ( Осовская и др. , 2010).
Температура, при которой скорость разложения образцов максимальна, равна 290-295 С (рис. 2) и не зависит от степени деацетилирования образцов. Однако скорость потери массы образцов (максимальная скорость деструкции) при этой температуре (глубина пика) зависит от степени деацетилирования, составляющей для образцов 1 и 2 11-12 % в минуту, для образцов 3 и 4 – 9, для образца 5 – 7,6 % в минуту.
Таким образом, с увеличением степени деацетилирования скорость потери массы образцов (скорость деструкции) уменьшается в 1,5 раза. В работе ( Долгопятова и др. , 2011) показано, что скорость деструкции и полной деполимеризации хитина и хитозана уменьшается с увеличением степени деацетилирования.
При нагревании образцов выше 300-400 С развивается термоокислительная деструкция, приводящая к потере массы образцов примерно до 40 %.
На кривых ДСК (рис. 3) при температуре 430-540 С наблюдаются экзотермические пики (примерно одинаковые по величине и равные 8-9 мВт / мг). С увеличением степени деацетилирования экзотермические пики становятся более выраженными и смещаются в сторону более низких температур: с 510 С (образец 1) до 430 С (образцы 4, 5).
Наличие экзотермических пиков на кривых ДСК можно объяснить горением газообразного продукта, образующегося при разложении уксусной кислоты. Уксусная кислота выделяется при термическом деацетилировании хитина. При температуре выше 430 С разложение уксусной кислоты сопровождается образованием и горением метана и протекает по реакции
2СН 3 СООН = СО 2 + СН 4 + 2С + 2Н 2 О.
Нагрев образцов до 600 С приводит к дальнейшей потере массы вплоть до образования скоксованного остатка. Потеря массы образцов 1-3 составила 68-70 %, образцов 4, 5 – 60 %. Полученные экспериментальные данные согласуются с литературными сведениями. Так, в работе ( Роговина и др ., 2010) установлено, что изменение массы при деструкции хитина составляет 70 %, а хитозана (со степенью деацетилирования 87 %) – 54 %. Максимальная скорость потери массы для хитина наблюдается при температуре 375 ОС, а для хитозана - при 298 ° С. К сожалению, авторами этой работы не указано, из какого хитинсодержащего сырья получены хитин и хитозан.
В процессе обработки результатов термического анализа используют метод Фримена – Кэрролла ( Шестак , 1987). Для описания процесса термического разложения твердых веществ предложено уравнение линейной регрессии ( Петрюк и др. , 2010), которое описывает кинетику термического разложения и позволяет рассчитать энергию активации процесса Е :
∆ln(Rt) = n∆ln(W) – (E / R)(1/ T), где Rt = dW / dT – скорость потери массы образца; R – универсальная газовая постоянная; Т – температура, К; W – масса образца, вступившая в реакцию; Е – энергия активации.
Энергию активации, рассчитанную этим методом, называют эффективной. Величина эффективной энергии активации термического разложения является одним из важнейших показателей, который характеризует устойчивость природных и синтетических полимеров к действию высоких температур. Энергия активации используется также при изучении механизмов термической деструкции, старения и стабилизации полимерных материалов.
При линеаризации экспериментальных данных ТГ (рис. 1) с помощью метода Фримена – Кэрролла кинетические кривые термического разложения хитина и хитозана были построены в координатах ln( R t ) = ƒ(1 / Т ). На рис. 5 приведен пример графического определения эффективной энергии активации разложения для образца 2.
Процесс термической деструкции исследованного образца (рис. 5) можно разбить на три линейных температурных интервала: 100-240, 240-300 и 320-600 °С. Эти температурные интервалы соответствуют стадиям потери образцом адсорбционной воды, максимальной скорости термоокислительной деструкции, стадии образования скоксованного остатка.
Построение кинетических кривых в координатах ln( R t ) = ƒ(1 / Т ) позволило определить энергию активации процесса разложения образцов хитина и хитозана на этих стадиях, поскольку тангенс угла наклона данных зависимостей соответствует величине (– Е / R ).
Расчеты показали, что стадии потери адсорбционной воды для исследованных образцов соответствует энергия активации процесса Е , равная 10-11 кДж / моль, стадии максимальной скорости термоокислительной деструкции – Е = 56-65 кДж / моль, образованию скоксованного остатка – Е = 7,7-8,4 кДж / моль.
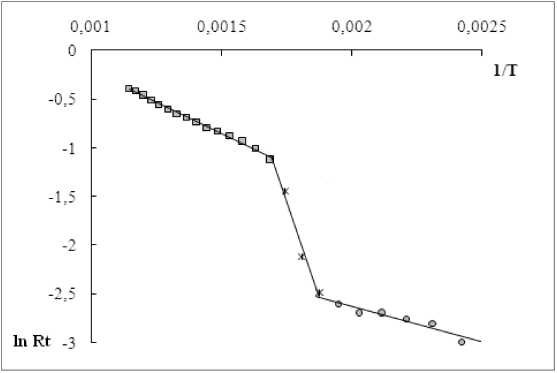
Рис. 5. Линеаризация экспериментальных данных термогравиметрии методом Фримена – Кэрролла
4. Заключение
Приведены результаты термогравиметрического анализа креветочного хитина и хитозана с различной степенью деацетилирования. Температура, при которой скорость разложения образцов максимальна, составляет 290-295 С и не зависит от степени деацетилирования образцов. Скорость потери массы образцов при температуре 290-295 С обусловлена степенью деацетилирования. Энергия активации процесса разложения образцов хитина и хитозана на стадии максимальной скорости термоокислительной деструкции, рассчитанная по методу Фримена – Кэрролла, составляет 56-65 кДж/моль.
Список литературы Термическое разложение природных полисахаридов: хитина и хитозана
- Долгопятова Н.В., Новиков В.Ю., Коновалова И.Н. Влияние степени деацетилирования на скорость кислотной деструкции хитина и хитозана и выход гидрохлорида D(+) глюкозамина. Журн. приклад. химии. 2011. Т. 84, № 10. С. 1734-1738
- Новиков В.Ю., Коновалова И.Н., Долгопятова Н.В. Химические основы технологии получения хитина и его производных из панциря ракообразных. СПб., ГИОРД, 2012. 208 с
- Осовская И.И. и др. Хитин-глюкановые комплексы. Физико-химические свойства и молекулярные характеристики. Учебное пособие. Изд-во Санкт-Петербургского гос. технологического университета растительных полимеров, 2010. 52 с
- Петрюк И.П., Гайдадин А.Н., Ефремова С.А. Определение кинетических параметров термодеструкции полимерных материалов по данным динамической термогравиметрии. Метод. указания. Волгоград, ВолгГТУ, 2010. 12 с
- Роговина С.З. и др. Исследование термостабильности смесей на основе синтетических полимеров и природных полисахаридов. Химия растительного сырья. 2010. № 4. С. 45-50
- Шестак Я. Теория термического анализа. М., Мир, 1987. 456 с


