Термодинамические свойства нитрида ванадия
Автор: Шишков Владимир Иванович, Жихарев Владилен Михайлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 15 (274), 2012 года.
Бесплатный доступ
Термогравиметрическим методом в интервале давлений 0,5.1000 гПа при температурах 1573.1923 К изучено равновесие с азотом мононитрида ванадия в его области гомогенности и в гетерогенной системе VN x-V 2N y. С помощью термодинамической модели, основанной на методе параметров взаимодействия К. Вагнера, получено уравнение зависимости упругости диссоциации нитрида VN x от его состава и температуры. Рассчитаны стандартные энергии Гиббса образования стехиометрического нитрида при 1500...2000 К и дано уравнение расчета энергии образования нестехиометрического нитрида заданного состава при указанных температурах.
Мононитрид ванадия, равновесное давление азота, термогравиметрия, параметры взаимодействия, термодинамические расчёты
Короткий адрес: https://sciup.org/147156719
IDR: 147156719 | УДК: 669.292.5+536.7
Текст научной статьи Термодинамические свойства нитрида ванадия
Фазовые равновесия большинства систем переходный металл – азот до сих пор остаются невыясненными, а отрывочные сведения о термодинамических свойствах нестехиометрических нитридов – противоречивыми. Немногочисленные сведения об упругости диссоциации мононитрида ванадия обесценены отсутствием указаний о составе диссоциирующего нитрида.
Задача настоящей работы – установить зависимость состава мононитрида ванадия от давления и температуры с целью получения термодинамических характеристик фазы.
Опыты проводили на специально изготовленной установке (рис. 1), основными частями которой являются печь 14, микровесы 16, манометры 12 и 13 и система очистки и контроля очищения азота от примесей [1].
Состав нитридной фазы определяли методом непрерывного взвешивания на коромысловых весах с крутильной нитью из вольфрама диаметром 40 мкм, оборудованных системой электромагнитного уравновешивания. Максимальная нагрузка весов составляет 1 г, абсолютная чувствительность 10–6 г. При определении состава нитрида весовым методом был учтен эффект псевдоизменения массы образца. Учет ошибок в измерении температуры и давления дает предельную абсолютную погрешность в определении состава нитрида Δ x = 0,005.
Исходными материалами были порошкооб- разный металлический ванадий марки ВЭЛ-1 и технический азот, подвергнутый перед использованием тщательной очистке от следов кислорода.
После того как вольфрамовый тигелек диаметром 6 мм, высотой 8 мм и весом 230 мг с навеской ванадия (520 мг) был подвешен на одно плечо коромысла на длинной молибденовой нити диаметром 12 мкм, заканчивающейся вольфрамовой цепочкой, установку вакуумировали до давления 10–3 мм рт. ст., потом 4–5 раз промывали чистым азотом и затем печь наполняли азотом при непрерывном контроле за его чистотой. После подачи первых порций газа печь включали в сеть, и одновременно с набором газа до атмосферного давления происходило образование нитрида при взаимодействии ванадия с азотом сначала при 1000…1100 °С, затем при температуре опыта. О ходе взаимодействия в системе судили по изменению массы и давления. Прекращение этих изменений при постоянной температуре указывало на наступление равновесия. После некоторой выдержки образца в равновесном состоянии давление и температура изменялись и опыты проводились при других условиях.
Истинность установления равновесных состояний проверяли путем достижения равновесия как со стороны диссоциации нитрида, так и со стороны его азотирования, то есть при откачке и напуске азота, либо в условиях повышения или
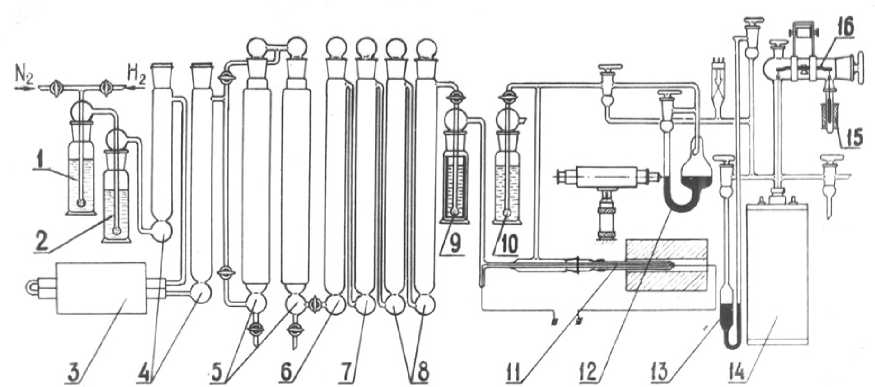
Рис. 1. Схема установки для исследования термодинамических свойств нитридов: 1– серная кислота; 2 – щелочь; 3 – медь (650 °С); 4, 6 – хлорид кальция; 5 – активная медь (200 °С); 7 – силикагель; 8 – ангидрон; 9 – амальгама алюминия; 10 – затворная склянка; 11 – гальваническая ячейка; 12, 13 – манометры; 14 – печь; 15 – соленоид; 16 – микровесы
понижения температуры. Граничные равновесные давления находились методом сужения, то есть по знаку изменения массы образца при изменении давления вблизи его граничного значения. Образование в образце наряду с мононитридом новой фазы – субнитрида ванадия обнаруживается по непрерывной убыли массы образца при поддержании давления в системе ниже равновесного для гетерогенной смеси.
Опыты проведены в интервалах температур 1300…1650 °С и давлений от 0,5 до 760 мм рт. ст. Для оценки воспроизводимости результатов в каждом опыте использовали 2–3 образца. Результаты исследования графически представлены на рис. 2.
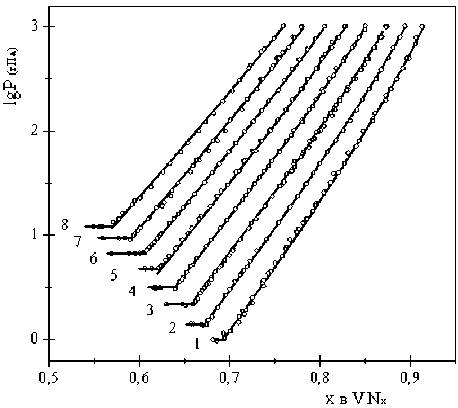
Рис. 2. Зависимость равновесного давления азота (гПа) от состава нитрида VN x при температурах (°С): 1300 (1), 1350 (2), 1400 (3), 1450 (4), 1500 (5), 1550 (6), 1600 (7) и 1650 (8)
Наклонные участки изотермических зависимостей соответствуют области гомогенности мо- нонитрида, горизонтальные – области гетерогенного равновесия моно- и низшего нитрида ванадия, что подтверждается также данными рентгеноструктурного анализа охлажденных образцов. Результаты эксперимента показывают, что упругость диссоциации нитрида ванадия в зависимости от его состава в исследованной части области гомогенности изменяется на 2–3 порядка. Это свидетельствует о значительном изменении термодинамической устойчивости нитрида при различных внешних условиях. Замечено, что состав нитрида в области гомогенности существенно изменяется даже при весьма быстром охлаждении его с высоких температур. При понижении температуры образца на 450…500 °С за первую минуту состав нитрида меняется на Δх = 0,05…0,10. Погрешность расчета состава нитридной фазы составляет 0,02 %. Суммарная погрешность, учитывающая и ошибки в измерении давления и температуры, равна 0,57 %.
Для термодинамической характеристики нестехиометрический нитрид ванадия мо ж но представить как твердый раство р ванадия и нитрида стехиометрического состава, а взаимодействие его с газообразным азотом описать уравнени е м
(V)+2n = (VN).(1)
Усл о вие равновесия реакции (1)
^(V) + 2 ^N2 = ^(VN).
Химические потенциалы реа г ентов
^(V) = GV + RT ln x(V) + RT ln y(V);(3)
^n2 = Gn 2 + RT In Pn2;(4)
^(VN) = GVN + RT ln x (VN) + RT ln T(VN).
Здесь GV и GVN - молярные энергии Гиббса чистых ванадия и стехиометрического нитрида; GN2 - молярная энергия Гиббса азота при давлении 1 атм (1013 гПа); х(V) и х(VN) - мольные доли ванадия и стехиометрического нитрида в нитриде переменного состава VNх; Y(V) и Y(VN) — коэффициенты активности компонентов относительно стандартного состояния «чистый компонент» (стандартное состояние по Раулю).
После подстановки выражений (3)-(5) в условие равновесия (2) получим
I (2) - -
I 2 =
T
- 2,175.
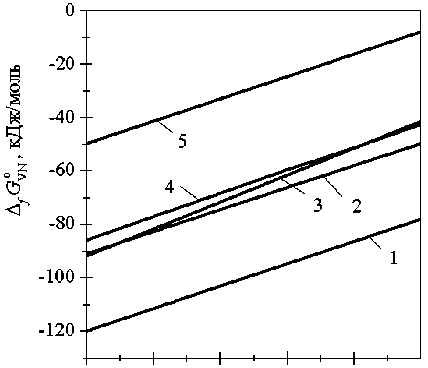
На рис. 3 представлены результаты расчета
A f G VN по данным различных авторов. Как видно
из него, наши данные хорошо согласуются со справочными данными Бужека [4] и Туркдогана [5].
2 RT in P n2 = G Vn - G V + RT ( in Y (VN) - in Y (V) ) . Разность G V n - G V - 2 G N2
_
1 г"
2 G N
+
rt h
X
х (V)
- это стандартное из-
менение энергии Гиббса при образовании 1 моль стехиометрического нитрида из ванадия и азота ( P N2 = 1 атм).
Логарифмы коэффициентов активности компонентов разлагаем по методу Вагнера [2] и Лю-писа [3] в ряды Тейлора
1500 1600 1700 1800 1900 Г, К
Рис. 3. Зависимость стандартного изменения энергии Гиббса при образовании 1 моль стехиометрического нитрида от температуры по данным различных авторов: 1 – Самсонов Г.В. [7], 2– Туркдоган Е.Т. [5], 3 – наш расчет, 4 – Бужек З. [4], 5 – Эллиотт Д.Ф., Глейзер М. [6]
n
n
i = 0
i = 0
В этих разложениях в качестве переменной выбрана мольная доля другого компонента, а величины
I (1) =I 1 i
d i in у1 | d x? I
2 V X 2 — 0
и
т (2) = I 1 i I
d i in у 2
d x 1
Образование нестехиометрического нитрида VN х из (1 - х ) моль ванадия и х моль стехиометрического нитрида можно рассматривать с двух
X | —> 0
называют параметрами взаимодействия i -го порядка. Если в разложениях (7) ограничиться порядком n = 3 , то выражения для коэффициентов активности запишутся в виде:
in Y 1 = I 7 X 2 - 3 ( I S') - 1 22) ) X 3 ; in Y 2 = 1 Г 4 - 3 ( 1 22) - 1 '/ ) X 2 .
Если записать химическую формулу нестехиометрического нитрида VN х , то нетрудно показать, что
X (V) = X ! = 1 - X и X (VN) = X 2 = X ,
а уравнение (6) тогда примет окончательный вид:
1 - X 2Д fGVN in PN + 2 in----=--+
N2 х RT
- 2 X + X 2
точек зрения:
-
1) химическая реакция
(1 - х )V + хVN = VN х,(16)
для которой
ArG" =AfGVnx - xAfGVn ;(17)
-
2) растворение ванадия в стехиометрическом нитриде
AmG " = (1 - х) AmG(V) + X A mG(VN),(18)
где A m G (V) — парциальное изменение энергии Гиббса при переходе 1 моль ванадия из чистого состояния в нитрид данного состава:
AmG(V) =Д(У) - GV .(19)
Здесь химический потенциал ванадия в растворе (нитриде)
P(V) = GV + RT in a $ с активностью его л (R) - r a (V) = х (V)
(R)
Y (V)
Результаты расчета по опытным данным В.М. Жихарева и В.И. Шишкова [1]:
A f G V N =- 243100 + 100,82 T , Дж/моль; (13)
I (у =- 24963 + 8,955;
2 T
и долей (21)
X (V) = 1 - X .
Поэтому
A m G (V) = RT [in(1 - x ) + in у$ ]. (22)
Аналогично
AmG (VN) = RT [h x + In y(VN) ].
Подставив (22) и (23) в (18), получим
A m G ° = (1 - x ) RT [ln(1 - x ) + In Y$ ] +
-
+ xRT [ln x + In Y (RN) ].
Так как A rG ° = A mG ° , то
A f G V n x = x A f G VN + RT [ (1 - x )ln(1 - x ) +
-
+ x In x + (1 - x )ln Y (R) + X In Y(VN) ].
Другие термодинамические свойства нестехиометрического нитрида VN х могут быть рассчитаны на основании общих положений химической термодинамики.
Список литературы Термодинамические свойства нитрида ванадия
- Изучение термодинамических свойств мононитрида ванадия. Сообщение 1/В.А. Кожеуров, B.М. Жихарев, В.И. Шишков, Г.В. Грицишина//Изв. вузов. Черная металлургия. -1972. -№ 8. -С. 10-13.
- Вагнер, К. Термодинамика сплавов/К. Вагнер. -М.: Металлургиздат, 1957. -179 с.
- Люпис, К. Химическая термодинамика материалов/К. Люпис. -М.: Металлургия, 1989. -502 с.
- Buzek Z. Zakladni termodynamicke udaje о metalurgickych reakcich а о interakcich prvko v soustavach vyznamnych pro hutnickou teorii а praxi/Z. Buzek//Hutnicke actuality. -1979. -Т. 20, № 1-2. -C. 1-111.
- Туркдоган, Е.Т. Физическая химия высокотемпературных процессов/Е.Т. Туркдоган. -М.: Металлургия, 1985. -344 с.
- Эллиотт, Д.Ф. Термохимия сталеплавильных процессов/Д.Ф. Эллиотт, М. Глейзер. -М.: Металлургия, 1969. -252 с.
- Самсонов, Г.В. Нитриды/Г.В. Самсонов. -Киев: Наукова думка, 1969. -378 с.


