Термодинамический анализ фазовых равновесий при раскислении хромсодержащих сталей марганцем и цирконием
Автор: Макровец Лариса Александровна, Михайлов Геннадий Георгиевич, Выдрин Дмитрий Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 15 (274), 2012 года.
Бесплатный доступ
Рассмотрены термодинамические особенности процессов взаимодействия кислорода, хрома, марганца, углерода и циркония в жидком железе. Рассчитана диаграмма состояния Cr 2O 3-MnO-ZrO 2 и подобраны параметры субрегулярной теории для жидких и твердых растворов на основе оксида циркония. Построены поверхности растворимости кислорода в жидком металле системы Fe-Cr-Mn-Zr-O-C. Изучено влияние температуры на раскислительную способность марганца и циркония в жидкой хромсодержащей стали. Результаты работы могут быть использованы при разработке технологии рафинирования стали сплавами и лигатурами, содержащими цирконий.
Цирконий, фазовые диаграммы, фазовые равновесия, термодинамическое моделирование
Короткий адрес: https://sciup.org/147156723
IDR: 147156723 | УДК: 536.7:669.15
Текст научной статьи Термодинамический анализ фазовых равновесий при раскислении хромсодержащих сталей марганцем и цирконием
Значительный интерес к использованию циркония при выплавке как сплавов специального назначения, так и марганцовистых и хромистых сталей был вызван развитием атомной энергетики. При вводе циркония в металл отмечается повышение теплостойкости, улучшение обрабатываемости и свариваемости, измельчение первичного зерна, модифицирование неметаллических включений стали и сплавов. Однако литература по вопросам раскисления цирконием даже конструкционных сталей ограничена. Представляет интерес термодинамический анализ процессов взаимодействия циркония, введенного в сталь, с кислородом в присутствии других элементов, например, хрома, марганца и углерода.
Для проведения термодинамического анализа процессов взаимодействия марганца, хрома и циркония с кислородом использована теория субрегулярных ионных растворов в приближении о квадратичной от состава зависимости энергий смешения [1]. Предварительный анализ показал, что при концентрациях марганца, хрома и циркония в стали, представляющих интерес, состав неметаллический включений определяется сопряженной с об- ластью существования металлических расплавов системой Cr2O3–MnO–ZrO2 . Активности компонентов оксидного расплава рассчитываются по теории субрегулярных ионных растворов, в частности, для этого трехкомпонентного расплава имеют вид [1]:
lg a ( Cr2o3 ) = 2lg X 1 + 2lg Y i = 2lg X 1 + 2 [ З x i 2 X 2 6 1112 +
+ x x 22 ( 2 - 3 x j ) 6 1 122 + X 2 ( 1 3 X 1 ) 6 1222 +
+ 3 X 1 x 3 ( 1 — X 1 ) 6 1113 + X 1 x 3 ( 2 - 3 X 1 ) 6 1133 +
+ X 3 ( 1 - 3 X 1 ) 6 1333 - 3 XIX 3 ( 1 - X 1 ) Q 2223 — 3 X 2 X 3 Q 2233 —
-
— 3 X 2 X 3 ( 1 - 3 X 1 ) 6 2333 + X 1 X 2 X 3 ( 2 - 3 X 1 ) Q 1123 +
+ X 2 X 3 ( 1 - 3 X 1 ) 6 1223 + X 2 X 3 2 ( 1 — 3 X 1 ) 6 1233 ] /( 2 3 RT ) ; (1)
lg a ( MnO ) = lg X 2 + [ X 1 ( 1 - 3 X 2 ) 6 1112 +
+ X 1 X 2 ( 2 — 3 X 2 ) 6 1122 + 3 X 1 X 2 ( 1 — X 2 ) 6 1222 —
-
- 3 X 1 X 3 6 1113 — 3 X 1 X 3 ( 2 — 3 X 1 ) 6 1133 — 3 X 1 X 3 6 1333 +
+ 3 X 2 X 3 ( 1 — X 2 ) 6 2223 + X 2 X 3 ( 2 — 3 X 2 ) 6 2233 +
+ X 3 ( 1 — 3 X 2 ) 6 2333 + X 1 X 3 ( 1 — 3 X 2 ) 6 1123 +
+ % i x 2 x 3 ( 2 — 3 x 2 ) Q 1223 +
+ X i x 3 2 ( 1 - 3 x 2 ) Q 1233 ] /( 2,3 RT ) ; (2)
lg a ( ZrO2 ) = lg X 3 + [- 3 X 3 X 2 Q 1112 - 3 X1 x 2 Q 1122 -
-
- 3 X 1 x 2 Q 1222 + X 1 ( 1 - 3 x 3 ) Q 1113 + X 1 x 3 ( 2 - 3 x3 ) Q 1133 +
+ 3 X 1 x 3 ( 1 - x 3 ) Q1333 + x 2 ( 1 - 3 x 3 ) Q 2223 +
+ x 2 x 3 ( 2 - 3 x 3 ) Q 2233 + 3 x 2 x 3 ( 1 - X 1 ) Q2333 +
+ X 1 x 2 ( 1 - 3 x 3 ) Q1123 + X 1 x 2 x3 ( 2 - 3 x 2 ) Q 1223 +
+ X 1 X 3 2 ( 1 - 3 X 2 ) Q 1233 ] /( 2,3 RT ) , (3)
где x 1 , x 2 , x 3 – ионные доли катионов Cr 3+ , Mn2+ , Zr4+ в оксидном расплаве, Qijkl – энергетические параметры теории.
По аналогичным формулам рассчитывали активности компонентов твердого раствора Cr2O3, MnO, ZrO2. Параметры теории субрегулярных ионных растворов для твердых растворов подставляли в формулы (1)-(3) в виде Q ijkl .
В таблице приведены энергетические параметры теории субрегулярных ионных растворов для твердых (Qijkl) и жидких (Qijkl) растворов системы FeO –Cr2O3–MnO–ZrO2 . Двойные оксидные диаграммы исследованы ранее [2–4]. В литературе приведено ограниченное число тройных диаграмм состояния с ZrO2, чаще всего есть только упоминание о наличии соединений и твердых растворов, а сами диаграммы не приводятся. Поэтому по информации, основанной на свойствах бинарных оксидных систем, были рассчитаны ранее диаграммы состояния тройных систем FeO–ZrO2–MnO [2] и FeO –ZrO2–Cr2O3 [3].
На рис. 1 приведена расчетная модель диаграммы состояния системы Cr2O3 – MnO –ZrO2 . В соответствии с этой диаграммой в равновесии с жидким металлом могут находиться фазы: кристаллический Cr2O3, MnCr2O4 с незначительной примесью FeO , MnO с незначительной примесью FeO , твердые растворы на основе ZrO2 и оксидный расплав (FeO , Cr2O3, MnO , ZrO2 ) переменного состава с незначительным количеством CrO.
На рис. 2, а, б приведены поверхности растворимости компонентов в жидком металле (ПРКМ) системы Fe–Cr–Mn–Zr–O, построенные по методикам, опубликованным в монографии [1]. Твердые растворы оксидов FeO, MnO и шпинелей
Энергетические параметры субрегулярной ионной теории для системы FeO - Cr2O3 - MnO - ZrO2
|
Система |
Параметры теории, Дж/моль·К |
||
|
FeO –Cr2O3 |
Q 1112 = –10 500 |
Q 1122 = –21 000 |
Q 1222 = –10 500 |
|
Q 1112 = 0 |
Q 1122 = 0 |
Q 1222 = 0 |
|
|
FeO–MnO |
Q 1113 = 0 |
Q 1133 = 0 |
Q 1333 = 0 |
|
Q 1113 = 0 |
Q 1133 = 0 |
Q 1333 = 0 |
|
|
FeO –ZrO2 |
Q 1114 = 13 550 |
Q 1144 = 7000 |
Q 1444 = 27 100 |
|
Q 1114 = 3684 |
Q 1144 = 73 680 |
Q 1444 = 36 840 |
|
|
Cr2O3 – MnO |
Q 2223 = 0 |
Q 2233 = 0 |
Q 2333 = 0 |
|
Q 2223 = 0 |
Q 2233 = 0 |
Q 2333 = 0 |
|
|
Cr2O3 – ZrO2 |
Q 2224 = 5370 |
Q 2244 = 33 700 |
Q 2444 = 27 600 |
|
Q 2224 = 68 650 |
Q 2244 = 137 300 |
Q 2444 = 68 650 |
|
|
MnO –ZrO2 |
Q 3334 = –48 780 |
Q 3344 = –81 260 |
Q 3444 = –2393 |
|
Q 3334 = 48 275 |
Q 3344 = 61 725 |
Q 3444 = 13 450 |
|
|
FeO–Cr2O3–MnO |
Q 1123 = 0 |
Q 1223 = 0 |
Q 1233 = 0 |
|
Q 1123 = 0 |
Q 1223 = 0 |
Q 1233 = 0 |
|
|
FeO–Cr2O3–ZrO2 |
Q 1124 = 62 760 |
Q 1224 = 62 760 |
Q 1244 = 83 680 |
|
Q 1124 = 146 450 |
Q 1224 = 167 400 |
Q 1244 = 209 200 |
|
|
FeO–MnO–ZrO2 |
Q 1134 = –41 840 |
Q 1334 = 125 500 |
Q 1344 = 62 760 |
|
Q 1134 = 20 920 |
Q 1334 = 125 500 |
Q 1344 = 209 200 |
|
|
Cr2O3–MnO–ZrO2 |
Q 2234 = 0 |
Q 2334 = 0 |
Q 2344 = 0 |
|
Q 2234 = 167 400 |
Q 2334 = 334 400 |
Q 2344 = 167 400 |
|
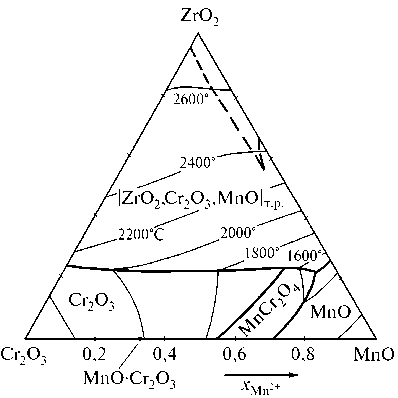
Рис. 1. Расчетная модель диаграммы состояния системы Cr2O3 - MnO - ZrO2
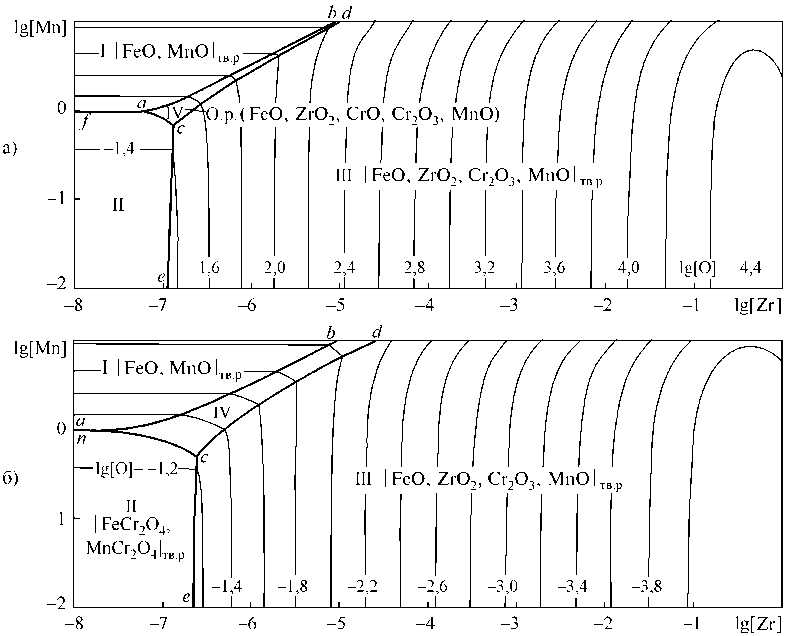
Рис. 2. ПРКМ системы Fe–Zr–Cr–Mn–O при 1873 K, [Cr] = 0,6 мас. %: а) Т = 1550 °С; б) Т = 1600 °С
FeCr2O4, MnCr2O4 при расчете координат ПРКМ считали совершенными растворами, активности компонентов этих растворов приравнивали мольным долям. Активности компонентов оксидного расплава и твердого раствора на основе ZrO2 (FeO , Cr2O3, MnO , ZrO2 ) рассчитывали по теории субрегулярных ионных растворов [1]. В связи с отсутствием надежных экспериментальных данных активность CrO в оксидном расплаве опреде- ляли как в совершенном ионном растворе, то есть приравнивали ионной доле Х(C 2+).
На ПРКМ заданы области составов металла, равновесного с различными оксидными фазами. Жидкий металл, состав которого попадает на определенный участок поверхности, находится в равновесии с неметаллической фазой, указанной в этой области. Например, в области I заданы составы жидкого металла, равновесного с твердыми
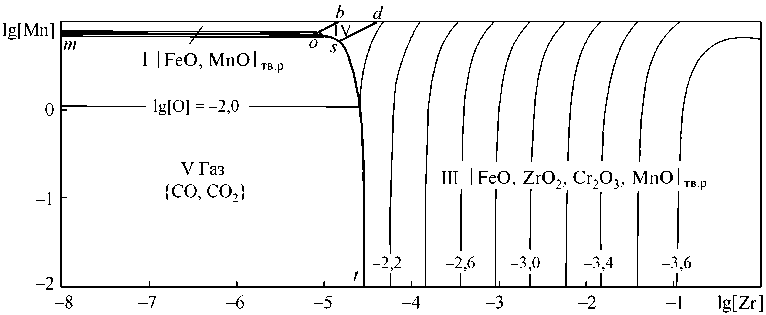
Рис. 3. ПРКМ системы Fe–Zr–Cr–Mn–O–C при 1873 К, [Cr] = 0,6 мас. %, [C] = 0,3 мас. %, P общ = 1 атм
растворами оксидов FeO, MnO . Если состав металла попадает на границу двух участков, то металл находится в равновесии с двумя неметаллическими фазами. Например, на линии ab заданы составы металла, равновесного с твердым раствором оксидов FeO, MnO и оксидным расплавом. Тонкими линиями показаны сечения поверхности растворимости плоскостями постоянной концентрации кислорода в металле.
Из вида ПРКМ, построенной при [Cr] = = 0,6 мас. % (см. рис. 1), следует, что равновесие с кристаллическим Cr2O3 не реализуется. Область составов металла, равновесного с жидкой оксидной фазой, развита крайне незначительно. При реальных концентрациях циркония в металле (порядка десятых долей процента) в равновесии с жидким металлом могут находиться только твердые растворы на основе ZrO2 .
На рис. 3 приведены результаты расчетов фазовых равновесий для изучаемой системы в присутствии углерода (0,3 мас. %). Видно, что в этом случае возможно лишь образование в равновесии с металлом твердых неметаллических фаз.
Выводы
-
1. В результате термодинамического анализа установлены энергетические параметры как для жидких, так и для твердых оксидных растворов на основе ZrO2 .
-
2. Установлено влияние температуры (1550 и 1600 °С) и содержания углерода (0,3 мас. %) на
-
3. В связи с высокой химической активностью циркония при модифицировании стали цирконием следует предварительно раскислять сталь присадками сильных раскислителей (алюминием или кальцием).
последовательность фазовых превращений при раскислении хромсодержащей стали марганцем и цирконием.
Список литературы Термодинамический анализ фазовых равновесий при раскислении хромсодержащих сталей марганцем и цирконием
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем: моногр./Г.Г. Михайлов, Ю.С. Кузнецов, Б.И. Леонович. -М.: Изд. Дом МИСиС, 2009. -520 с.
- Михайлов, Г.Г. Термодинамика процессов взаимодействия кислорода, марганца и циркония в жидком железе/Г.Г. Михайлов, С.В. Свердина, Л.А. Чернова//Производство стали и ферросплавов. Теория и практика: юбилейный сб. науч. тр. -Челябинск: Изд-во ЮУрГУ, 1998. -С. 91-99.
- Михайлов, Г.Г. Термодинамика процессов взаимодействия кислорода, хрома и циркония в жидком железе/Г.Г. Михайлов, С.В. Свердина, Л.А. Чернова//Изв. вузов. Черная металлургия. -2000. -№ 1. -С. 4-6.
- Михайлов, Г.Г. Термодинамика процессов взаимодействия хрома, марганца и кремния с кислородом в жидком железе/Г.Г. Михайлов, Л.А. Чернова//Высокотемпературные расплавы. -1995. -№ 1. -С. 27-35.


