Термодинамический анализ и фазовые равновесия в системе железо-хром-углерод
Автор: Леонович Борис Иванович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 36 (169), 2009 года.
Бесплатный доступ
С использованием подрешеточной модели проведен термодинамический анализ трехкомпонентной системы железо-хром-углерод. Результаты расчета фазовых равновесий представлены в виде изотермических сечений и фазовых диаграмм. Приведена схема фазовых превращений в этой системе в сопоставлении с бинарными системами. Рассчитаны и построены политермические разрезы с постоянным значением концентрации хрома в сплаве. Работа выполнена в соответствии с научной программой Федерального агентства по образованию - «Развитие научного потенциала высшей школы (2009-2010 гг.)», код проекта - 713 и при поддержке РФФИ, грант № 08-08-00416.
Термодинамическая модель, фазовая диаграмма, система железо-хром-углерод
Короткий адрес: https://sciup.org/147156632
IDR: 147156632 | УДК: 544.344.013
Текст научной статьи Термодинамический анализ и фазовые равновесия в системе железо-хром-углерод
При термодинамическом анализе фазовых равновесий в трехкомпонентной системе Fe-Cr-C, необходимо знать свойства веществ, образующихся в двухкомпонентных системах железо-хром, железо-углерод и хром-углерод.
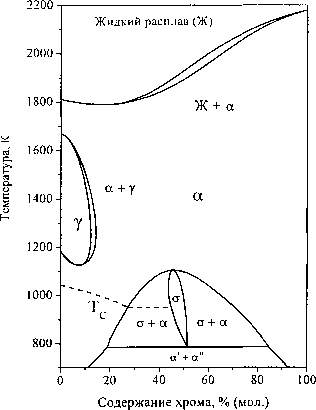
Термодинамический анализ системы железохром проведен в исследованиях [1, 2]. Установлено соответствие расчета и экспериментально определенного минимума линии ликвидуса при концентрации хрома ~17 мол. % и температуре 1516 °C. Хром стабилизирует о.ц.к. модификацию железа и образует с a-железом непрерывный ряд твердых растворов. Область твердых растворов хрома в г.ц.к. модификации железа сравнительно узкая и простирается до концентрации хрома ~14 % (мол.). Хром снижает температуру полиморфного а<^у превращения железа с 910 °C до ~850 °C при содержании хрома ~8,0 % (мол.) (рис. 1, а). При температуре ниже ^1100 К возможно образование упорядоченной сигма-фазы (а).
В системе железо-углерод в зависимости от температуры и концентрации углерода стабильными являются следующие фазы: феррит (а, 5), аустенит (у), жидкий расплав (Ж). Термодинамический расчет диаграммы состояния Fe-C выполнен в ряде исследований [3-5]. Диаграмма состояния этой системы представлена на рис. 1, б.
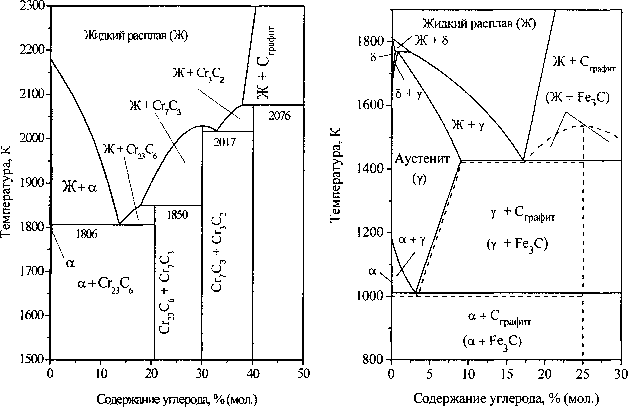
При взаимодействии хрома и углерода воз можно образование карбидов различного состава и структурного типа Сг23С6, Сг7С3 и Сг3С2. Диаграмма состояния системы хром-углерод (рис. 1, в) рассчитана по термодинамическим данным, приведенным в работе [6]. Из вида этой диаграммы следует, что в системе имеют место два эвтектических и два перитектических превращения, приводящих к выделению из жидкого расплава тугоплавких карбидов хрома различного состава.
Система железо-хром-углерод была предметом многочисленных экспериментальных и теоретических исследований [7-9]. Установлено, что в этой системе образуются трехкомпонентный жидкий раствор и тройные твердые растворы внедрения структуры о.ц.к. (феррит) и г.ц.к. (аустенит). Взаимодействие компонентов растворов приводит к образованию карбидов хрома и железа состава М3С, М7С3, М23Сб и Сг3С2, где М = Fe, Сг - компоненты металлической подрешетки.
Жидкий расплав. Молярная энергия Гиббса гомогенного трехкомпонентного сплава задается уравнением
а)
б)
Рис. 1. Диаграммы состояния двухкомпонентных систем: Fe-Cr (а), Сг-С (б), Fe-C (в)
где xt - молярные доли компонентов раствора; Ly - температурно-зависимые параметры модели, значения которых выражаются полиномами Ред-лиха-Кистера:
zv=4+4(x/-x7)+4(x/-x/)2. (2)
Парциальные молярные энергии Гиббса (химические потенциалы) могут быть вычислены по уравнению [10, 11]
из данных, приведенных в таблице. Параметры L вычисляются по формуле (2), а состав твердого раствора определяется мольными долями веществ в каждой подрешетке:
Ж = W(1 ”^с) иуРе + № = 1;
Ус = (я/фс/( 1 - ^с) и Ус + У У = 1 • (7)
В уравнении (5) в подстрочных индексах запятая разделяет компоненты в одной подрешетке, а
G,=H,=Gm + Z(4
7=2
9Gm OX,
Ч
двоеточие означает различие подрешеток.
Парциальные молярные энергии Гиббса гипо
где бу - символ Кронекера (S у = 0 при г ^ j и
тетических компонентов твердого раствора определяются следующим образом [12]:
Ьу= \ при / = у).
Значения параметров модели приведены в таблице.
О.ц.к. и г.ц.к. - твердые растворы внедрения. В таких растворах металлические вещества (железо и хром) образуют подрешетку замещения, а углерод и вакансии (V) - подрешетку внедрения. Тогда такой твердый раствор внедрения можно представить общей формулой (Сг,ГеХ(С,Р)с. В случае г.ц.к.-фазы а = с = 1, для о.ц.к.-фазы а = 1 и с = 3. Образование такого раствора можно также представить смешением гипотетических соединений СтаСс, СгаУС1 БеаСс и ¥еаУс, тогда молярная энергия Гиббса такого «четырехкомпонентного» раствора может быть задана уравнением
^т - УСгУу^СгУ + УСтУс^Сг.С + УреУу^РеУ +
+У?еУсСУ.С + ЯЛа(Ж 111 Ж + Уре 1п Ж ) +
+c(yc\nyc+yv\nyv) + G”6 +G^, (4)
где
^ ' ~ УСтУУе^Ус^СхУе.С + Уу^СхУеУ ) +
+УуУс (УСх^СхУР + У¥е^¥е;У,С )• (^)
Слагаемое G^ определяет магнитную составляющую энергии Гиббса. Её определение следует
Gij =6^+—— + —-- Ук"КГ ^У; дуу к=Сху^еу ^Ук
где i и j - элементы замещения и внедрения соответственно. Парциальные величины реальных компонентов определятся следующим образом:
Gj = GiV; Gc = G,c - С,.у.
Карбидные фазы. В трехкомпонентной системе железо-хром-углерод возможно образование смешанных карбидов стехиометрического состава различного структурного типа. Замещающие металлические элементы (железо и хром) в этих карбидах образуют одну или более подрешеток, в которых все вакантные междоузлия (вакансии) заполняются углеродом. Так что подрешетка внедрения является комплектной, а концентрация элемента внедрения (углерода) равна единице (ус = 1)-
Энергии Гиббса карбидов с одной металлической подрешеткой (хромзамещенный цементит (Сг,Ге)3С, (Сг,Ге)7С3, Сг3С2) определятся выра жением
^т ~ УСх^СхУ + Тге^Ре.С + ^1а(уСт 1п уСг +
+Ж 111 Уре )] + ЖМг,Г=:С - (9) где а - стехиометрический коэффициент элементов металлической подрешетки.
|
Фаза |
Параметр, Дж/моль |
Примеч. |
|
1 |
2 |
3 |
|
Жидкий расплав (Ж) |
С“(ж) - отграфит) =!! 7369 _ 24,637 G^ - G^°yK) = 24335> 93 -11,427 + 2,37615 • 10"2177 G^1 -Я2°98 =-16459 + 335,618-7-5071п7 G^ - G^f' = 12040,17 - 6,558437 - 3,6751551 ■ 10"2177 С°р - ^298 = -10839,7 + 291,3027 - 467 In 7 Z°Y =-90526-25,9117 Z1^ = 80000 Z^r = 80000 £^ж' =-124320 + 28,57 Z^e = 19300 Z^ =49260-197 L°^e =-14550 + 6,657 ^CAFe =-516700 4$,Fe = 75500 Z^Fe = 47310 |
T<2180K 7>2180 T<1811 7>1811 |
|
О.ц.к. -твердый раствор (а, 5); а=15 с=3 |
G^ - Я2°98 = -8851,93 +157,487 - 26,90871n7 -
G^K) - Я298 = -25384,451 + 299,312557 - 467 In 7 +2,2960305 -IO317"9 G^K) -G^ -зс^^афит) = 416000 V-zF.K-z VzF. V V уоСоцк) _GO(OUK) _зсо(графит) = 322050 +75,667 7 1C.V XV. V V/ Z Z® = -1907 Y™Ky =-1907 ^cr+e-v =20500-9,687 ^cr+e-c = -1750000 + 9407 G^ =7?71п(р + 1)/(т) . 1 Г . 79 158 ( 1 ,Y T4 T10 t16 Y тЛ|_ 140/2 497^ 2 45 200 J J 1 Гт"5 t"15 t"25 1 f ( т ) —------- Л|_ 10 315 1500 J , 518 Г 790 ( 1 ^1 1125[_ 497 J J p = 0,4 |
T<2180 7>2180 T<1811 7>1811 T<1 T>1 |
Окончание таблицы
|
1 |
2 |
3 |
|
Тс = -311,5_Усг +1043yFe + уСг>>ре[1650 + 550(jCr - yFe)] Р = -0,008^Сг + 2,22^ре - 0,85yCr_yFe |
||
|
_____ При отрицательных величинах Тс и Р, их значения следует поделить на -1 |
||
|
Г.ц.к. -твердый раствор (у); 0=1, с=\ |
G^ -G^0"^ = 7284 +0,163 Т G^ - G^ = -1462,4 + 8,2827 -1,157 In 7 + 6,4 ■ 10"4 72 G*™' - Я298 = -27098,266 + 300,252567 - 467 In 7 + 2,78854 • 10317"9 G°^ -G^ -б°(графит) = 25000 Gf^k) - С£№ - с^^афит) = 77207 -15,8777 L^.c = -26586-187 Z^v =-29686-187 ^=-34671 L^N =10833-7,4777 ®v = 14Ю |
|
|
(Fe,Cr)3C |
Gp^ - Я298 = -10745 + 706,047 -120,67 In 7 G°(M3C) -з^оС™») „^(графит) = -39744-18 087 Z^c =29260-16.637 |
|
|
(Fe,Cr)7C3 |
С^?Сз1 - Я298 = -209752 + 980,297 -170,57 In 7 - 0,069092172 GO(M7C3) _7(3о(оцк) _зсо(графит) = 113385-78,377 ZCr+e:C =-Ю465 |
|
|
(Fe,Cr)23C6 |
G^c6^-H^s =-521983 + 3622,247-620,9657 In 7-0,12643172 G^!6 1=20/ 23G“(r^3c6} + з / 23Gp^e23c6} Gp^23P6) = 20/23С“^2зСб) +3/23С°^33гСб) re.иг. u re.re.u cr.ur.v Gp^S?61 - 23 / 3Gp^3C) + 5 / зс°(графит) = 66920 - 407 ге.ге.и те.с с Тс™ Fe с = -252350 + 80,47 сг,ге.сг,г с. с ’ |
|
|
Cr3C2 |
°сУсС2) -Я2°98 =-103719+ 496,83477-84,34967In7-0,032709572 |
|
|
Сигма-фаза (о) |
Gv^crc, -22G°(°UK) -8GplruK) =92300-95,967 Л V.X-zI.VzI V-/1 А С GfeCrPe -4GiyuK)-8Gp<™K) + 18Gp•0',к, =117300-95,967 ГС.Сх.ГС JT V JL V |
|
|
С графит |
Отграфит) _ Ho^ = -17369 +170,737 - 24,371n7 - 4,723 • 10"4 72 + + 25626007’1 - 2,643 • 108 7-2 +1,2 ■ 1010 7"3 | |
|
Для карбида состава (Cr,Fe)23C6 установлено наличие двух металлических подрешеток, в которых располагаются совместно атомы хрома и железа. Общей формулой такого карбида является (Cr,Fe)20(Cr,Fe)3C6. Такое разделение металлов по двум подрешеткам (5 и t) позволяет представить энергию Гиббса такой системы уравнением
Gm= У Ст УСт^Сг.Сг.С + УСгУре^СгТе:С +
+УРеУСг^Ре:Сг:С + УРеУРе^РеТе^ +
+^ Л20(Усг In Усг + УРе !п Уре ) + ХУст b Усг + +Уре hl Уре )] + УсгУре (УСг^Сг,Ре:Сг:С +Уре^€г,Ре:Ре:с) + +УСгУре (УСг^Сг:Сг,Ре:С + Уре^Ре:Сг,Ре:С ) +
+УСгУРеУСгУРе^Сг,Ре:Сг,Ре:С • (10)
В этой формуле G£r.Fe.c и GFe:Cr:C определяются через энергии Гиббса подрешеток, содержащих разноименные металлы
23Gcr:Fe:C “ 20^Cr:Cr:C + ^^Fe:Fe:C ’ ^ ^
23GFe:Cr;C = 20GFe;Fe;C + 3GCr:Cr:C.
Парциальные молярные энергии гипотетических «компонентов» можно рассчитать по формуле
Gab.c =Gm Hl-Z^^Va-J^f ^-I Sy А ) V^b )
При использовании значении параметров модели (см. таблицу) будем иметь
^Cr:Fe:C ” ^Cr:Fe:C + ЖЖ (^Cr:Cr:C “ ^Cr:Fe:C “
~^Fe:Cr:C + ^Fe:Fe:C ) + 20 RT Ь yCr + 3RT Ь JFe +
"^УСтУре^УСт + У^е ”^ЖЖ)^Cr,Fe:Cr,Fe:C>
^Fe:Cr:C = ^Fe:Cr:C + ЖЖ (^Cr:Cr:C "^CrFe.C ~
—^Fe:Cr:C + C:Fe:C ) + 20 RT b Ж + 3^ThyCr +
+ЖЖ(Ж + Ж ”^УсхУ^^Сх^е^
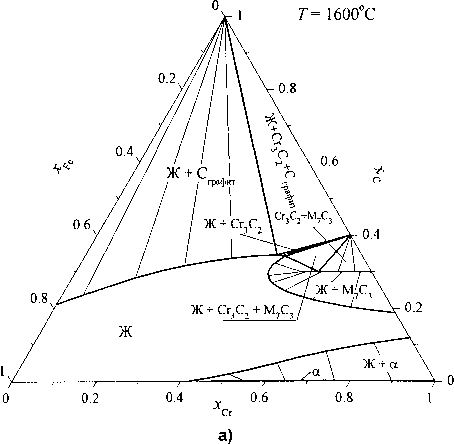
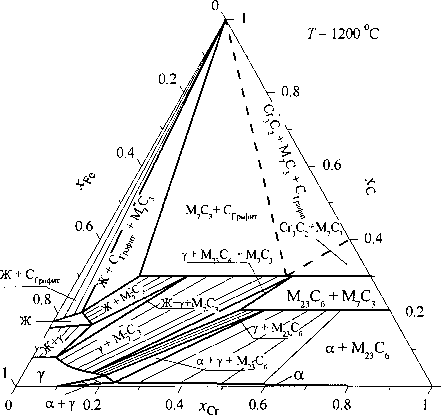
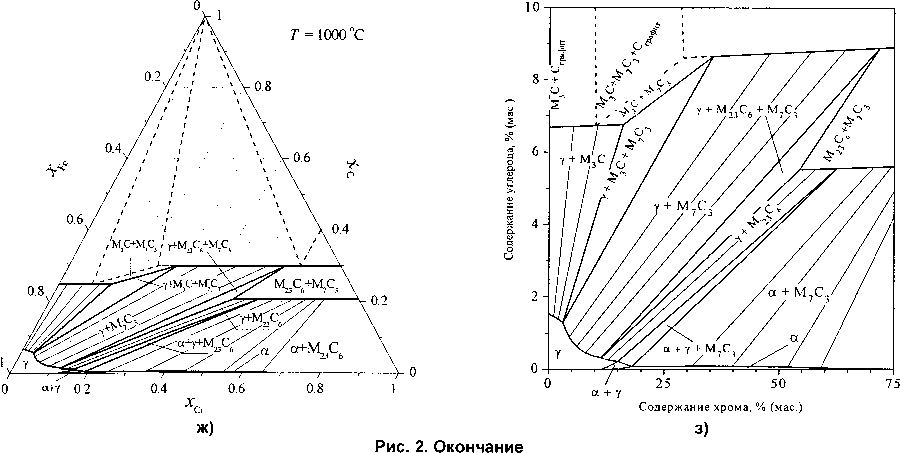
Графическая зависимость результатов расчета по полученным соотношениям представлена на рис. 2 в виде изотермических сечений и фазовых диаграмм металлического сплава в интервале температур 1600... 1000 °C. Из приведенных графических зависимостей следует, что при 1600 °C первично кристаллизующимся металлом является низкоуглеродистый феррит. Расплав, насыщенный углеродом, кристаллизуется с образованием карбида хрома Сг3С2 либо (Ге, Сг)7С3, что приводит к наличию двух трехфазных равновесий Ж + Сг3С2 +СграфИТ и Ж + М7С3 +Сг3С2. При уменьшении температуры до 1597 °C реализуется нонва-риантное равновесие
Ж + Сг3С2<=± МПС3 + С^афщ..
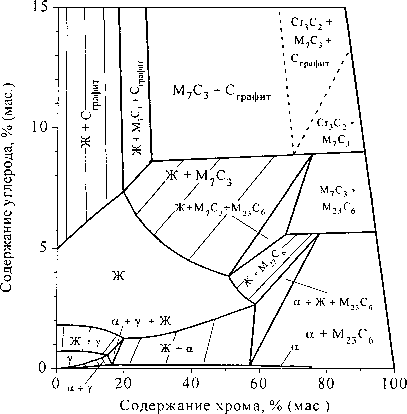
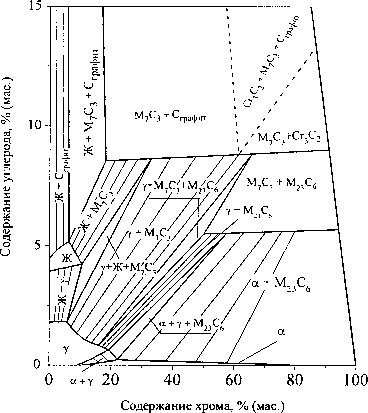
Комплекс фаз, образующихся при кристаллизации жидкого расплава, графически представлен на рис. 3, б линиями трехфазного равновесия с участием
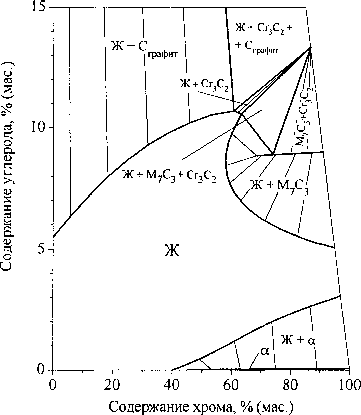
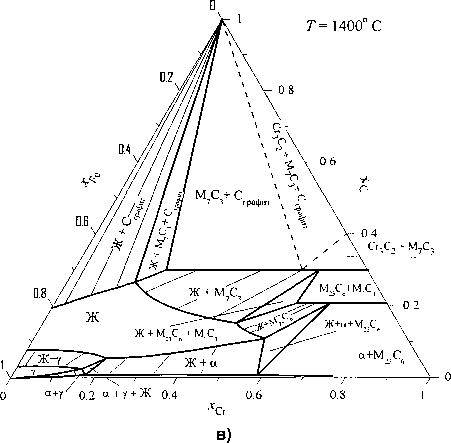
Рис. 2. Изотермические сечения и фазовые диаграммы металлического сплава системы железо-хром-углерод при температуре 1600(а, б), 1400 (в, г), 1200 (д, е), 1000 (ж, з)
а)
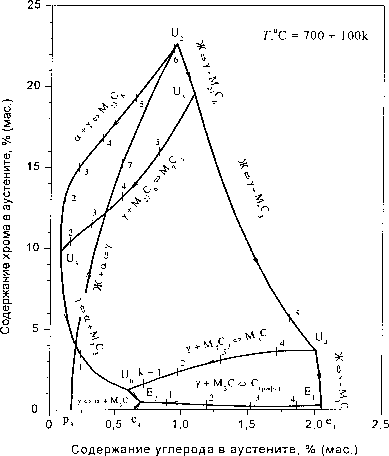
Рис. 3. Диаграммы трехфазных равновесий с участием аустенита (а) и жидкого сплава (б)
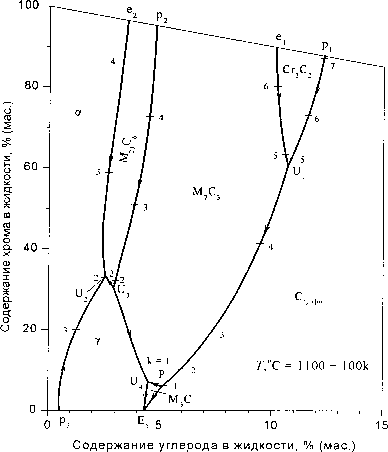
б)
О
С - Сг
С - Cr - Fe
С - Fe
Cr - Fe
|
1803 °C |
Pi |
|
Ж + Сгр |
СгЗС2 |
|
1597 |
Ж + СгЗС2 о М7СЗ + Сгр |
U1 |
|
1744 |
ei |
|
ЖоСг7СЗ + СгЗС2 |
|
Ж <-» Сгр + Сг23С6
Cr3C2 + M7C3 + Сгр
Ж + М7СЗ + Сгр
а + у + М23С6
Ж + у + М7СЗ
" у + М7СЗ + МЗС
у + М23С6 + М7СЗ
у + а + М7СЗ
Ж + а<-»у+М23С6
Ж + М23С6оу+М7СЗ
Ж + М7СЗ + МЗС
Ж+М7СЗоу + МЗС
Ж + у + МЗС
у+М23С6оа + М7СЗ
и2
Ж + у + М23С6
Ж + М7СЗ + Сгр о МЗС

Ж + МЗС + Сгр
Жоу + МЗС + Сгр

и5
а + М23С6 + М7СЗ
у + МЗСоа + М7СЗ
и6
а + ст + М23С6
МЗС + М7СЗ + а
у + а + МЗС
у + МЗС + Сгр
у <-> а + МЗС + Сгр

|
1495 |
е2 |
|
|
Ж + 6<- |
у |
|
|
1154 |
Сз |
|
Ж = у |
+ Сгр |
Вестник ЮУрГУ, № 36, 2009
а + МЗС + Сгр
|
658 |
МЗС о а + М7СЗ + Сгр |
Е3 ' |
а + М7СЗ + Сгр
МЗС + М7СЗ + Сгр
а(Сг)+ ст + М23С6
а(Ре) + ст + М23С6
|
512 |
аГСг) + a(Fe) + ст + М23С6 |
D |
а(Сг) + а(Ре) + ст + М23С6
Рис. 4. Схема фазовых превращений в системе железо-хром-углерод
е5
ст <-» а(Сг) + а(Ре)
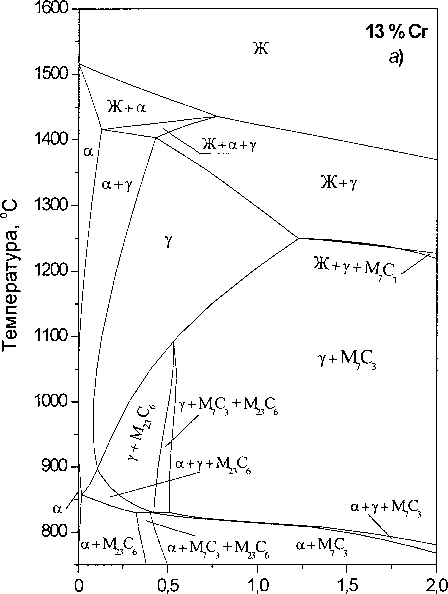
Содержание углерода, % (мае.)
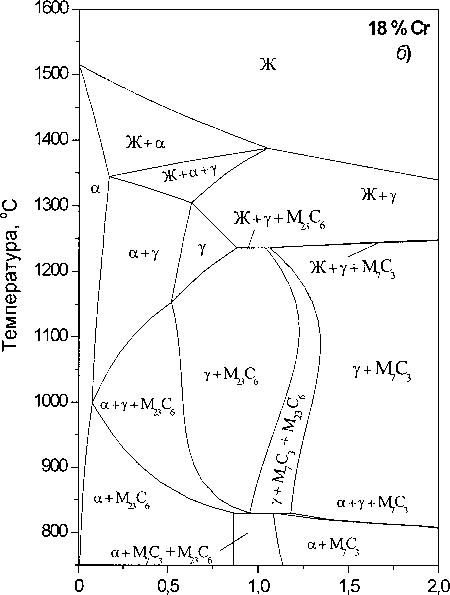
Содержание углерода, % (мае.)
Рис. 5. Политермические разрезы диаграммы состояния системы Fe-Cr-C при содержании хрома в металле 13%(а) и 18 % (6)
жидкости. Области между кривыми определяются как политермические поверхности растворимости компонентов в расплаве, равновесном с одной из кристаллизующихся фаз.
При температуре 1400 °C (рис. 2, в, г) и небольших концентрациях хрома первично кристаллизующимся металлом будет аустенит. Возможно также образование карбида М2зС6 в равновесии с жидким расплавом или ферритом. Дальнейшее снижение температуры приводит к расширению концентрационных пределов устойчивости аустенита и трансформации, равновесных с металлом, карбидов. Фазовые превращения с участием аустенита графически представлены на рис. 3, а. Координаты точек пересечения кривых определяют температуры и концентрации компонентов нонва-риантных превращений с участием г.ц.к.-фазы (аустенита).
Совокупность фазовых превращений в сопоставлении с реакциями в бинарных системах представлена на рис. 4.
На изотермических сечениях при заданной концентрации одного из компонентов можно установить последовательность фазовых превращений и определить количественные соотношения равновесных фаз. Однако наиболее представительными и удобными для анализа являются политермические разрезы при постоянной концентрации одного из компонентов. На рис. 5 приведены такие политермические сечения, соответствующие содер жанию хрома в металлическом сплаве 13 и 18% (по массе) и различной концентрации углерода.
Выводы. Проведен термодинамический анализ и изучены фазовые равновесия в трехкомпонентной системе железо-хром-углерод. Рассчитаны и построены изотермические сечения в интервале температур 1600... 1000 °C. Приведена графическая зависимость проекции поверхности ликвидуса и диаграмма трехфазных равновесий с участием аустенита. Результаты расчета представлены также в виде политермических разрезов с постоянным содержанием хрома в металле.
Работа выполнена в соответствии с научной программой Федерального агентства по образованию - «Развитие научного потенциала высшей школы (2009-2010 гг.)», код проекта - 713 и при поддержке РФФИ, грант № 08-08-00416.
Список литературы Термодинамический анализ и фазовые равновесия в системе железо-хром-углерод
- Andersson J.-O. Thermodynamic Properties of the Cr-Fe System/J.-O. Andersson, B. Sundman//CALPHAD. 1987. V. 11, № 1. P. 83-92.
- Taylor J.R. A Thermodynamic Assessment of the Cr-Fe-O System/J.R. Taylor, A.T. Dinsdale//Z. Metallkd. 1993. V. 84, № 5. P. 335-345.
- Chipman J. Thermodynamics and Phase Diagram of the Fe-C System/J. Chipman//Metallurg. Trans. A. 1972. V. 3, № 1. P. 55-64.
- Chicco B. Experimental Determination of the Austenitic + Liquid Phase Boundaries of the Fe-C System/В. Chicco, W.R. Thorpe//Metallurg. Trans. A. 1982. V. 13A, № 7. P. 1293-1297.
- Agren J. The Thermodynamic Analysis of the Fe-C and Fe-N Phase Diagrams/J. Agren//Metallurg. Trans. A. 1979. V. 10A, № 12. P. 1847-1852.
- Andersson J.-O. Thermodynamic Properties of Cr-C/J.-O. Andersson//CALPHAD. 1987. V. 11, № 2. P. 271-276.
- Carbon -Chromium -Iron/A. Bondar, V. Ivanchenko, A. Kozlow, J.-C. Tedenac//MSIT, London-Bornstein. New Series IV/11D2 -P. 72.
- Hillert M. A Thermodynamic Assessment of the Fe-Cr-Ni-C System/M. Hillert, С. Qiu//Metallurg. Trans. A. 1991. V. 22A, № 10. P. 2187-2196.
- Andersson J.-O. A Thermodynamic Evaluation of the Fe-Cr-C System/J.-O. Andersson//Metallurg. Trans. A. 1988. V. 19A, № 3. P. 627-636.
- Люпис К. Химическая термодинамика материалов/К. Люпис; пер. с англ. под ред. Н.А. Ватолина, А.Я. Стомахина. М.: Металлургия, 1989. 503 с.
- Морачевский А.Г. Термодинамика расплавленных металлических и солевых систем/А.Г. Морачевский. М.: Металлургия, 1987. 240 с.
- Sundman B.J. A Regular Solution Model for Phases with Several Components and Sublattices, Suitable for Computer Applications/B. Sundman, J. Agren//Phys. Chem. Solids. 1981. V. 42. P. 297-301.
- Sundman B. The Sublattice Model/B. Sundman, J. Agren//Mat. Res. Soc. Symp. Proc. 1983. V. 19. P. 115-127.


