Термодинамический анализ процессов твердофазной металлизации железотитановых концентратов Копанского месторождения
Автор: Асанов А.В., Бухарина В.Е., Мальков Н.В., Сенин А.В., Рощин А.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 24 (124), 2008 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156593
IDR: 147156593 | УДК: 669.053.2+661.88
Текст статьи Термодинамический анализ процессов твердофазной металлизации железотитановых концентратов Копанского месторождения
При обогащении руд Медведевского и Копайского месторождений получаются железованадиевый и ильменитовый концентраты.
Основными недостатками плавки порошкового ильменитового концентрата в рудно-термической печи являются повышенный расход электроэнергии по причине неоптимального протекания процессов восстановления в жидкой фазе и повышенный вынос пыли материала, что требует значительных капитальных затрат на систему очистки газов и утилизацию уловленного продукта [1].
Для снижения энергетических затрат и практически полной ликвидации потерь шихты за счет выноса пыли целесообразным является использование двухстадийной схемы, состоящей из стадии восстановления оксидов железа и ванадия в твердой фазе и плавки в электропечи восстановленного концентрата с целью разделения металла и титанового шлака. Для реализации этой схемы необходимо определить оптимальные параметры селективного восстановления железа и ванадия, обеспечивающие практически полное восстановление этих элементов из ильменитового концентрата.
В работе выполнен термодинамический анализ, который проводился с использованием программного комплекса «TERRA». Интегральная компьютерная система «TERRA» (ИКС «TERRA») предназначена для расчета произвольных систем с химическими и фазовыми превращениями. Она позволяет моделировать равновесные состояния. В качестве критерия равновесного состояния в системе использован максимум энтропии изолированной системы [2].
Дополнена база данных термодинамическими характеристиками индивидуальных веществ FeTiO3, CaTiSiO5, Fe2TiO4 и др., которые могут образоваться в данной системе. Источником информации о термодинамических характеристиках компонентов концентрата, продуктов твердофазного восстановления служил справочник «Термодинамиче ские свойства индивидуальных веществ» [3]. Для дититаната железа в связи с отсутствием термодинамических данных по теплоемкости проведены оценочные термодинамические расчеты стандартной теплоемкости и коэффициенты полинома теплоемкости [4]. Выполнена корректировка базы данных свойств некоторых индивидуальных веществ.
Шихта для металлизации состояла из концентрата (табл. 1) и кокса.
Исходный состав шихты задан в соответствии со стехиометрическими реакциями восстановления. Общее давление Р принимали равным 1 атм. Переменные параметры расчета температура Т и расход углерода.
Рассчитывали равновесные составы, начиная с температуры 400 °C с шагом по 20 °C. Такая последовательность расчета равновесных состояний соответствует постепенному нагреву шихты в восстановительном агрегате.
При проведении расчетов использовалась модель конденсированных растворов.
Составляющие раствора (шлака): Fe2SiO3, SiO2, А12О3, FeO, FeTiO3, MnO, Cr2O3, V2O3, TiO, TiO2, Ti2O3, Ti3O5, Ti4O7, CaO, CaSiO3, MgO, MgSiO3, MgTi2O5, Al2TiO5, MgTiO3, Fe3O4, CaTiSiO5, FeTi2O5, CaTiO3.
Составляющие раствора (металла): C, Si, SiC, Fe, Fe3C, Mn, Mn3C, Cr, V, VC, Ti, TiC, Cr3C2.
Результаты вычислений изменения состава системы при восстановлении ильменитового концентрата в зависимости от расхода углерода кокса при температуре 1300 °C представлены на рис. 1.
Полученные результаты свидетельствуют, что для восстановления оксидов железа и ванадия из ильменитового концентрата необходимо 11,8 мас.% углерода. При этом количестве углерода железо восстанавливается почти полностью из ильменита, а оксиды ванадия до его карбидов. При большем количестве углерода наряду с оксидами железа и ванадия начинают восстанавливаться оксиды ти-
Состав ильменитового концентрата, мас.%
Таблица 1
|
Вид концентрата |
Массовая доля компонентов в шихте, кг/100 кг концентрата |
||||||||
|
Fe3O4 |
FeTiO, |
V2O5 |
SiO2 |
CaO |
MgO |
MnO |
Cr2O3 |
A12O3 |
|
|
Копанский |
6,71 |
85,88 |
0,17 |
3,19 |
1,31 |
0,77 |
1,22 |
0,32 |
1,06 |
* Работа выполнена при финансовой поддержке Правительства Челябинской области.
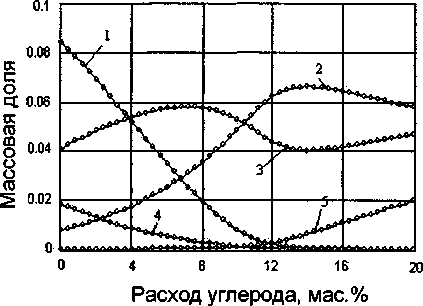
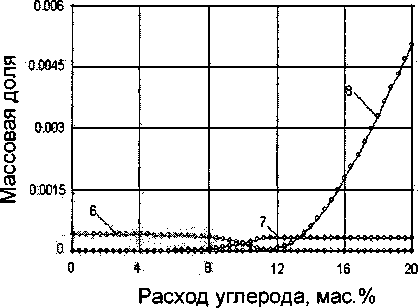
Рис. 1. Влияние расхода восстановителя на процесс восстановления основных компонентов ильменитового концентрата: 1 - FeTiO3, 2 - Fe3C, 3 - Fe, 4 - FeO, 5 - С, 6 -V2O3, 7 - VC, 8 - TiC
тана до карбидов титана. Также при 0 11,8% заметно увеличивается доля свободного углерода в восстановленном концентрате.
Влияние температуры на состав продуктов восстановления ильменитового концентрата приведены на рисунках 2, 3,4, 5.
Установлено, что при температуре 430...450 °C из магнетита начинает восстанавливаться железо и практически полностью заканчивается процесс восстановления железа при температуре 750...800°C. При температуре 550...580 °C начинает восстанавливаться железо из ильменита с образованием промежуточного соединения - псевбрукита и Т102. При температуре 780 °C начинается образование карбидов железа (рис. 2).
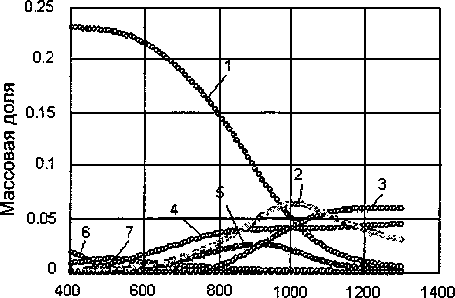
Температура, °C
Рис. 2. Влияние температуры на содержание железа в шлаковой и металлической фазах: 1 - FeTiO3,2 - ТЮ2, 3 - Fe3C, 4 - Fe, 5 - FeTi2O5, 6 - FeO, 7 - Fe3O4
Дититанат устойчив до температуры 900 °C, а затем из него восстанавливается железо и выделяется ТЮ2. Полностью восстановление железа заканчивается при температуре 1250... 1300 °C.
Таким образом, восстановление ильменита происходит по следующей схеме:
FeTiO3+C -> Fe, Fe3C, TiO2, CO, FeTi2O5.
Это согласуется с результатами работ [5], авторы которых считают, что ильменит восстанавли вается одностадийно с образованием металлического железа и диоксида титана.
Оксиды титана до температуры 1000 °C представлены в основном TiO2, а при более высокой температуре Т1О2 начинает восстанавливаться до оксидов титана более низкой валентности (рис. 3) по схеме:
TiO2-* Ti4O7—* TigOs™* Т12О3~* TiO.
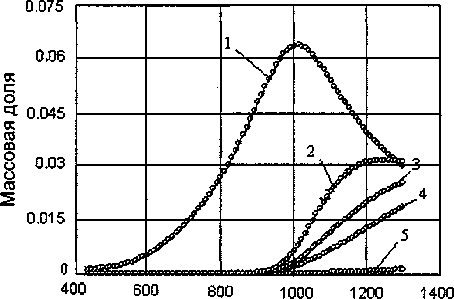
Температура,°C
Рис. 3. Влияние температуры на образование оксидов титана: 1 - ТЮ2, 2 - ТЦО7, 3 - Ti3O5,4 - Ti2O3, 5 - TiO
Установлено, что хром начинает восстанавливаться до металлического хрома при температуре 950 °C. При температуре 900 °C начинает восстанавливаться марганец до металлического марганца. При температуре 1100 °C появляется карбид титана. Ванадий начинает восстанавливаться при температуре 760...780 °C до карбида и практически полностью восстанавливается при температуре 1200... 1250 °C (рис. 4).
При температуре до 600 °C устойчивы силикаты магния и кальция. При более высокой температуре эти соединения распадаются.
Силикаты магния распадаются на SiO2 и MgO, который сразу связывается с оксидами титана с образованием MgTiO3 и MgTi2O5.
Асанов А.В., Бухарина В.Е., Мальков Н.В., Сенин А.В., Рощин А.В.
Термодинамический анализ процессов твердофазной металлизации железотитановых концентратов...
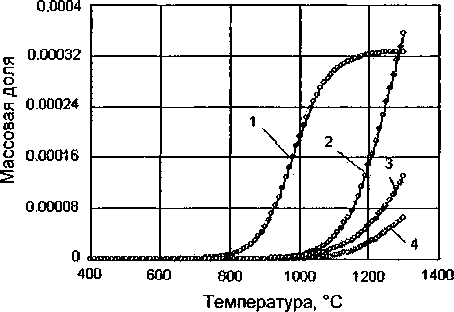
Рис. 4. Влияние температуры на содержание Сг, Мп, VC, TiC: 1 - VC, 2 - Сг, 3 - Мп, 4 - TiC
В связи с высокой термодинамической прочностью оксидов кальций, алюминий и магний в процессах селективного твердофазного углетермического восстановления практически не восстанавливаются. В исследованном температурном интервале практически не восстанавливается кремний.
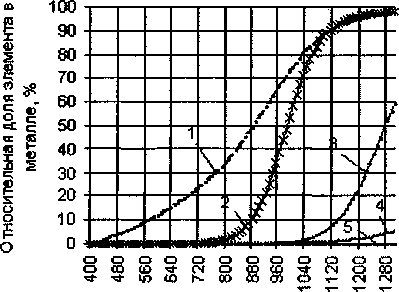
Зависимости степеней восстановления Fe, Мп, Сг, V, Ti от температуры представлены на рис. 6.
Расчетный состав полупродукта после твердофазного восстановления представлен в табл. 2, 3.
Также при высокой температуре оксиды титана связываются с оксидом алюминия с образованием А12ТЮ5 (рис. 5).
Таблица 2
Состав металлической фазы полупродукта после твердофазного восстановления при температуре 1250 °C, мас.%
|
С |
Fe |
Мп |
Сг |
V |
Ti |
|
5,5 |
93,72 |
0,1 |
0,3 |
0,24 |
0,04 |
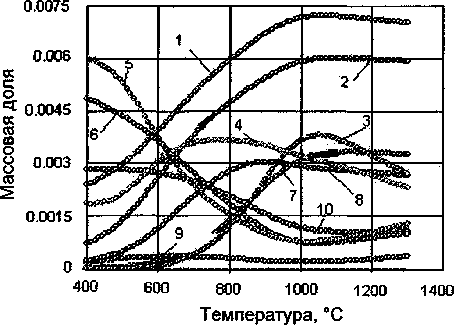
Рис. 5. Влияние температуры на состав оксидной фазы: 1 - SiO2, 2 - CaTiO3, 3 - MgTi2O5, 4 - CaTiSiOs, 5 - CaSiO3, 6 - MgSiO3, 7 - AI2TiO5, 8 - MgTiO3, 9 -MgO, 10 - AI2O3
Опытные данные показывают [6], что в процессе восстановительного обжига и твердофазного восстановления происходит выделение металла в виде чрезвычайно дисперсной фазы, которая по данным энергодисперсионного анализа состоит из чугуна (более 96 % мае. железа, 3...4 % углерода) с незначительной примесью титана. При этом оксидная фаза содержит до 51 % титана, 43 % кислорода, а также небольшое количество магния, алюминия, кремния, хрома и незначительное (менее 1 %) количество железа.
В результате проведенных расчетов установлено, что конечными продуктами восстановления ильменитового концентрата углеродом при нагреве до температуры 1100... 1300 °C являются природнолегированный чугун и шлаковая фаза - комплексный оксид титана (Ti4+, TF+,Ti2+ - аносовит) и раствор оксидов невосстанавливаемых металлов в «пустой» породе.
Температура, ^
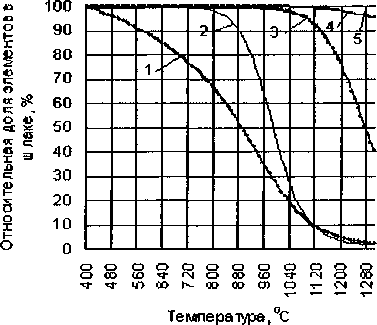
Рис. 6. Влияние температуры на распределение элементов между металлом и шлаком при карботермическом восстановлении ильменитового концентрата: 1 - Ре, 2 - V, 3 - Сг, 4 - Мп, 5 - Ti
Таблица 3
Состав оксидной фазы полупродукта после твердофазного восстановления при температуре 1250 °C, мае. %
|
FeO |
SiO2 |
А12О3 |
MnO |
Cr2O3 |
V2O3 |
TiO |
TiO2 |
Ti2O3 |
Ti3Os |
Ti4O7 |
MgO |
CaO |
|
1,34 |
5,92 |
2,5 |
2,26 |
0,28 |
0,01 |
0,73 |
27,93 |
12,71 |
18 |
24,1 |
1,4 |
2,2 |
Наблюдаемое совпадение экспериментальных и расчетных данных свидетельствует о возможности применения методики расчетов и термодинамических характеристик для прогнозирования фазовых и химических превращений при восстановлении ильменитового концентрата.
Список литературы Термодинамический анализ процессов твердофазной металлизации железотитановых концентратов Копанского месторождения
- Кобелев, В.А. Переработка ильменитовых концентратов местороэюдений Южного Урала/В.А. Кобелев, Л.А. Смирнов//Проблемы комплексной переработки титаномагнетитов Южного Урала. Магнитогорск: Магнитогорский дом печати, 2001. С. 62-72.
- Теоретические основы процессов произодства углеродистого феррохрома из уральских руд: монография/В.П. Чернобровин, И.Ю. Пашкеев, Г.Г. Muxaйлов и дp. Челябинск: Изд-во ЮУрГУ, 2004. 346 с.
- Термодинамические свойства индивидуальных веществ/Л.В. Гурвич, И.В. Вещ, В.А. Медведев и др. М.: Наука, 1978-1982. Т. 1-4.
- Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ/Г.К. Моисеев, Н.А. Ватолин, Л.А. Маршук, Н.И. Ильиных. Екатеринбург: УрО РАН, 1997. 231 с.
- Пирометаллургическая переработка комлексных руд/Л.И. Леонтьев, Н.А. Ватолин, С.В. Шаврин, Н.С Шумаков. М.: Металлургия. 1997. 431 с.
- Рощин А.В. Селективное восстановление и пирометаллургическое разделение металлов титаномагнетитовых руд/А.В. Рощин, В.П. Грибанов, А.В. Асанов//Вестник ЮУрГУ. Серия «Металлургия». 2006. Вып. 7. № 10(65). С. 49-55.


