Термодинамический анализ процессов взаимодействия компонентов в системе Fe-Sr-Ca-O-С в условиях существования металлического расплава
Автор: Михайлов Геннадий Георгиевич, Вяткин Герман Платонович, Макровец Лариса Александровна, Самойлова Ольга Владимировна, Бакин Игорь Валерьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.20, 2020 года.
Бесплатный доступ
В настоящее время получение высококачественных конструкционных материалов вплотную связано с отработкой технологий микролегирования и модифицирования стали сплавами щелочноземельных (ЩЗМ) и редкоземельных (РЗМ) металлов в агрегате печь-ковш. Рационально подобранные композиции рафинирующих и модифицирующих добавок позволяют повлиять на микроструктуру металла, увеличить прочность и пластичность стального проката, повысить хладостойкость и коррозионную стойкость стали, а также глобуляризировать неметаллические включения, резко сократить их количество и размер. Считается, что наиболее эффективными модификаторами являются комплексные сплавы, содержащие наряду с кальцием барий и стронций. Модифицирующая способность ЩЗМ в жидком железе увеличивается в ряду Ca, Sr, Ba, следовательно, по модифицирующей способности кальций уступает стронцию и барию. В то же время процессы раскисления стали сплавами, содержащими ЩЗМ, особенно раскисление стронцием, изучены недостаточно. Для разработки научно обоснованных составов рафинирующих сплавов для раскисления и модифицирования необходимо проведение расчетов, позволяющих оценить, в частности, раскислительную способность щелочноземельных элементов, в том числе и стронция. В данной работе с использованием метода построения поверхностей растворимости компонентов (ПРКМ) рассматривается рафинирующее действие стронцийсодержащих сплавов. Выполнены расчеты по построению диаграммы состояния системы FeO-SrO-CaO и ПРКМ системы Fe-Sr-Ca-O-С. По результатам расчета показано, что при одновременном присутствии кальция и стронция в жидком железе реализуется комплексный механизм раскисления с образованием в качестве неметаллических включений частиц твердого раствора оксидов |SrO, CaO(FeO)|тв.р с минимальным содержанием оксида железа (порядка 0,001 мас. %).
Термодинамическое моделирование, система fe-sr-ca-o-с, фазовые равновесия, комплексное раскисление, кальций, стронций
Короткий адрес: https://sciup.org/147233969
IDR: 147233969 | УДК: 669.18 | DOI: 10.14529/met200401
Текст научной статьи Термодинамический анализ процессов взаимодействия компонентов в системе Fe-Sr-Ca-O-С в условиях существования металлического расплава
На настоящий момент для повышения качества металла, в особенности низколегированного, применяются технологии внепечной обработки стали с использованием комплексных сплавов, в состав которых входят помимо кремния щелочноземельные (ЩЗМ) и редкоземельные (РЗМ) металлы.
Одним из перспективных направлений в области металлургических технологий является разработка комплексных кальций-, барий- и стронцийсодержащих составов для раскисления и модифицирования. Согласно экспериментальным данным работ [1–3] использование таких композиций позволило значительно снизить показатель загрязнен- ности неметаллическими включениями и обеспечить высокий уровень их глобуляри-зации, при этом фиксировалось измельчение структуры металла и положительное влияние обработки такими модификаторами на механические свойства сталей. Также авторы работы [3] подчеркивают, что использование Fe–Si–Ca–Ba–Sr модификаторов способствовало повышению степени усвоения кальция. Однако указанные в работе [3] экспериментальные результаты требуют теоретической оценки происходящих в жидком металле взаимодействий, в том числе и термодинамического описания реакций раскисления с одновременным участием кальция и стронция.
Целью настоящей работы является термодинамический анализ процессов взаимодействия компонентов в системе Fe–Sr–Ca–O–С при температурах 1550 и 1600 °С и различных содержаниях углерода (0,1 и 0,4 мас. %).
Примеры расчета поверхности растворимости компонентов в металле (ПРКМ) приведены в монографии [4]. В общем случае при анализе гетерогенных, протекающих в жидком металле, реакций образования неметаллических включений используется нижеприведенный алгоритм.
-
1. Необходимо определиться с числом компонентов в анализируемой системе. Например, при раскислении железа стронцием и кальцием необходимо рассматривать взаимодействия, протекающие в жидком металле системы Fe–Sr–Ca–O. А если в жидком железе растворен некоторый процент углерода, то необходимо рассматривать фазовые равновесия в жидкометаллической системе Fe–Sr–Ca–O–С.
-
2. Физико-химические металлические системы необходимо рассматривать в области, сопряженной с областью существования неметаллических образований (газовой, оксидных, жидких и твердых фаз).
-
3. Состав образующихся неметаллических включений будет определяться на соответствующих квазибинарных или других диаграммах или участках диаграмм, которые по условиям существования жидкой или твердой оксидной фазы могут находиться в равновесии с жидким металлом. Так при раскислении жидкой стали стронцием и кальцием сопряженными с металлическим расплавом являются: оксидные фазы, принадлежащие диаграмме состояния системы FeO–SrO–CaO, и газовая фаза {CO, CO 2 , Sr, Ca}.
-
4. После установления химизма основных фазовых равновесий нужно определиться с набором необходимых для расчета термодинамических данных, значений констант равновесий реакций, активностей компонентов в металлических и неметаллических фазах, теориями, определяющими зависимость активно-
- стей от состава, степенью вариантности того или иного фазового равновесия.
Для расчета координат ПРКМ системы Fe–Sr–Ca–O необходимы данные по диаграмме состояния системы FeO–SrO–CaO, которые до настоящего времени не были известны. К рассчитанным нами ранее диаграммам состояния систем FeO–SrO [5] и FeO–CaO [6] необходимо было получить термодинамические параметры для системы SrO–CaO. В литературе [7–11] имеются данные о наличии ряда твердых растворов в системе SrO–CaO, однако только в работе [12] приводится вид данной диаграммы состояния с неограниченной растворимостью оксидов как в жидком, так и в твердом состоянии.
Для моделирования использовали данные по температуре и энтальпии плавления оксида железа FeO 1378 °С [13] и 33 470 Дж/моль [14] соответственно; оксида стронция SrO 2532 °С [15] и 80 950 Дж/моль [15] соответственно; оксида кальция CaO 2613 °С [16] и 52 300 Дж/моль [17] соответственно.
Активности компонентов оксидного расплава как в системе SrO–CaO, так и в системе FeO–SrO–CaO рассчитывали с использованием теории субрегулярных ионных растворов, учитывающей зависимость координационного числа раствора от состава [4]. В табл. 1 приведены подобранные в настоящей работе энергетические параметры данной теории для расплава исследуемых систем. Активности компонентов твердого раствора |SrO, CaO| тв.р в системе SrO–CaO рассчитывали по теории регулярных ионных растворов [4], энергетический параметр Q = 28 568 Дж/моль. Активности компонентов твердого раствора |FeO, CaO| тв.р в системе FeO–SrO–CaO также рассчитывали по теории регулярных ионных растворов (был подобран энергетический параметр Q = 28 588 Дж/моль). Активности компонентов твердого раствора |SrO, CaO(FeO)| тв.р рассчитывали по теории регулярных ионных растворов, но так как в SrO растворяется только CaO, то для этого случая был взят
Таблица 1
Параметры теории субрегулярных ионных растворов для системы FeO–SrO–CaO (оксидный расплав)
На рис. 1 приведена расчетная диаграмма состояния системы SrO–CaO. В целом результаты расчета соответствуют литературным данным [12], некоторые отклонения можно считать зависящими от принимаемой исследователями температуры плавления оксида кальция.
На рис. 2 приведены результаты расчета диаграммы состояния системы FeO–SrO–CaO.
На этой диаграмме присутствует два вида твердых растворов: |FeO, CaO| тв.р на основе оксида железа и |SrO, CaO(FeO)| тв.р , в котором в CaO частично растворяется FeO. Причем последний из этих твердых растворов существует в интересующем нас интервале температур 1550–1600 °С.
Для расчета поверхности растворимости компонентов в металле использовали данные по значениям констант равновесия реакций из табл. 2. Активности оксидного расплава рассчитывали по теории субрегулярных ионных растворов (энергетические параметры теории
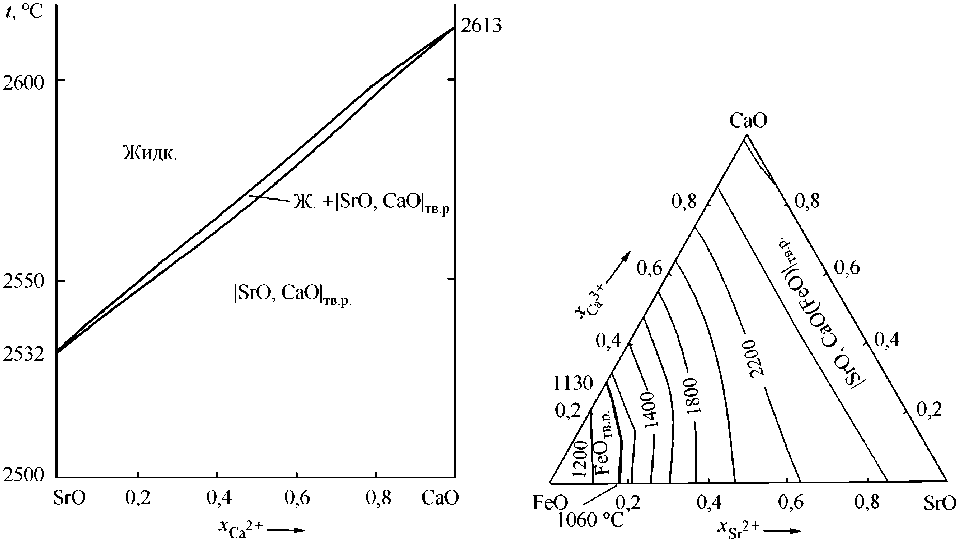
Рис. 1. Диаграмма состояния системы SrO–CaO
Рис. 2. Диаграмма состояния системы FeO–SrO–CaO
Таблица 2
Температурные зависимости констант равновесия химических реакций, протекающих в металлическом расплаве системы Fe–Sr–Ca–O–C
|
Химическая реакция |
lg K = –A/T + B |
Источник |
|
(FeO) = [Fe] + [O] |
–6320/ T + 4,734 |
[4] |
|
(SrO) = [Sr] + [O] |
–25 571/ T + 9,493 |
[5] |
|
(CaO) = [Ca] + [O] |
–31 368/ T + 12,515 |
[6] |
|
|FeO| тв.р. = [Fe] + [O] |
–8069/ T + 5,800 |
[4] |
|
|SrO| тв.р. = [Sr] + [O] |
–29 800/ T + 11,000 |
[5] |
|
|CaO| тв.р. = [Ca] + [O] |
–34 100/ T + 13,460 |
[6] |
|
{Sr} = [Sr] |
1870/ T – 3,650 |
[5] |
|
{Ca} = [Ca] |
1912/T – 2,690 |
[6] |
|
{CO} = [C] + [O] |
–1168/ T – 2,070 |
[18] |
|
{CO 2 } = [C] + 2[O] |
–9616/ T + 2,510 |
[18] |
Примечание. В круглых скобках представлены компоненты оксидного расплава; в квадратных – металлического расплава; в прямых скобках указаны твердые соединения; в фигурных скобках – газовая фаза.
Таблица 3
Параметры взаимодействия первого порядка компонентов в жидком железе e i j при 1600 °С
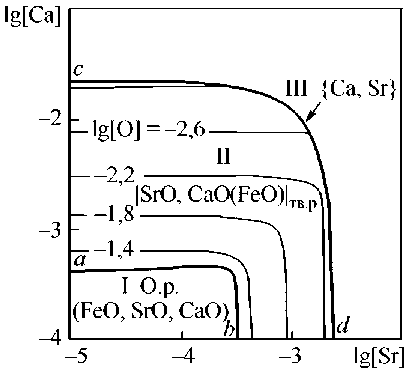
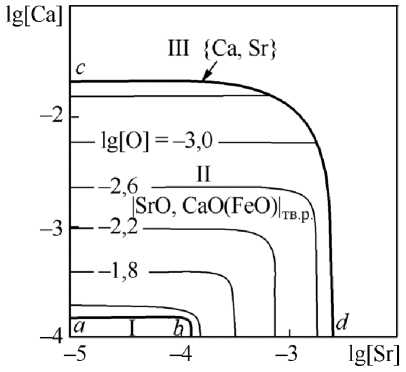
На рис. 3 приведены изотермические сечения (1600 и 1550 °С) поверхности растворимости компонентов в металле (ПРКМ) системы Fe–Sr–Ca–O. Влияние углерода на вид этой диаграммы показано на рис. 4 и 5. На рис. 3–5 в области I представлены составы жидкого металла, сопряженного с жидкими неметаллическими включениями (FeO, SrO, CaO), в области II – с частицами твердого раствора оксидов |SrO, CaO(FeO)| тв.р , в облас-
а)
б)
Рис. 3. ПРКМ системы Fe–Sr–Ca–O, P общ = 1 атм: а) t = 1600 °С; б) t = 1550 °С
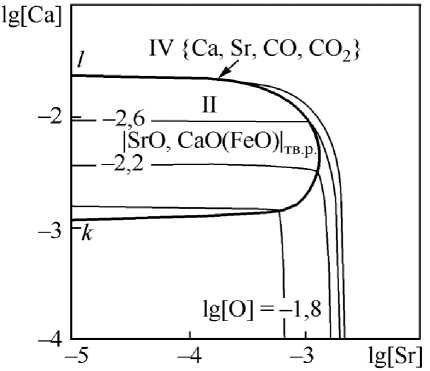
Рис. 4. ПРКМ системы Fe–Sr–Ca–O–С, P общ = 1 атм, t = 1600 °С, [C] = 0,1 мас. %
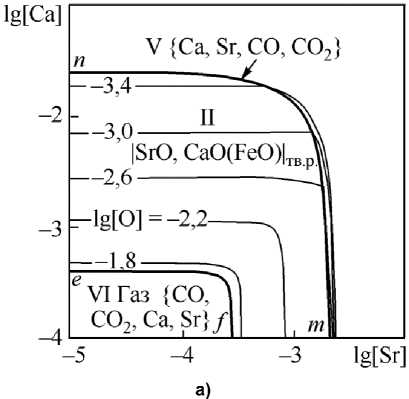
Рис. 5. ПРКМ системы Fe–Sr–Ca–O–С, P общ = 1 атм, t = 1550 °С: а) [C] = 0,1 мас. %, б) [C] = 0,4 мас. %
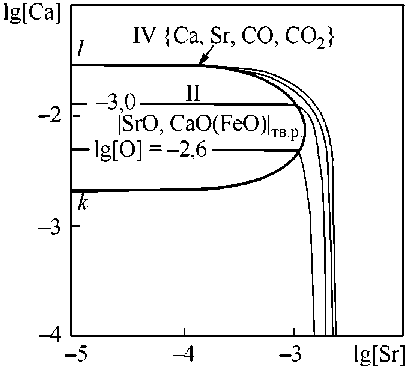
б)
ти III – с газовой фазой {Ca, Sr}, в области IV – с газовой фазой {Ca, Sr, CO, CO 2 } переменного состава (от практически чистого газообразного Ca до практически чистого CO), в области V – c газовой фазой {Ca, Sr, CO, CO 2 } переменного состава (от практически чистого газообразного Ca до практически чистого газообразного Sr со следами CO и CO 2 ) и в области VI – с газовой фазой {CO, CO 2 , Ca, Sr} на основе CO.
Согласно проведенному моделированию для системы Fe–Sr–Ca–O при промышленно значимых концентрациях кальция в стали (0,001 и 0,005 мас. %) основными включениями, образующимися при взаимодействии компонентов исследуемой системы, будут частицы твердого раствора оксидов |SrO, CaO(FeO)| тв.р вплоть до предельной растворимости кальция и стронция в жидком металле. Состав твердого раствора (например, на рис. 5а) меняется от практически чистого CaO (точка n ) до практически чистого SrO (точка m ), FeO следы – не более 0,001 мас. % растворяется в CaO.
Влияние углерода проявляется в возможности образования газовой фазы VI на основе монооксида углерода CO (см. рис. 5а) и газовой фазы IV переменного состава (см. рис. 4 и рис. 5б), равновесие с которой будет осуществляться только при концентрациях кальция в металле меньше, чем 0,001 мас. %. Концентрация стронция при этом не влияет на термодинамическую возможность образования данной газовой фазы. Увеличение концентрации углерода в металле расширяет область существования газовой фазы. Так для температуры 1600 °С при концентрации растворен- ного в металле углерода [C] = 0,1 мас. % на ПРКМ имеется область существования частиц твердого раствора оксидов (см. рис. 4), а для этой же температуры уже при концентрации углерода [C] = 0,4 мас. % единственной равновесной с жидким металлом фазой будет являться газовая фаза переменного состава (по этой причине на рис. 4 не приводится ПРКМ для [C] = 0,4 мас. %). При снижении температуры жидкого металла до 1550 °С становится возможным образование частиц твердого раствора, но при сравнении рис. 5а и 5б очевидно увеличение вероятности образования газовой фазы при увеличении концентрации углерода в жидкой стали. Также можно отметить, что образование газовой фазы в качестве равновесной более термодинамически предпочтительно по сравнению с образованием жидких неметаллических включений (оксидного расплава).
По полученным результатам можно сделать вывод о том, что при использовании комплексных кальций- и стронцийсодержащих модификаторов будет реализовываться комплексный механизм раскисления при промышленно значимых концентрациях кальция (не менее 0,001 мас. %). Концентрация кислорода в жидкой стали снижается до 0,001 мас. % [O], что говорит о достаточно высоких раскислитель-ных свойствах подобных комплексных модификаторов.
Выводы
Подобраны энергетические параметры теорий субрегулярных ионных растворов (для оксидных расплавов) и регулярных ионных растворов (для твердых растворов) и построены диаграммы состояния оксидных систем SrO–CaO и FeO–SrO–CaO. Проведен термодинамический анализ процессов взаимодействия компонентов в системе Fe–Sr–Ca–O–С для температур 1550 и 1600 °С и концентраций углерода в 0,1 и 0,4 мас. %. При использовании комплексных кальций- и стронцийсодержащих модификаторов будет реализовываться комплексный механизм раскисления с образованием частиц твердого раствора оксидов |SrO, CaO(FeO)|тв.р (состав твердого раствора меняется от практически чистого CaO до практически чистого SrO). При этом воз- можно достичь концентрации кислорода в жидкой стали в 0,001 мас. % [O], что говорит о достаточно высоких раскислительных свойствах подобных комплексных модификаторов. Так, если рассмотреть изотерму кислорода lg[O] = –2,2, то видно, что раскислительная способность кальция несколько ниже раскис-лительной способности стронция. Таким образом, видно, что термодинамика позволяет понять тонкие эффекты рафинирования.
Работа выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011.
Список литературы Термодинамический анализ процессов взаимодействия компонентов в системе Fe-Sr-Ca-O-С в условиях существования металлического расплава
- Модифицирование стали барием и стронцием / И.Д. Рожихина, О.И. Нохрина, В.И. Дмитриенко, М.А. Платонов // Известия высших учебных заведений. Черная металлургия. - 2015. -Т. 58, № 12. - С. 871-876. DOI: 10.17073/0368-0797-2015-12-871-876
- Модификатор для внепечной обработки стали, содержащий щелочноземельные металлы /И.Б. Проворова, Е.В. Розенберг, К.Э. Барановский и др. //Литье и металлургия. - 2016. -№ 2 (83). - С. 14-18.
- Methods for improving the efficiency of steel modifying / I.V. Bakin, G.G. Mikhailov, V.A. Golubtsov et al. // Materials Science Forum. - 2019. - Vol. 946. - P. 215-222. DOI: 10.4028/www. scientific. net/MSF.946.215
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М.: Издат. Дом МИСиС, 2009. - 520 с.
- Термодинамический анализ раскислительной способности стронция в жидком железе: диаграмма стабильности фаз в системах Fe-Sr-O и Fe-Mg-Sr-O / Г.Г. Михайлов, Л.А. Макровец, О.В. Самойлова, И.В. Бакин // Черная металлургия. Бюллетень научно-технической и экономической информации. - 2019. - Т. 75, № 12. - С. 1366-1372. DOI: 10.32339/0135-59102019-12-1366-1372
- Фазовые равновесия в жидкой стали, комплексно раскисленной алюминием и кальцием в присутствии магния / Г.Г. Михайлов, Л.А. Макровец, О.В. Самойлова, Л.А. Смирнов // Электрометаллургия. - 2019. - № 12. - С. 9-18. DOI: 10.31044/1684-5781-2019-0-12-9-18
- Jacob, K.T. The CaO-SrO-CuO-O2 system: Phase equilibria and thermodynamic properties at 1123 K / K.T. Jacob, P.M. Raj, Y. Waseda // Journal of Phase Equilibria. - 1995. - Vol. 16, no. 2. -P. 113-120. D0I:10.1007/bf02664848
- Risold, D. Thermodynamic modeling and calculation of phase equilibria in the strontium-calcium-copperoxygen system at ambient pressure / D. Risold, B. Hallstedt, L.J. Gauckler // Journal of the American Ceramic Society. - 1997. - Vol. 80, no. 3. - P. 537-550. DOI: 10.1111/j.1151-2916.199 7. tb02865. x
- Equilibrium phase diagrams for the systems PbO-SrO-CuO and PbO-CaO-SrO / H. Kitaguchi, J. Takada, K. Oda, Y. Miura // Journal of Materials Research. - 1990. - Vol. 5, no. 7. - P. 1397-1402. DOI: 10.1557/jmr.1990.1397
- Urusov, V.S. Simulation of the local structure and properties of the CaO-SrO and SrO-BaO solid solutions / V.S. Urusov, T.G. Petrova, N.N. Eremin //Doklady Physics. - 2003. - Vol. 48, no. 9. -P. 469-473. DOI: 10.1134/1.1616052
- Evaluation of phase diagrams for the Al2O3-CaO-SrO system by in-situ observation using con-focal laser microscope / T. Kuroki, Y. Saito, T. Matsui, K. Morita // Materials Transactions. - 2009. -Vol. 50, no. 2. - P. 254-260. DOI: 10.2320/matertrans.mra2008352
- Binary alkaline earth oxide mixtures: Estimation of the excess thermodynamic properties and calculation of the phase diagrams / W.J.M. Van der Kemp, J.G. Blok, P.R. Van der Linde et al. // Calphad. - 1994. - Vol. 18, no. 3. - P. 255-267. DOI: 10.1016/0364-5916(94)90032-9
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, С.Б. Олкокк. - М..: Металлургия, 1982. - 392 с.
- Darken, L.S. The system iron-oxygen. II. Equilibrium and thermodynamics of liquid oxide and other phases / L.S. Darken, R.W. Gurry // Journal of American Chemical Society. - 1946. - Vol. 68. -P. 798-816.
- Иргашов, Х. Термодинамические свойства оксида стронция в твердой и жидкой фазах / Х. Иргашов, В.Д. Тарасов, В.Я. Чеховской // Теплофизика высоких температур. - 1985. - Т. 23, № 1. - С. 86-91.
- Wriedt, H.A. The Ca-O (calcium-oxygen) system / H.A. Wriedt // Bulletin of Alloy Phase Diagrams. -1985. - Vol. 6, no. 4. - P. 337-342. DOI: 10.1007/BF02880517
- Schenck, H. Das System MnO(-FeO)-MgO(-CaO) und seine Verteilungsgleichgewichte mit flüssigem Mangan und Eisen-Mangan-Legierungen / H. Schenck, M.G. Frohberg, R. Nünninghoff // Archiv für das Eisenhüttenwesen. - 1964. - Vol. 35, no. 4. - P. 269-277. DOI: 10.1002/srin. 196402318
- Fuwa, T. The carbon-oxygen equilibria in liquid iron / T. Fuwa, J. Chipman // Trans. AIME. -1960. - Vol. 218. - P. 887-891.
- Sigworth, G.K. The thermodynamics of liquid dilute iron alloys / G.K. Sigworth, J.F. Elliott // Metal Science. - 1974. - Vol. 8. - P. 298-310.
- Mikhailov, G.G. On the interaction of calcium and oxygen in liquid iron / G.G. Mikhailov, D.A. Zherebtsov // Materials Science Forum. - 2016. - Vol. 843. - P. 52-61. DOI: 10.4028/www. scientific. net/MSF.843.52


