Термодинамический анализ процессов взаимодействия в системе Cu-S-O в условиях существования медного расплава
Автор: Трофимов Евгений Алексеевич, Михайлов Геннадий Георгиевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 36 (169), 2009 года.
Бесплатный доступ
Посредством термодинамических расчётов построена ПРКМ системы Cu-S-O, которая может быть использована для анализа имеющихся литературных данных, а также для анализа технологических процессов, связанных с взаимодействием серы с кислородом в медном расплаве. Работа проведена по научной программе Федерального агентства по образованию - «Развитие научного потенциала высшей школы (2009-2010 годы)», код проекта - 375 и при поддержке РФФИ, грант № 07-08-00365.
Медный расплав, сера, кислород, термодинамические расчёты
Короткий адрес: https://sciup.org/147156625
IDR: 147156625 | УДК: 669.33+541.123
Текст научной статьи Термодинамический анализ процессов взаимодействия в системе Cu-S-O в условиях существования медного расплава
Свойства расплава черновой меди при окислительном рафинировании и литье в значительной степени определяются содержанием серы и кислорода. В частности, образование газовой пористости в медных полуфабрикатах, в основном, - результат взаимодействий в системе Cu-S-O. Кроме того, информация о химических превращениях в этой системе имеет большое значение для изучения пирометаллургических процессов плавки сульфидных медных концентратов. В силу своей практической значимости данная система неоднократно становилась предметом как теоретических, так и экспериментальных исследований.
Согласно работам [1] (Язава А., Азаками Т.), [2] (Шмидл Дж. и др.), а также данным, приведённым А.С. Пашинкиным с соавторами в работе [3], при рассматриваемых температурах в системе Cu-S-O могут находиться следующие фазы: жидкая медь с растворёнными в ней серой и кислородом, твёрдые и жидкие оксиды и сульфиды меди (Си2О и Cu2S) и газовая фаза, состоящая из смеси SO2 с О2 и S2.
Уравнения, описывающие реакции взаимодействия между этими фазами, а также температурные зависимости констант равновесия этих реакций приведены в табл. 1. Температурные зависимости параметров взаимодействия первого порядка для растворенных в жидкой меди серы и кислорода приведены в табл. 2.
Большая часть значений, приведённых в табл. 1 и 2, заимствована из работ [4-8], другие рассчитаны с использованием данных, приведённых в этих работах.
Используя приведённые константы, задавая температуру и общее давление газовой фазы (при условии, что она содержит только SO2, S2 и О2), можно рассчитать концентрации серы и кислорода в жидкой меди, а также составы сопряжённых с этой медью неметаллических фаз и газовой фазы. Таким образом, можно рассчитать координаты поверхности растворимости компонентов в металле (ПРКМ) для данной системы.
Известно, что куприт с халькозином взаимодействуют по схеме
2 /Си2О/т + /Cu2S/T= 6 Си + {SO2}.
Начинается это взаимодействие при температурах значительно более низких, чем рассматриваемые нами.
Согласно данным, приведённым в работе [3], уже при температуре 730 °C парциальное давление SO2 в газовой фазе, находящейся в равновесии с твёрдой фазой, должно составлять 0,102 МПа, а при температуре 1052 °C - 0,653 МПа.
Следовательно, если суммарное давление газовой фазы равно 0,101 МПа или даже несколько превышает это значение, происходит вырождение псевдобинарной диаграммы Cu2S-Cu2O. Это явление найдёт отражение и на ПРКМ системы Cu-S-O. Появится область составов металла, которые сопряжены только с газовой фазой.
На рис. 1 построена ПРКМ системы Cu-S-O, изотермы растворимости кислорода и серы в жидкой меди и изобары давления SO2 в газовой фазе.
На ПРКМ приведены точные координаты изотерм растворимости и границ фазовых равновесий.
Таблица 1
Температурные зависимости констант равновесия процессов взаимодействия в системе Cu-S-O
|
№ |
Процесс |
Выражение для константы равновесия |
Температурная зависимость, IgK (давление, МПа; концентрация, мае. %) |
|
1 |
(Cu2O) = 2Си + [0] |
= °[О] /а(Си2О) |
-3140 /Т+ 2,250 |
|
2 |
/Си2О/ = 2Си + [0] |
к = "[о] |
-6500 /Т+ 4,468 |
|
3 |
(Cu2S) = 2 Си + [S] |
К = ^[s] ^(Cu2S) |
- 1924 / 7 + 1,201 |
|
4 |
/Cu2S/ = 2 Си + [S] |
к = a[s] |
. -2514 / 7+1,622 |
|
5 |
{S02} = [S] + 2[О] |
^ = a[O]a[S]^(so2) |
-6520/7+0,996 |
|
6 |
0,5 {02} = [О] |
4451 /7-0,336 |
|
|
7 |
0,5 {S2} = [S] |
^ = a[S]/P(°S2) |
6247/7-0,686 |
Таблица 2
Параметры взаимодействия первого порядка в жидкой меди для системы Cu-S-0
|
№ |
Параметр взаимодействия |
Температурная зависимость |
|
1 |
-630/7+0,327 |
|
|
2 |
el |
- 1154 / 7 + 0,664 |
|
3 |
- 124/Т |
|
|
4 |
es° |
-248/7 |
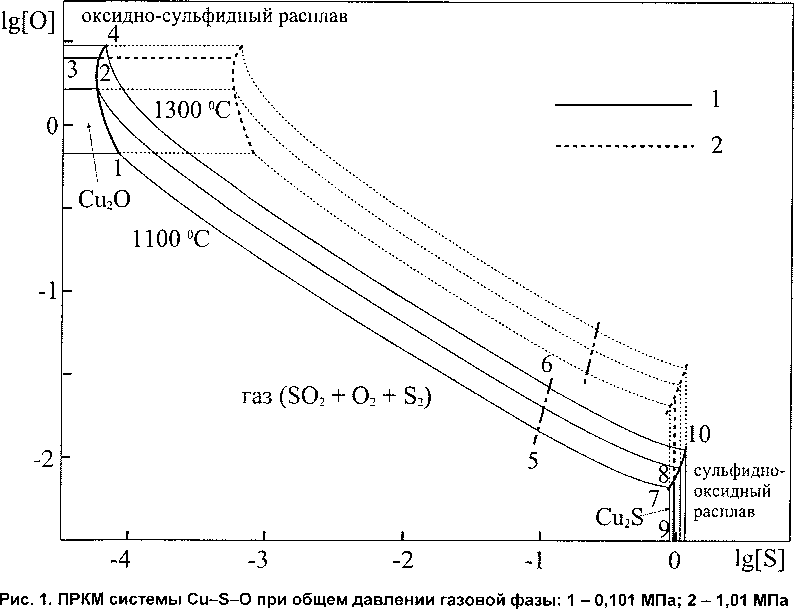
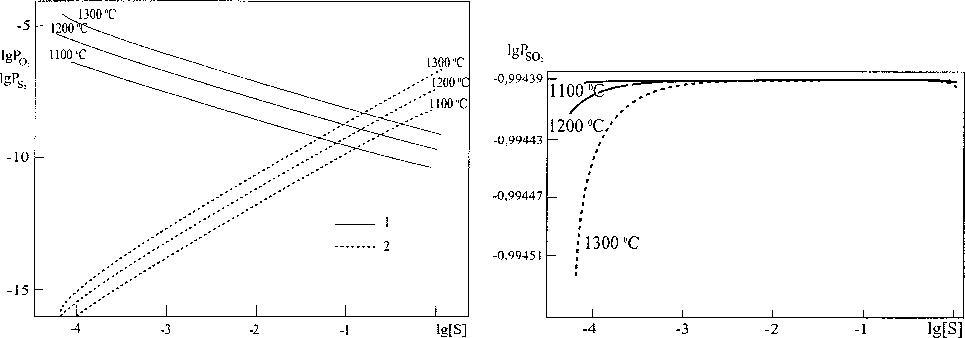
Рис. 2. Парциальные давления (МПа) кислорода (1) и серы (2) в области равновесия металла с газовой фазой в системе Cu-S-O при общем давлении газовой фазы 0,101 МПа
Рис. 3. Парциальное давление (МПа) сернистого газа в области равновесия металла с газовой фазой в системе Cu-S-O при общем давлении газовой фазы 0,101 МПа
Расчёт производился для двух различных величин суммарного давления газов в системе -0,101 МПа и 1,01 МПа.
Линия 1-2 показывает составы жидкого металла, находящегося в равновесии с твердым оксидом меди и газом. На линии 2-4 показаны составы металла, сопряженного с жидким неметаллическим расплавом на основе Си2О и газовой смесью. В обширной области между линиями 1-2-4 и 7-8-10 определены составы жидкого металла, находящегося в равновесии с газовой смесью, в которой основным компонентом является SO2, а также присутствуют кислород и пары серы. Линия 5-6 демонстрирует составы металла, равновесные с газом, в котором соотношение количеств серы и кислорода равно 1:2. Линия 7-8 показывает составы жидкого металла, находящегося в равновесии с твердым сульфидом меди и газом. На линии 8-10 определены составы металла, сопряженного с жидким неметаллическим расплавом на основе Cu2S и газовой смесью.
В области, ограниченной линиями 1-2-3, показаны составы медного расплава, находящегося в равновесии с твердым Си2О; а в области, ограниченной линиями 7-8-9, - с твердым Cu2S. Линии 3-2-4 ограничивают области составов медного расплава, равновесного с неметаллическим расплавом на основе Си2О, а линии 9-8-10 - области составов меди, равновесной с расплавом на основе Cu2S.
Изменения в составе газовой смеси, происходящие при увеличении содержания серы в медном расплаве, в ходе перемещения от границы металла, равновесного с оксидными конденсированными фазами, до границы металла, равновесного с сульфидными фазами, представлены на рис. 2 и 3.
Расчёты показывают, что с увеличением давления в системе будет происходить сближение границ 1-2-4 и 7-8-10 (см. рис. 1), однако, их смыкание возможно лишь при довольно высоких парциальных давлениях сернистого газа.
Так, согласно расчёту, результаты которого приведены в нашей ранней работе [9], необходимо давление порядка нескольких сотен МПа. Расчет, осуществлённый в ходе настоящей работы на основе уточнённого набора параметров, качественно подтверждает этот вывод. Такие значения расходятся с предположением Эллиотта о том, что такое смыкание возможно уже при парциальном давлении сернистого ангидрида порядка 0,8 МПа.
Заключение
Посредством термодинамических расчётов построена поверхность растворимости компонентов в металле для системы Cu-S-O, демонстрирующая, как количественные изменения в составах медного расплава и взаимодействующего с ним газа связаны с качественными изменениями в составе равновесных, сложных, конденсированных фаз. Результаты работы могут быть использованы для анализа технологических процессов производства и рафинирования меди, а также сплавов на её основе.
Работа проведена по научной программе Федерального агентства по образованию - «Развитие научного потенциала высшей школы (2009-2010 годы)», код проекта - 375 и при поддержке РФФИ, грант № 07-08-00365.
Список литературы Термодинамический анализ процессов взаимодействия в системе Cu-S-O в условиях существования медного расплава
- Yazawa A. Thermodinamyc studies of the liquid Cu-S-O system/A. Yazawa, T. Azakami//Canad. Metallurg. Quart. 1969. V. 8, № 3. P. 257-266.
- Schmiedl J. Phase equilibria in the pyrometallurgy of sulfide ores/J. Schmiedl, V. Repcak, S. Cempa//Trans. Inst. Mining and Met. 1977. V. 86, № 6. P. 88-93.
- Пашинкин A.C. Применение диаграмм парциальных давлений в металлургии/A.C. Пашинкин, М.М. Спивак, A.C. Малкова. М: Металлургия, 1984. 160 с.
- Пичугин Б.А. Влияние компонентов на растворимость кислорода в литейных бронзах/Б.А. Пичугин, Л.И. Гофеншефер, В.И. Рыжов//Литейное производство. 1977. № 10. С. 16.
- Куликов И.С. Раскисление металлов/И.С. Куликов. М.: Металлургия, 1975. 504 с.
- Козлов В.А. Рафинирование меди/В.А. Козлов, С.С. Набойченко, Б.Н. Смирнов. М.: Металлургия, 1992. 268 с.
- Чурсин В.М. Плавка медных сплавов (Физико-химические и технологические основы)/В.М. Чурсин. М.: Металлургия, 1982. 152 с.
- Туркдоган Е.Т. Физическая химия высокотемпературных процессов/Е.Т. Туркдоган; пер. с англ. Ю.И. Уточкина и В.И. Симонова. М.: Металлургия, 1985. 344 с.
- Трофимов Е.А. Анализ фазовых равновесий в системе Cu-S-O при температурах 1100-1300 °С/Е.А. Трофимов, Г.Г. Михайлов//Известия вузов. Цветная металлургия. 2005. № 1. С 4-9.


