Термодинамический анализ процессов взаимодействия в системе Cu-Zr-O, реализующихся в условиях существования медного расплава
Автор: Самойлова Ольга Владимировна, Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Трофимов Евгений Алексеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 4 т.14, 2014 года.
Бесплатный доступ
Выполнено термодинамическое моделирование процессов взаимодействия циркония и кислорода, растворенных в жидкой меди. Установлено, что компоненты системы Cu 2O-ZrO 2 сопряжены с жидким металлическим расплавом в системе Cu-Zr-O. С использованием данных о температурах и теплотах плавления оксидов Cu 2O и ZrO 2, а также положений субрегулярных ионных растворов и совершенных ионных растворов определены координаты линии ликвидус диаграммы состояния системы Cu 2O-ZrO 2. Расчет активностей оксида меди и оксида циркония показал, что и в области существования оксидного расплава имеют отрицательное отклонение от закона Рауля. Для интервала температур 1100-1300 °С построена поверхность растворимости компонентов в металле (ПРКМ) системы Cu-Zr-O. В ходе моделирования установлена температурная зависимость параметра взаимодействия первого порядка по Вагнеру в медном расплаве. Определены составы металлического расплава, равновесного с чистыми твердыми оксидами Cu 2O и ZrO 2, а также составы металлического расплава, равновесного с оксидным расплавом. Также определены линии трехфазных равновесий («жидкий металл - оксидный расплав - твердый оксид Cu 2O»; «жидкий металл - оксидный расплав - твердый оксид ZrO 2»; «жидкий металл - твердый оксид Cu 2O - твердый оксид ZrO 2») и точка четырехфазного равновесия «жидкий металл - оксидный расплав - твердый оксид Cu 2O - твердый оксид ZrO 2». На ПРКМ нанесены изотермы растворимости кислорода в жидкой меди и определен максимум раскислительной способности циркония. Установлена высокая раскислительная способность циркония в расплавах на основе меди.
Система cu-zr-o, термодинамическое моделирование, поверхность растворимости компонентов в металле, расплавы на основе меди
Короткий адрес: https://sciup.org/147156891
IDR: 147156891 | УДК: 669.33
Текст научной статьи Термодинамический анализ процессов взаимодействия в системе Cu-Zr-O, реализующихся в условиях существования медного расплава
Цирконий используется при плавке алюминиевых, хромистых бронз как модификатор, улучшающий свойства медных сплавов (например, жаропрочность). Также цирконий рекомендуется использовать при раскислении медноникелевых сплавов [1]. В литературе вопрос о термодинамике процессов взаимодействия, происходящих в системе Cu–Zr–O, практически не освещен. Целью данного исследования является термодинамический анализ системы Cu–Zr–O, выполненный с применением построения поверхности растворимости компонентов в металле (ПРКМ).
Методика термодинамического моделирования подробно изложена в монографии [2] и включает в себя: 1) расчет линий ликвидус оксидных диаграмм состояния с выбором модели, описывающей оксидный шлаковый расплав, находящийся в сопряжении с металлическим; 2) расчёт ПРКМ с использованием данных об оксидном шлаковом расплаве, о константах равновесия взаимодействия элементов в металлическом расплаве и данных о параметрах взаимодействия элементов в металлическом расплаве.
Сведения по диаграмме состояния системы Cu 2 O–ZrO 2 в литературе практически отсутствуют. Только в работе A.M.M. Gadalla и J. White [3] представлен фрагмент этой диаграммы, включающий точку эвтектики, положение которой характеризуется следующими данными: 7,35 мас. % ZrO2 и 1130 °С (рис. 1).
Для термодинамического моделирования оксидной системы в настоящей работе использовались приближения теории совершенных ионных растворов и теории субрегулярных ионных растворов. В качестве исходных данных использовались сведения о температурах и теплотах плавления чистых компонентов системы (табл. 1). Расчет с использованием теории совершенных ионных растворов позволил получить следующее положение точки эвтектики: 5,35 мас. % ZrO2 и 1223 °С (рис. 1, табл. 2). Существенная разница между рассчитанной и экспериментально определённой температурами точки эвтектики продиктовала необходимость использования более сложной модели. В качестве такой модели использовано приближение теории субрегулярных ионных растворов. Наилучший набор энергетических параметров теории Q , а также координаты точки эвтектики, которые эта модель позволила получить, представлены в табл. 2. Результаты расчёта линий ликвидус диаграммы состояния системы Cu2O–ZrO2 в сравнении с литературными данными показаны на рис. 1.
Для оценки адекватности проведенного термодинамического моделирования по теории субрегулярных ионных растворов с использованием полученных значений параметров теории Q были рассчитаны активности компонентов оксидного расплава a (Cu O) и a (ZrO ) . Результаты представлены на рис. 2. Расчет проведён только для концен-
Рис. 1. Результаты моделирования линии ликвидус диаграммы состояния системы Cu 2 O–ZrO 2 : сплошная линия – по теории субрегулярных ионных растворов; пунктир – по теории совершенных ионных растворов. Литературные данные A.M.M. Gadalla и J. White [3] нанесены штрихпунктиром. Римскими цифрами обозначены равновесные составы фаз, используемые при расчете
Таблица 1
Координаты точки эвтектики и энергетические параметры теории субрегулярных ионных растворов
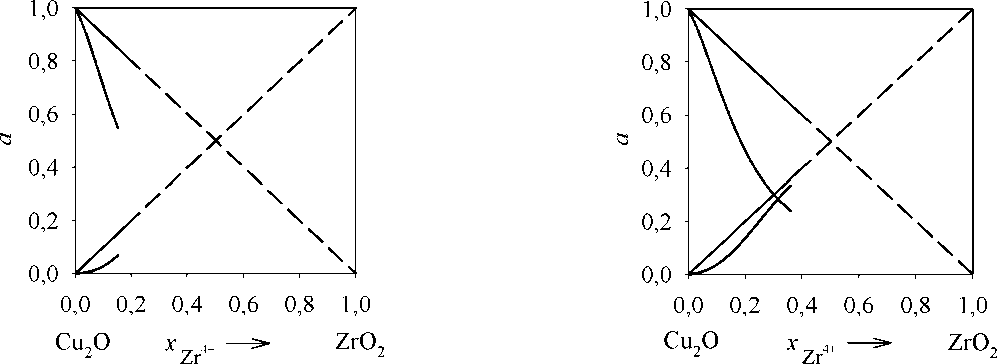
Данные о температурах и теплотах плавления веществ
|
Вещество |
o Tm , С |
Δ mH o o , Дж/моль T m |
Источник |
|
Cu 2 O |
1242 |
64 300 |
[4] |
|
ZrO 2 |
2680 |
86 944 |
[5] |
Таблица 2
|
Методика моделирования |
Резу л ьт ат ы ра счё та к оо рд и н а т т оч ки э вт ек т и ки |
Энергетические параметры теории субрегулярных ионных растворов |
||
|
Q 1112 , Дж/моль |
Q 1122 , Дж/моль |
Q 1222, Дж/моль |
||
|
Теория совершенных ионных растворов |
5, 35 мас . % ZrO 2 ; 1223 °С |
— |
— |
— |
|
Теория субрегулярных ионных растворов |
16 ,0 6 ма с. % ZrO 2 ; 1135 °С |
–39940 |
+18590 |
–29628 |
а) б)
Рис. 2. Зависимость активностей компонентов оксидного расплава (Cu2O, ZrO2) от состава: а) T = 1500 °С; б) T = 2000 °С. Расчёт по теории субрегулярных ионных растворов траций, при которых существует оксидный расплав. В этих интервалах a(Cu O) и a(ZrO ) характе- ризуются отрицательными отклонениями от закона Рауля.
Для построения ПРКМ необходимы сведения о константах равновесия реакций в исследуемой системе. Реакции, протекающие в медном расплаве системы Cu–Zr–O, и константы равновесия этих реакций приведены в табл. 3. Константы равновесия реакций с образованием компонентов шлакового расплава ( K ж ) и с образованием чистых твердых компонентов ( K тв) из компонентов металлического расплава связаны между собой через теплоту плавления A m H О о и температуру плавления T m
Tm чистого твердого компонента
1g K ж = 1g K тв - 1g K пл ;
оо
A m H 70 A m H то
1g K =-- m - +------ m- .
пл 2,3 ■ R ■ T 2,3 ■ R ■ T m
Здесь R – универсальная газовая постоянная; K пл – константа равновесия перехода твердого вещества в жидкое состояние.
Следует отметить, что компоненты шлакового расплава пишутся в круглых скобках, компоненты металлического расплава – в квадратных, а чистые твердые вещества указываются в прямых скобках.
Для моделирования ПРКМ необходимы также и сведения о параметрах взаимодействия компонентов в медном расплаве. Экспериментальные данные о значении параметра взаимодействия eOZr в жидкой меди в литературе не встречаются. В справочнике И.С. Куликова [7] этот параметр оценивается расчетным методом по эмпирической формуле, в результате чего параметр eOZr оказался равен –300 при 1473 К. Однако эмпирическая формула была выведена для разбавленных растворов на основе железа и при расчете разбавленных растворов на основе меди может давать значительную погрешность. В ходе расчета ПРКМ системы Cu–Zr–O в данной работе имелась возможность оценить значение этого параметра, исходя из термодинамики процессов взаимодействия кислорода и циркония, растворенных в медном расплаве. Согласно проведенному термодинамическому моделированию значение параметра eOZr равно –0,17 при 1473 К. Зависимость значений данного параметра от температуры приведена в табл. 4.
Для параметра e ZZrr в литературе данных не имеется. Однако значение этого параметра можно оценить, используя данные по активности циркония в медном расплаве для температуры 1673 К [9]. Для этого использовано соотношение
Zr = 1g a zr - 1g [ Zr, мас.% ]
Zr [ Zr, мас.% ]
.
Согласно расчету по литературным данным параметр e ZZrr равен –0,841 при 1673 К. Зависимость значений данного параметра от температуры приведена в табл. 4.
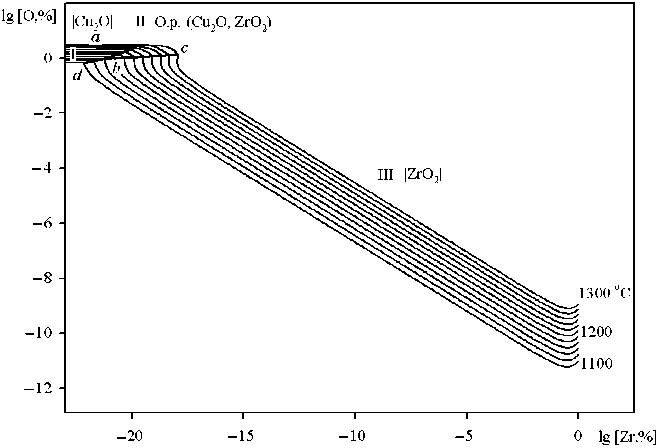
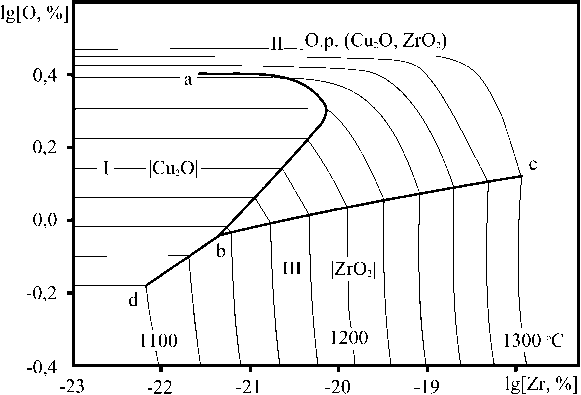
Результаты моделирования ПРКМ для системы Cu–Zr–O приведены на рис. 3. Линия a–b задает составы металлического расплава, равновесного с чистым твёрдым Cu2O и оксидным расплавом (Cu 2 O, ZrO 2 ). Линия b–c задает составы металлического расплава, равновесного с чистым твёрдым ZrO2 и оксидным расплавом (Cu2O, ZrO2). С увеличением температуры эта линия уходит в сторону больших концентраций циркония в металле. Линия b – d задает составы металлического расплава, равновесного с чистым твердым оксидом меди и чистым твердым оксидом циркония. В точке b в равновесии с металлическим расплавом находятся оксидный расплав, чистый твердый оксид меди и чистый твердый оксид циркония. В области I заданы составы металла, равновесного с чистым твер-
Таблица 3
Константы равновесия процессов взаимодействия медного расплава и сопряжённых фаз (lg K = A / T + B )
|
Уравнение реакции |
A |
B |
Источник |
|
(Cu 2 O) = 2 [Cu]+ [O] |
–3141 |
2,251 |
[6] |
|
(ZrO 2 ) = [Zr] + 2 [O] |
–41999 |
8,956 |
Данная работа |
|
|Cu 2 O| = 2 [Cu] + [O] |
–6500 |
4,468 |
[6] |
|
|ZrO 2 | = [Zr] + 2 [O] |
–46540 |
10,494 |
[7] |
Параметры взаимодействия первого порядка в медном расплаве e i j
Таблица 4
|
j i |
O |
Zr |
|
O |
- 630 + 0,327 [8] |
250 (данная работа) |
|
Zr |
1425 —— (данная работа) |
- 14^ [9] |
а)
б)
Рис. 3. ПРКМ системы Cu–Zr–O (в логарифмических координатах) для интервала температур 1100–1300 °С: а) общий вид; б) увеличенный фрагмент части с высоким содержанием кислорода
дым Cu2 O; с увеличением концентрации циркония концентрация растворенно го в меди кислорода остается практически неизменной. В области II заданы составы металла, равновесного с оксидным расплавом; концентрация растворенного в меди кислорода незначительно уменьшается с увелич е нием концентрации циркония. В области III зад аны сос тавы металла, равновесного с чистым тве рдым ZrO2 ; концентрация растворенного в меди кислорода резко уменьшается с увеличением с о держания циркония в металле. Таким образом, цирконий является сильным раскислителем для меди, что говорит также и о высокой возм ожно сти угара этого легирующего компонента. В о б ласти III концентрация растворенного в меди к и слорода уменьшается на несколько порядков от [О] ~ 10–1 до 10–11 мас. %. Даже при концентр ации
[Zr] = 10–10 мас. % в равновесии с металлом будет находиться чистый твердый оксид циркония. Максимальной раскислительной способности цирконий достигает при концентрации в 0,33 мас. %. Дальнейшие добавки циркония не приводят к уменьшению содержания кислорода.
Выводы
Впервые построена диаграмма раскислитель-ной способности циркония в жидкой меди. Результаты моделирования (в частности, построенная ПРКМ) демонстрируют высокую раскислительную способность циркония в меди. Даже при очень малых концентрациях циркония в медном расплаве, содержащем кислород, образование оксида меди термодинамически маловероятно. Такое свойство системы Cu–Zr–O необходимо учитывать при легировании медных сплавов цирконием. Для исключения потерь циркония при введении его в металлический медный расплав последний должен быть предельно раскислен.
Работа осуществлена при финансовой поддержке РФФИ, грант № 13-03-00534.
Список литературы Термодинамический анализ процессов взаимодействия в системе Cu-Zr-O, реализующихся в условиях существования медного расплава
- Производство отливок из сплавов цветных металлов: учеб. для вузов/А.В. Курдюмов, М.В. Пикунов, В.М. Чурсин, Е.Л. Бибиков. -М.: Металлургия, 1986. -416 с.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Gadalla, A.M.M. Equilibrium relationships in the system CuO-Cu2O-ZrO2/A.M.M. Gadalla, J. White//Transactions of the British Ceramic Society. -1966. -Vol. 65, no. 7. -P. 383-390.
- Химическая энциклопедия: в 5 т./под ред. И.Л. Кнунянца. -М.: Сов. энцикл. -1990. -Т. 2 -671 с.
- Кубашевский, О. Металлургическая термохимия/О. Кубашевский, С.Б. Олкокк. -М.: Металлургия, 1982. -392 с.
- Трофимов, Е.А. Взаимодействие никеля с кислородом в жидкой меди/Е.А. Трофимов, Г.Г. Михайлов//Известия вузов. Цветная металлургия. -2002. -№ 2. -С. 10-13.
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Линчевский, Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами/Б.В. Линчевский. -М.: Металлургия, 1986. -222 с.
- Gierlotka, W. Thermodynamic description of the binary Cu-Zr system/W. Gierlotka, K.-Ch. Zhang, Y.-P. Chang//Journal of Alloys and Compounds. -2011. -Vol. 509. -P. 8313-8318.


