Термодинамический анализ распределения элементов между металлическим и шлаковым расплавами
Автор: Антоненко В.И., Задорина A.C., Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 (43), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156525
IDR: 147156525 | УДК: 669.18.045.5
Текст обзорной статьи Термодинамический анализ распределения элементов между металлическим и шлаковым расплавами
В процессах выплавки и внепечной обработки выплавляемых сплавов различные элементы системы (кислород, сера, марганец и др.) распределяются между металлургическими фазами. При этом относительное содержание элементов в продуктах плавки определяется как валовым составом системы, так и термодинамическими свойствами фаз. Поэтому для получения металлических сплавов заданного состава необходимо оценить равновесное распределение элементов между фазами, и, прежде всего, между металлическим и шлаковым расплавами определяемое при рассмотрении обменных реакций, протекающих в системе:
[Fe]+[O] = (FeO),(1)
[Fe]+[S] = (FeS),(2)
[Mn]+[O] = (MnO).(3)
Температурная зависимость констант равновесия этих реакций определяется соотношениями [1]:
1 1 a(Fe0) 6320 Л ПИЛ lg ^i = 1g=--—— + 4,734,(4)
^[Fe]^[O]
lg^2=lg^L = ^+2,571,(5)
^[FeJ^S] 1
. „ , a(MnO)
lg^3=Ig—--- =--— + 5,45,(6)
a[Mn]a[O] 1
где a(Feo) • a(FeS) ’ a(MnO) ~ активности FeO, FeS и MnO в шлаке; ajOj, a^j, G[Fej, a^Mnj - активности кислорода, серы, железа и марганца в металле.
Таким образом, для расчета равновесного состава выплавляемого сплава необходимо определить активности компонентов металла и шлака.
В настоящей статье для расчета активностей компонентов металлического расплава использован метод параметров взаимодействия (метод Вагнера) [2], применяемый для относительно разбавленных растворов. Тогда активность элемента-растворителя (железа) будет равна его содержанию в сплаве, то есть ajFej = [Fe]. Для оценки активности компонентов шлакового расплава использована электростатическая теория ионных растворов (ЭСТИР) [3], основанная на учете состояния валентных электронов химических элементов.
Учитывая ионную природу шлаковых расплавов, состав их однозначно определяется ионными долями катионов, х{, и анионов, у у. При термодинамическом анализе таких растворов должны быть оценены активности всех соединений, образованных всеми металлами (катионами) и металлоидами (анионами), то есть должны быть определены и термодинамические числа молей компонентов раствора, A^B^j\ (в краткой записи -
Vij Vg компонента у). Соотношение числа атомов Vy металла сорта I, А^, и число атомов Vy металлоида сорта j, В^, в компонентах раствора строго постоянно, причем a* /а] = Vy ]vy , где а* и а] - соответственно валентности металла и металлоида в соединении ij.
На практике часто ионные растворы (шлаки) получают в результате смешивания отдельных соединений, взятых в определенном соотношении, или в результате протекания определенных обменных химических реакций, протекающих в системе между различными фазами, то есть число соединений, из которых образован раствор (шлак) может быть меньше числа термодинамических компонентов. Тогда термодинамическое число приведенных молей, например компонента л В;, . в растворе, содержащем один моль
VstlVst катионов (мольная доля приведенного компонента st) будет равна:
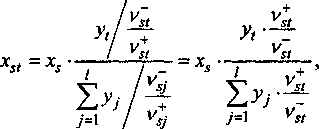
а так как v., /vt = а* а] , то
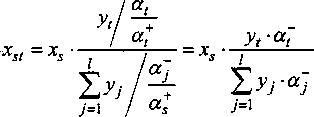
Тогда термодинамическое число молей компонента st в произвольном количестве расплава будет равно j=x
Эффективные заряды катиона z, еу, и аниона j, ^ в соединении оценивается при использовании таблиц электроотрицательностей атомов [4-6] и таблиц потенциалов ионизации атомов [7]. Объем раствора V является аддитивной функцией объемов компонентов. Ионная составляющая энергии катионов z со всеми ионами компонента mj в растворе определяется как показано в работе [8],
С учетом сделанных допущений химический потенциал компонента st запишется в виде:
/ v7,

FeO, мае. %
Рис. 1. Влияние добавок FeO на коэффициент распределения серы
Hsl=l4*RT
хзУА

\н
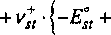
к
^5j xi Ei-st j=I
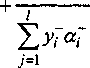
к к I
Z=1 /И—1 J=1
к I
Ы j=x
FeO, мас.%
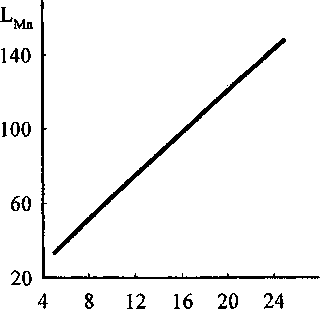
Рис. 2. Влияние добавок FeO на коэффициент распределения марганца
к к I i=l т=1 У=1
" о 2 г. ’ v 7
^rij Pflij
Предложенную модель ЭСТИР использовали для термодинамического анализа распределения кислорода, марганца и серы между металлической и шлаковой фазами с применением обычного для вне-печной обработки и ЭШП стали шлака, содержащего катионы Fe2+, Mn2+ , А13+ , Si4+, Mg2+, Са2+ .
В работе рассмотрены влияние добавок FeO к шлакам исходного состава и влияние замены СаО на SiO2 на равновесный коэффициент распределения марганца, серы, кислорода между шлаком и металлом.
На рис. 1, 2 показано влияние добавок FeO к шлаку базового состава, мае. %: СаО - 50, SiO2 -20, МпО - 5, MgO -15, А12О3 - 4,7 и FeS -0,5 на коэффициент распределения серы и марганца между шлаком и металлом ( Ц и ZMb ). Из рисунков видно, что при увеличении содержания FeO в оксидном расплаве коэффициент распределения серы падает, а величина равновесного распределения марганца растет, то есть содержание серы в металле растет, а марганца уменьшается.
На рис. 3, 4 показано влияние замены оксида кальция на диоксид кремния на величины Zg и ZMn . В шлаках, содержащих в мае. % МпО -10, MgO -10, А12О3 - 4,7 и FeS - 0,5 (содержание СаО, SiO2 и FeO приведено в подрисуночном тексте).

SiO2, мас.%
Рис. 3. Влияние замены СаО на SiO2 на коэффициент распределения серы.
1 - СаО + SiO2 = 70; FeO = 5; 2 - СаО + SiO2= 67,5; FeO = 7,5;
3 - СаО + SiO2= 65; FeO = 10
Антоненко В.И., Задорина, А.С., Михайлов Г.Г.
Термодинамический анализ распределения элементов между металлическим и шлаковым расплавами
SiO2, мас.%
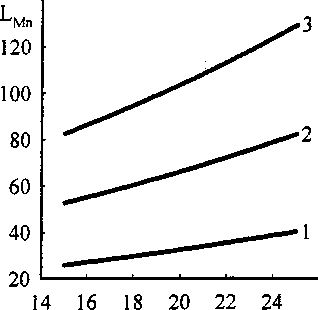
Рис. 4. Влияние замены СаО на SiO2 на коэффициент распределения марганца.
1 - СаО * SiO2 = 70; FeO = 5; 2 - СаО + SiO2 = 67,5; FeO = 7,5;
3 - СаО + SiO2 = 65; FeO = 10
SiO„ мас.%
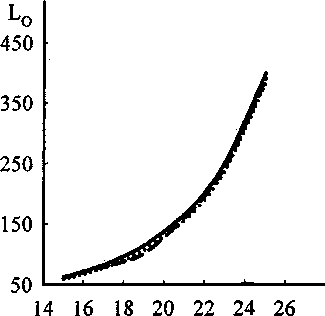
Рис. 5. Влияние замены СаО на SiO2 на коэффициент распределения кислорода.
........... СаО + SiO2 = 70; MgO = 10;
___СаО + SiO2 = 65; MgO = 15;
СаО + SiO2 = 60; MgO = 20
Видно, что при увеличении содержания SiO2 коэффициент распределения серы падает (рис. 3), в то же время величины равновесных коэффициентов распределения марганца и кислорода (рис. 4, 5)
увеличиваются. При оценке распределения кислорода взят шлак (содержание в мае. % FeO - 5, А120з - 4,7 и FeS - 0,5 ), в котором изменение содержания MgO, СаО и SiO2 приведено в подрисуночном тексте.
Выводы:
-
1. Используя электростатический вариант теории ионных расплавов, оценено влияние состава шлакового расплава на содержание кислорода, марганца и серы при внепечной обработке.
-
2. Показано, что увеличение содержание FeO и замена СаО на SiO2 приводит к повышению содержания серы и кислорода и уменьшению содержания марганца в металле, что согласуется с производственными данными и данными, приведенными в литературе.
Список литературы Термодинамический анализ распределения элементов между металлическим и шлаковым расплавами
- Эллиот Д.Ф., Глейзер М., Рамакришна В. Термохимия сталеплавильных процессов. -М.: Металлургия, 1969. -252 с.
- Григорян В.А., Белянчиков Л.Н., Стомахин А.Я. Теоретические основы сталеплавильных процессов. -М.: Металлургия, 1987. -271 с.
- Антоненко В.И., Задорина A.C. Электростатический вариант теории ионных растворов//Строение и свойства металлических и шлаковых расплавов: Труды XI российской конференции. -Екатеринбург-Челябинск: Изд-во ЮУрГУ. -2004. -Т. 1. -С. 104-106.
- Паулинг Л. Природа химической связи. -М.: Госхимиздат, 1974 -440 с.
- Бацанов С.С. Электроотрицательность элементов и химическая связь. -Новосибирск: СО АН СССР, 1962. -196 с.
- Барнард А. Теоретические основы неорганической химии. -М.: Наука, 1968. -361 с.
- Справочник химика. -Л.: ГНТИ Хим. литературы. 1962. -Т. 1. -С. 1069.
- Антоненко В.И., Задорина A.C., Михайлов Г.Г. Термодинамика ионных растворов. Расчет распределения серы между шлаком и металлом//Вестник ЮУрГУ. Серия «Металлургия». -2004. -Вып. 4-№ 8 (37). -С. 12-14.


