Термодинамический анализ реакций в процессе микродугового хромирования стали
Автор: Пустовойт Виктор Николаевич, Домбровский Юрий Маркович, Степанов Макар Степанович
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Технические науки
Статья в выпуске: 3 (78) т.14, 2014 года.
Бесплатный доступ
Показано, что существующие процессы диффузионного хромирования характеризуются рядом недостатков. Предложено использование технологии микродуговой химико-термической обработки для формирования карбидного покрытия на поверхности материала. Проведены термодинамические расчёты реакций восстановления оксида хрома, являющегося источником диффузанта. Выявлено, что наиболее вероятно протекание реакций восстановления оксида хрома метаном и углеродом с образованием атомарного хрома, а также последовательным по мере возрастания температуры нагрева образованием карбидов Cr 3C 2, Cr 7C 3 и Cr 23C 6. Осуществлена экспериментальная проверка полученных результатов. В результате упрочняющей обработки получен поверхностный слой на основе карбидов хрома глубиной 20-25 мкм, под которым расположена науглероженная зона эвтектоидной концентрации, а далее - исходная ферритно-перлитная структура.
Микродуговое хромирование стальных изделий, формирование поверхностного карбидного покрытия, термодинамические расчёты химических реакций
Короткий адрес: https://sciup.org/14250078
IDR: 14250078 | УДК: 621.793 | DOI: 10.12737/5701
Текст научной статьи Термодинамический анализ реакций в процессе микродугового хромирования стали
Введение. Одним из наиболее эффективных методов поверхностного упрочнения металлов и сплавов является химико-термическая обработка (КТО). Она достаточно проста и может быть реализована на любом предприятии, имеющем термический цех или участок. Однако традиционные процессы КТО (цементация, нитроцементация, азотирование) не всегда удовлетворяют современным требованиям, предъявляемым к деталям машин и инструменту. Это обусловливает интерес к процессам формирования диффузионных высокотвёрдых покрытий на основе карбидов, нитридов и боридов. Существующие технологии формирования таких покрытий отличаются большой продолжительностью, что сдерживает их практическое применение. Целью настоящей работы является изучение возможности интенсификации процесса формирования высокотвёрдых покрытий на основе карбидов хрома на поверхности стальных изделий.
Основные процессы диффузионного хромирования сталей. Результатам исследований диффузионного хромирования посвящено значительное число работ [1-5].
Наиболее распространён способ хромирования стальных изделий в герметизированном контейнере с насыщающей средой, который выдерживают в печи с температурой 1000-1200 °C в течение 6-8 часов. Предложено много вариантов состава порошковой смеси. Обычно это хром, низкоуглеродистый феррохром или окись хрома, инертные добавки, предотвращающие спекание частиц и прилипание к поверхности изделия (оксид алюминия, каолин, оксид магния, песок, огнеупорная глина), а также вещества-ускорители, генерирующие при нагреве активную газовую среду (чаще хлорид аммония).
После такой обработки в результате диффузии атомарного хрома на поверхности низкоуглеродистой стали образуется слой твёрдого раствора хрома в о-железе глубиной до 100 мкм, а в стали с содержанием углерода более 0,4 % — слой карбидов хрома Сг2зС6 и Сг7С3 глубиной до 30 мкм в результате встречной диффузии углерода из основного металла [2, 4]. Однако под карбидным слоем возникает обезуглероженная зона, что снижает механические свойства покрытия [5]. Для исключения обезуглероживания процесс упрочнения проводят в два этапа: первый — цементация, второй — диффузионное хромирование (процесс карбохромирования, [2]). Очевидно, что это усложняет процесс КТО, снижает его производительность и экономичность.
Для сокращения продолжительности процесса предлагали нагрев током высокой частоты (ТВЧ) изделия с обмазкой, содержащей источник хрома, связующее, а также флюс, образующий
Работа выполнена по теме №2.14.13 в рамках темплана ДГТУ.
галогениды, реагирующие с металлической поверхностью. Применение такой технологии позволяет получить диффузионный слой глубиной от 70 до 120 мкм при продолжительности обработки от 2-3 до 10-15 мин [1, 2]. Однако скоростной процесс не позволяет создавать поверхностные концентрации хрома и углерода, достаточные для образования карбидного слоя. В результате даже на высокоуглеродистых сталях диффузионный слой состоит только из твёрдого раствора хрома в а-железе [1, 2].
Таким образом, существующие процессы диффузионного хромирования, имеющие целью образование карбидного слоя, характеризуются рядом недостатков. Основными из них являются:
-
1. Большая продолжительность традиционного (печного) хромирования: 6-8 часов.
-
2. Невозможность создания карбидного слоя на поверхности малоуглеродистых сталей.
-
3. Появление под диффузионным слоем обезуглероженной зоны в средне- и высокоуглеродистых сталях.
-
4. Формирование сплошного карбидного слоя только в результате двойной КТО с обязательным этапом предварительной цементации перед хромированием.
-
5. Интенсификация процесса КТО с нагревом ТВЧ не приводит к формированию карбидного слоя из-за недостаточной концентрации хрома и углерода в поверхностном слое.
Применение микродуговой ХТО для формирования высокотвёрдых карбидных покрытий. Для формирования высокотвёрдых карбидных покрытий на сталях предложено использовать микродуговую ХТО (МДХТО) [6-8]. Обработка осуществляется на экспериментальной установке, обеспечивающей электронагрев образца, погружённого в контейнер с порошком каменного угля [8].
Особенностью данного процесса является возникновение микродуговых разрядов преимущественно в микрообъёмах порошка вокруг образца. Это явление обусловлено увеличением плотности тока в направлении от стенок контейнера к его оси. Температура нагрева изделия составляет 900-1200 °C. Однако локальный нагрев в местах контакта микродуг с поверхностью образца может достигать, по некоторым оценкам, семи тысяч градусов [9].
Применение этой технологии для цементации стали 20 показало, что науглероженный слой эвтектоидной концентрации глубиной до 0,3 мм может быть получен за 2-3 мин [8].
В этой связи представляло интерес изучение возможности применения МДХТО для создания карбидных покрытий на поверхности стали.
Учитывая большую трудоёмкость экспериментальных исследований данного процесса, был предпринят термодинамический анализ возможных химических реакций карбидообразования при МДХТО с насыщением хромом.
Обоснование применения термодинамического анализа. Движущей силой химических реакций является разность свободных энергий начального и конечного состояний взаимодействующих веществ. В качестве величин, характеризующих состояние термодинамических систем, используют энтальпию, энтропию, изобарно-изотермический потенциал (изменение энергии Гиббса).
Термодинамические расчёты заключаются в определении теплового эффекта реакции и основаны на следствии из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образований её продуктов за вычетом суммы энтальпий образований исходных веществ.
Изменение АС энергии Гиббса в результате химической реакции в стандартных условиях вычисляется по формуле:
^G = ^H-T^S где АН — стандартное изменение энтальпии; AS — стандартное изменение энтропии; Т— абсолютная температура.
Отрицательный знак ^G указывает на возможность самопроизвольного протекания реакции, положительный — на её термодинамическую невозможность, равенство нулю — на равно- веское состояние системы. Поэтому для определения температурного диапазона протекания реакции необходимо решить неравенство AG<0 относительно температуры.
Исследование процесса формирования покрытия на основе карбидов хрома. В качестве источника диффузанта использовали мелкодисперсный порошок оксида хрома Сг2О3. Учитывая, что формирование карбидного покрытия осуществляется в результате диффузии атомарного хрома, рассмотрим возможные реакции восстановления оксида. В случае МДХТО порошковая среда каменного угля обусловливает присутствие в реакционной среде в качестве восстановителей углерода, монооксида углерода и метана.
При проведении анализа учтены следующие реакции.
Углерод каменного угля взаимодействует при высокой температуре с кислородом воздуха с образованием оксида углерода, являющегося источником активного углерода. При контакте с металлической поверхностью он диссоциирует на атомарный углерод и диоксид углерода:
2С + О2 = 2СО
2СО = С + СО2
Атомарный углерод диффундирует в насыщаемый металл, а диоксид углерода взаимодействует с углеродом, обеспечивая непрерывность процесса за счёт регенерации монооксида углерода:
С + СО2 = 2СО
Кроме того, монооксид углерода на воздухе воспламеняется при температуре 700 °C и горит с образованием диоксида углерода и выделением тепла:
2СО + О2 = 2СО2 + 565 кДж
Возможно протекание целого ряда реакций взаимодействия оксида хрома с углеродом, оксидом углерода и метаном, при этом скорость химических реакций в значительной степени определяется степенью дисперсности исходных веществ.
Рассмотрим взаимодействие оксида хрома с углеродом и оксидом углерода.
Продуктами этих реакций могут быть как атомарный хром, так и его карбиды в сочетании с оксидом или диоксидом углерода. В системе Сг-С существуют следующие устойчивые карбиды: Сг7С3 (9,0 % С), Сг23Сб (5,7 % С), Сг3С2 (13,3 % С).
Для выявления наиболее вероятных реакций в температурном интервале МДХТО выпонен расчёт стандартного изменения энергии Гиббса ^G°.
Опубликован ряд работ, посвящённых восстановлению оксида Сг2О3, и выполнены термодинамические расчёты отдельных возможных реакций. Однако, поскольку данные различных источников отличаются, иногда на несколько порядков [10-12], предприняты проверочные расчёты стандартного изменения энергии Гиббса упомянутых реакций по общей методике с использованием единых справочных данных, что позволяет ожидать объективности такой оценки. Использовали метод Тёмкина — Шварцмана, как один из наиболее точных и учитывающий зависимость теплоёмкости от температуры [13].
Согласно этому методу, если теплоёмкость веществ, участвующих в реакции, выразить с помощью формулы:
Ср = а + b • Т + с -Т 2, то изменение энергии Гиббса можно определить из выражения: Д^ = А^ _ ^ _ ^Да + м^ + м где Да, ДД Дс— алгебраические суммы коэффициентов a, bv\ с температурного ряда теплоёмкости реакций, вычисленные аналогично расчёту стандартной энтальпии и энтропии, а величи- ны Мо, Му и M-г для различных температур вычислены Тёмкиным и Шварцманом. Величины коэффициентов a, Ьи с заимствованы из справочной литературы.
Изменение энергии Гиббса определяли для температур 1000 и 1500 К, а затем рассчитывали коэффициенты уравнения, исходя из линейной зависимости ^G от температуры.
Анализ полученных результатов показал, что возможные реакции можно разделить на три группы.
К первой группе относятся реакции 1-4 восстановления оксида хрома монооксидом углерода (табл. 1).
Таблица 1
Реакции восстановления оксида хрома монооксидом углерода
|
Реакция |
Зависимость \G; (кДж) от температуры Т(К) |
|
|
1 |
СГ2О3 +ЗСО = 2Сг + ЗСО2 |
2645 + 0,004x7 |
|
2 |
7Сг2О3 + ЗЗСО = 2Сг7С3 + 27СО2 |
608 + 1,04x7 |
|
3 |
23Сг2О3 + 93СО = 2Сг23Сб + 81СО2 |
3611 + 2,196x7 |
|
4 |
ЗСг20з + 17СО = 2Сг3С2 + 13СО2 |
32,5 + 0,631x7 |
Расчёт показал, что для этих реакций изменение энергии Гиббса положительно во всём интервале температур процесса МДХТО, поэтому эти реакции термодинамически невозможны (рис. 1).
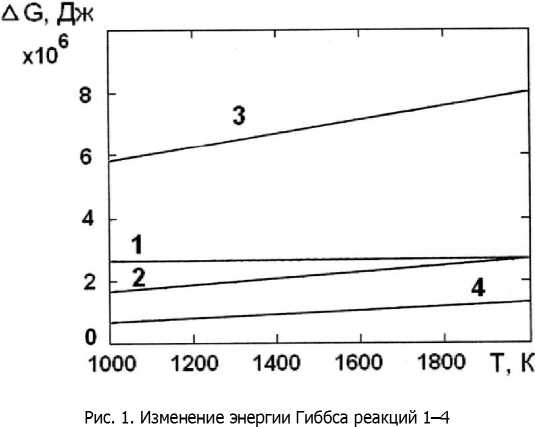
Ко второй группе относятся реакции 5-8 восстановления оксида хрома углеродом (табл. 2), для которых условие A(S<0 начинает выполняться при температурах 2101 К, 1852 К, 1746 К, 2375 К соответственно (рис. 2). Протекание этих реакций возможно лишь в локальных микрообъёмах поверхности стали под воздействием микродуговых разрядов.
Третью группу составляют реакции 9-12 восстановления оксида хрома углеродом (табл. 3), для которых условие A(S<0 начинает выполняться при более низких температурах 1513 К, 1416 К, 1365 К и 1460 К, что соответствует уровню температуры на поверхности образца при МДХТО (рис. 3).
Таблица 2
Реакции восстановления оксида хрома углеродом
|
№ |
Реакция |
Зависимость АС (кДж) от температуры Т(К) |
|
5 |
2Сг2О3 + ЗС = 4Сг + ЗСО2 |
1075,7 -0,512x7 |
|
6 |
14Сг2О3 + ЗЗС = 4Сг7С3 + 21СО2 |
6821-3,682x7 |
|
7 |
6Сг2О3 + 17С = 4Сг3С2 + 9СО2 |
2924,8-1,675x7 |
|
8 |
49Сг2О3 + 93С = 4Сг23Сб + 69СО2 |
25960-10,93x7 |
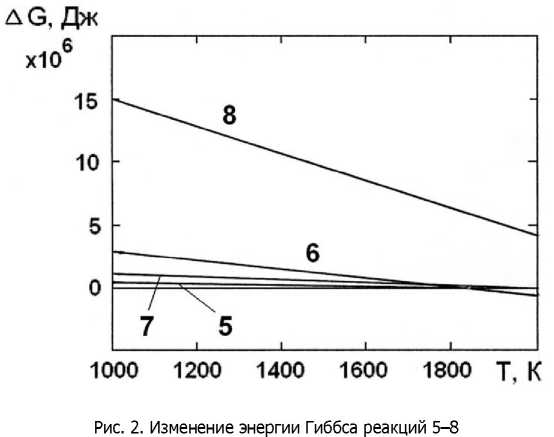
Таблица 3
|
№ |
Реакция |
Зависимость АС (кДж) от температуры Т(К) |
|
9 |
Сг2О3 + ЗС = 2Сг + ЗСО |
797,5 -0,527x7 |
|
10 |
7Сг2О3 + 27С = 2Сг7С3 + 21СО |
5176,8-3,655x7 |
|
11 |
ЗСг2О3 + 13С = 2Сг3С2 + 9СО |
2205,4- 1,615x7 |
|
12 |
23Сг2О3 + 81С = 2Сг23С6 + 69СО |
17238,8-11,802x7 |
Реакции восстановления оксида хрома углеродом
Анализ полученных зависимостей показал, что начиная с температуры 1365 К становится возможной реакция (11) восстановления оксида хрома углеродом с образованием карбида Сг3С2. При повышении температуры до 1456 К более вероятна реакция (10) восстановления оксида хрома углеродом с образованием карбида Сг7С3. Выше 1480 К наиболее вероятно протекание реакции (12) восстановления оксида хрома углеродом с образованием карбида Сг23Сб- Перечисленные карбиды формируются непосредственно из оксида, минуя стадию образования атомарного хрома. При температуре более 1513 К становится возможной реакция (9) образования атомарного хрома, и, следовательно, его диффузия в насыщаемую поверхность.
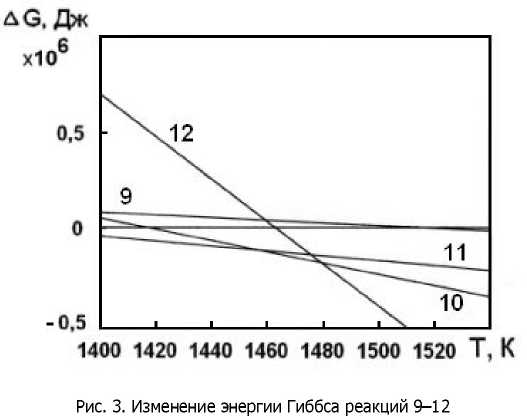
Таблица 4
Реакции восстановления оксида хрома метаном
|
№ |
Реакция |
Зависимость АС (кДж) от температуры Т(К) |
|
13 |
4Сг2О3 + ЗСН4 = 8Сг + 6Н2О + ЗСО2 |
2315,4-1,315x7 |
|
14 |
Сг2О3 + СН4 = 2Сг +2Н2О + СО |
675,2-0,44x7 |
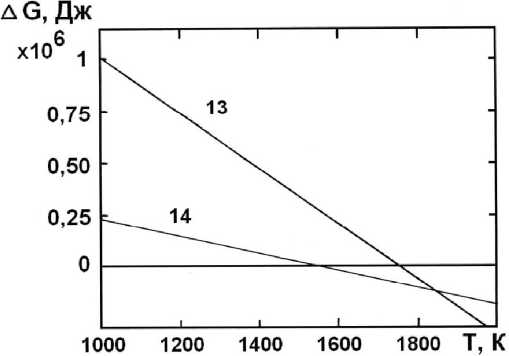
Рис. 4. Изменении энергии Гиббса реакций 13 и 14
Монооксид углерода, образующийся при протекании реакций 9-12, участвует в МДХТО наряду с монооксидом углерода, выделяющимся при нагревании каменного угля.
Рассмотрим взаимодействие оксида хрома с метаном (табл. 4).
Реакция (13) становится возможной, начиная с 1760 К, а реакция (14) — с 1535 К (рис. 4).
Таким образом, значение 1513 К можно считать начальной температурой образования атомарного хрома и протекания процесса диффузионного хромирования.
Для экспериментальной проверки проведённых расчётов было осуществлено диффузионное хромирование образцов из стали 20 в порошковой среде каменного угля. Для нанесения диффузанта использовалась гелеобразная электропроводная обмазка, содержащая оксид хрома
Сг2О3. Продолжительность процесса МДХТО составляла 3 мин. В результате обнаружено формирование слаботравящегося покрытия глубиной 20-25 мкм микротвёрдостью 11,5-13,0 ГПа, что соответствует микротвёрдости карбидов хрома. Под карбидным слоем расположена науглерожен-ная зона с перлитной структурой, а далее исходная ферритно-перлитная структура, характерная для стали 20 после отжига (рис. 5).
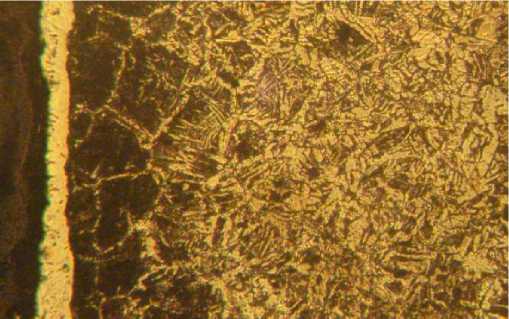
Рис. 5. Микроструктура стали 20 после микродугового хромирования, х 200
Выводы.
-
1. Существующие процессы диффузионного хромирования с целью создания карбидных покрытий на поверхности стальных изделий характеризуются рядом недостатков: большой продолжительностью; невозможностью формирования карбидного слоя на поверхности малоуглеродистых сталей; образованием обезуглероженной зоны при обработке средне- и высокоуглеродистых сталей; необходимостью комбинированной КТО с предварительной цементацией для формирования качественного упрочнённого слоя; отсутствием карбидного слоя при попытках интенсификации процесса КТО путём высокочастотного нагрева образцов с обмазками.
-
2. Термодинамический анализ показал, что при диффузионном хромировании методом МДХТО с использованием оксида Сг2О3 наиболее вероятно протекание реакций восстановления оксида метаном и углеродом с образованием атомарного хрома, а также последовательным по мере возрастания температуры нагрева образованием карбидов Сг3С2, Сг7С3 и Сг23С6.
-
3. Экспериментальная проверка МДХТО стали 20 с использованием Сг2О3 в качестве источника диффузанта подтвердила получение поверхностного слоя на основе карбидов хрома глубиной 20-25 мкм микротвёрдостью 11,5-13,0 ГПа, под которым расположена науглероженная зона эвтектоидной концентрации, а далее — исходная ферритно-перлитная структура.
Список литературы Термодинамический анализ реакций в процессе микродугового хромирования стали
- Электрохимико-термическая обработка металлов и сплавов/И. Н. Кидин [и др.]. -Москва: Металлургия, 1978. -320 с.
- Химико-термическая обработка металлов и сплавов: справ./Г. В. Борисёнок [и др.]. -Москва: Металлургия, 1981. -424 с.
- Лахтин, Ю. М. Химико-термическая обработка металлов/Ю. М. Лахтин, Б. Н. Арзамасов. -Москва: Металлургия, 1985. -256 с.
- Теория и технология химико-термической обработки/Л. Г. Ворошнин, О. Л. Менделеева, В. А. Сметкин. -Москва: Новое знание, 2010. -304 с.
- Диффузионные карбидные покрытия/В. Ф. Лоскутов [и др.]. -Киев: Тэхника, 1991. -168 с.
- Домбровский, Ю. М. Новые аспекты химико-термической обработки металлов в порошковых средах/Ю. М. Домбровский, М. С. Степанов//Вестн. Дон. гос. техн. ун-та. -2011. -Т. 11, № 8 (59), вып. 1. -С. 1217-1221.
- Домбровский, Ю. М. Выбор углеродсодержащей порошковой среды для микродуговой цементации металлических изделий/Ю. М. Домбровский, М. С. Степанов//Вестн. Дон. гос. техн. ун-та. -2013. -№ 3-4 (72-73). -С. 27-32.
- Домбровский, Ю. М. Микродуговая цементация стальных изделий в порошковых средах/Ю. М. Домбровский, М. С. Степанов//Упрочняющие технологии и покрытия. -2013. -№ 12. -С. 25-29.
- Электроискровое легирование металлических поверхностей/А. Е. Гитлевич [и др.]. -Кишинёв: Штиинца, 1985. -196 с.
- Теория и технология производства ферросплавов/М. И. Гасик, Н. П. Лякишев, Б. И. Емлин. -Москва: Металлургия, 1988. -784 с.
- Петрищев, А. С. Термодинамический анализ в системе Cr-O-C применительно к технологии металлизации хромосодержащего металлооксидного сырья/А. С. Петрищев, С. М. Григорьев, И. В. Прус//Науч. тр. Донец. нац. техн. ун-та. Серия: Металлургия. -2011. -Вып. 13. -С. 28-33.
- Meegoda, J. N. Conversion of Chromium Ore Processing Residue to Chrome Steel/Jay N. Meegoda, Wiwat Kamolpornwijit, Zhengbo Hu. Newark: New Jersey Institute of Technology, 2007. -49 p.
- Морачевский, А. Г. Термодинамические расчёты в металлургии/А. Г. Морачевский, И. Б. Сладков. -Москва: Металлургия, 1985. -136 с.


