Термодинамический анализ реакций взаимодействия марганца, кремния, магния, кальция, алюминия с кислородом в борсодержащем расплаве на основе железа
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Смирнов Леонид Андреевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 2 т.15, 2015 года.
Бесплатный доступ
Выполнен термодинамический анализ процессов взаимодействия бора, растворенного в жидкой стали, с компонентами металлического расплава: кислородом, алюминием, кальцием, магнием и углеродом. В работе, опираясь на результаты расчетов линий ликвидус для двойных диаграмм и поверхностей ликвидус для тройных оксидных диаграмм состояний с B 2O 3, разработана методика построения поверхностей растворимости компонентов в жидкой борсодержащей стали. Установлено, что марганец и кремний не способны блокировать окисление вводимого в сталь бора. В этом случае в основном бор при взаимодействии с кислородом, марганцем и кремнием образует жидкие оксидные (шлаковые) неметаллические включения. Кальций также не является эффективным защитником. Алюминий и магнийсодержащие лигатуры способны предотвратить окисление введенного в сталь бора и таким образом позволить стабилизировать технологию получения сталей, модифицированных бором. При тысячных долях процентов алюминия и магния исключается возможность взаимодействия растворенного в стали бора с оставшимся в стали кислородом. Для того чтобы сохранить в стали достаточное количество «эффективного бора», необходимо также разработать и эффективную систему деазотации стали за счет введения нитридообразующих элементов и вакуумирования.
Термодинамика, раскисление, рафинирование, бор
Короткий адрес: https://sciup.org/147156938
IDR: 147156938 | УДК: 669.017.3
Текст научной статьи Термодинамический анализ реакций взаимодействия марганца, кремния, магния, кальция, алюминия с кислородом в борсодержащем расплаве на основе железа
В работе [1] описано влияние микролегирования бором на механические свойства стали. Бор позволяет снизить анизотропию механических свойств, уменьшить размеры первичного литого зерна, увеличить прокаливаемость стали и повысить ее прочность при существенном снижении расхода легирующих компонентов. Максимальный эффект влияния бора достигается при содержании так называемого эффективного бора порядка 0,002–0,008 мас. %. Для того чтобы осознанно подходить к процессу легирования стали бором и его сохранению, необходимо рассмотреть, при каких содержаниях рафинирующих добавок, таких как алюминий, кальций, магний, кремний, марганец появляется возможность предохранить бор от взаимодействия с кислородом.
В работе [2] выполнены необходимые термодинамические расчеты оксидных борсодержащих двойных и тройных оксидных диаграмм состояний, установлены константы равновесия для реакций раскисления стали и процессов перехода оксидных компонентов из твердого в жидкое состояние (шлак). При проведении этих расчетов были установлены энергетические параметры теории субрегулярных растворов, интерпретирующей ак- тивности компонентов оксидных расплавов, подобраны значения параметров взаимодействия для компонентов в металлических расплавах. Это позволило создать систему определения оксидных фаз, сопряженных с областью существования металлических расплавов, и путем термодинамических расчетов установить строение поверхностей растворимости компонентов жидкой стали.
Равновесие бора с кислородом в присутствии углерода и других легирующих и раскисляющих компонентов описывается химическими реакциями, приведенными в табл. 1.
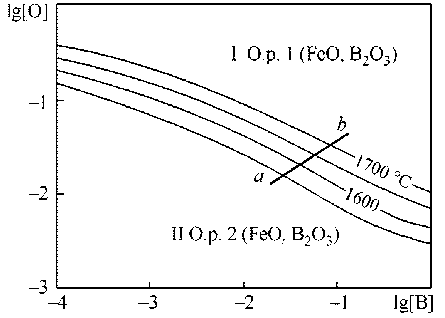
На рис. 1 приведена поверхность растворимости компонентов в жидком металле (ПРКМ) систем Fe–B–O (а) и Fe–B–C–O (б). Из рис. 1, а следует, что по раскислительной способности бор приближается к кремнию и несколько превосходит раскислительные способности марганца и ванадия. Металл может находиться только в равновесии с оксидным расплавом (в области I на основе оксида железа, в области II – на основе оксида бора). В присутствии углерода (рис. 1, б) возможно образование газовой фазы на основе СО.
Активности компонентов металлического расплава рассчитывали по методу Вагнера с ис-
Таблица 1
Температурные зависимости констант равновесия
|
№ |
Реакция |
lg K |
|
1 |
( FeO ) = [ Fe ] + [ O ] |
–6320/ Т + 4,734 |
|
2 |
( B 2 O 3 ) = 2 [ B ] + 3 [ O ] |
–44 005/ Т + 15,615 |
|
3 |
( SiO2 ) = [ Si ] + 2 [ O ] |
–30 225/ Т + 11,56 |
|
4 |
( MgO ) = [ Mg ] + [ O ] |
–22 457/ Т + 6,54 |
|
5 |
( CaO ) = [ Ca ] + [ O ] |
–31 480/ Т + 12,55 |
|
6 |
( MnO ) = [ Mn ] + [ O ] |
–12 175/ Т + 5,45 |
|
7 |
( AI 2 O 3 ) = 2 [ Al ] + 3 [ O ] |
–58 320/ Т +18,02 |
|
8 |
1 FeOU = [ Fe ] + [ O ] |
–8069/ Т + 5,8 |
|
9 |
| MgOL p = [ Mg ] + [ O ] |
–26 500/ Т + 7,85 |
|
10 |
1 CaOLe^ = [ Ca ] + [ O ] |
–34 103/ Т + 13,46 |
|
11 |
1 MnOL p = [ Mn ] + [ O ] |
–15 017/ Т + 6,77 |
|
12 |
SiO2 = [ Si ] + 2 [ O ] |
–31 000/ Т + 12,00 |
|
13 |
FeAl 2 O 4 = [ Fe ] + 2 [ Al ] + 4 [ O ] |
–74 580/ Т + 26,37 |
|
14 |
| AI 2 O 3I = 2 [ Al ] + 3 [ O ] |
–64 000/ Т + 20,48 |
|
15 |
{ CO } = [ C ] + [ O ] |
–1168/ Т – 2,07 |
|
16 |
{ CO 2 } = [ C ] + 2 [ O ] |
–9616/ Т + 2,51 |
|
17 |
{ Mg } = [ Mg ] |
6670/ Т – 6,48 |
|
18 |
{ Ca } = [ Ca ] |
–1912/ Т – 2,69 |
а)
б)
Рис. 1. ПРКМ системы Fe–B–O–C, T = 1600 °C, Pобщ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. % пользованием параметров взаимодействия элементов, растворенных в жидком железе [1]. Активности компонентов оксидных расплавов рассчитывали по теории субрегулярных ионных растворов, энергетические параметры данной теории приведены в работе [1].
Анализ диаграммы состояния тройной системы FeO–B2O3–SiO2 [2] и литературных данных позволил заключить, что в равновесии с метал- лическим расплавом могут находиться кремнезем и два оксидных расплава (FeO, SiO2, B2O3). В присутствии углерода возможно образование газовой фазы (СО, СО2). Поэтому возможные фазовые равновесия при раскислении железа бором описывали химическими реакциями, приведенными в табл. 1. При расчетах учитывали условия нормировки состава оксидного расплава I и II:
x ( Fe2+ )+ x ( Si4+ )+ x IB 3+ ) = 1; II II II
x ( Fe 2+ )+ x ( Si4+ )+ x ( b3+ ) = 1;
состава жидкого металла:
[ Fe ] + [ B ] + [ Si ] + [ O ] + [ C ] = 100 % и газовой фазы:
Робщ = p { CO } + p { CO 2 } .
Методика расчета составов равновесных фаз показана в монографии [3] на примере анализа равновесия жидкого металла с двумя оксидными фазами. При выполнении расчетов принималось, что оксидные расплавы представляют собой субрегулярные ионные растворы (подобранные энергетические параметры приведены в работе [2]).
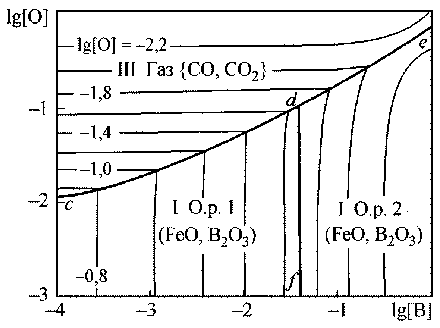
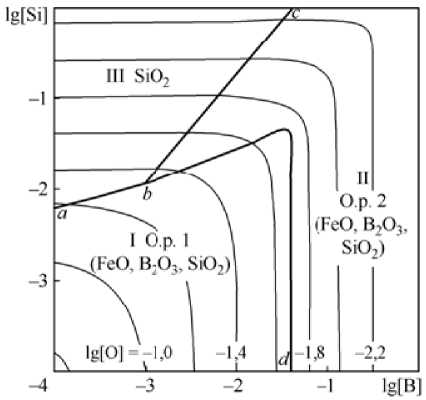
На рис. 2 представлены результаты расчета координат ПРКМ системы Fe–B–Si–O–С в виде проекции на плоскость составов при 1600 °С (а – [C] = 0; б – [C] = 0,1 мас. %). В областях I и II заданы составы жидкого металла, равновесного с оксидными расплавами; в области III – с кремнеземом, в области IV – с газовой фазой. Следует отметить на рис. 2 наличие двух зон составов металла, равновесного с оксидными расплавами. В области I оксидный расплав обогащен катионами железа Fe2+ (FeO), в области II содержится значительное количество катионов бора B3+ (B2O3) или катионов кремния Si4+ (SiO2), как это следует из рис. 2. Из рис. 2, а видно, что кремнезем может образоваться при концентрациях кремния более 0,01 мас. % и бора менее 0,04 мас. %, выше линии bc. Излом линии bd показывает изменение состава оксидного расплава с высокого содержания x(s.4+) на высокое содержание x(в3+), что соответствует диаграмме состояния FeO–B2O3–SiO2.
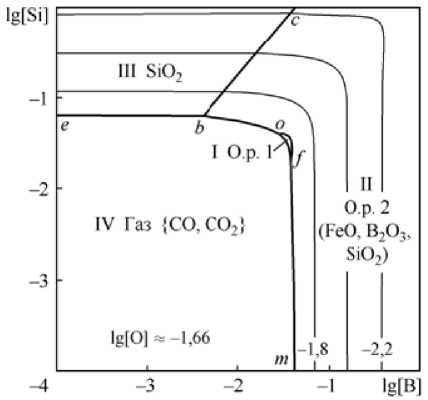
Углерод оказывает влияние на процессы комплексного раскисления железа бором и кремнием. Следует учитывать влияние давления, т. е. рассчитывать и строить изотермические и изосоставные сечения ПРКМ необходимо при заданном внешнем давлении. Такое сечение при 1600 °С и концентрации углерода 0,1 мас. % представлено на рис. 2, б. Для области IV практически характерно постоянное содержание кислорода в металле, которое определяется концентрацией углерода (lg [O] ~ –1,66 или [O] = 0,022). Из рис. 2, б видно, что углерод оказывает влияние на строение ПРКМ системы Fe–B–Si–O. В присутствии углерода кремний и бор могут быть раскислителями только при концентрациях больше десятой доли процента.
В табл. 2 приведены составы оксидных расплавов, отвечающих изокислородной линии lg[O] = –2,2 ([O] ≈ 0,063 мас. %). Видно, что при изменении концентрации кремния от 0,0001 до 0,01 мас. % оксидный расплав 2 состоит в основном из катионов B 2 O 3 .
а)
б)
Рис. 2. ПРКМ системы Fe–B–Si–O–С, T = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
Таблица 2
Составы оксидного и металлического расплавов, отвечающие изокислородной линии lg[O] = –2,2 (рис. 2, а)
|
lg[Si] |
lg[B] |
x ( Fe 2 + ) |
x ( b 3 + ) |
x ( Si4 +) |
|
–4,00 |
–0,50 |
0,0033 |
0,9967 |
0,0000 |
|
–2,80 |
–0,50 |
0,0033 |
0,9963 |
0,0004 |
|
–2,00 |
–0,50 |
0,0032 |
0,9941 |
0,0026 |
Аналогично рассмотрены системы Fe–B–Mg– O–C (рис. 3), Fe–B–Ca–O–C (рис. 4), Fe–B–Mn–O–C (рис. 5), Fe–B–Al–O–C (рис. 6).
На рис. 3, а представлены результаты расчета координат ПРКМ Fe–B–Mn–O в виде проекции на плоскость составов при 1600 °С. В области I заданы составы жидкого металла, равновесного с оксидным расплавом; в области II – с твердым раствором оксидов на основе MgO. Линия cd показывает проекцию области составов металла, равновесного с газообразным магнием. Из рис. 3, а видно, что магний участвует в раскислении – или в виде комплексного раскислителя с бором с образованием жидких оксидных включений, или в виде чистого магния.
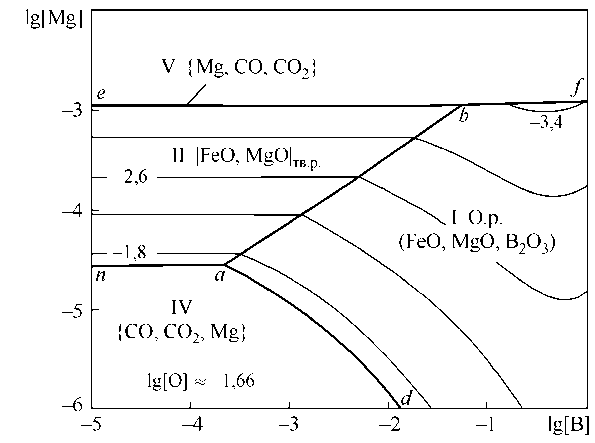
Изотермическое и изосоставное сечение ПРКМ при 1600 °С и концентрации углерода 0,1 мас. % представлено на рис. 3, б. В области IV нанесены составы жидкого металла, равновесного с газовой фазой на основе СО ( p CO ≈ 0,98 атм), в области V – на основе газообразного магния ( p Mg ≈ 0,98 атм). Область IV характеризует постоянное содержание кислорода в металле, которое определяется концентрацией [O] = 0,022 мас. %.
Из табл. 3 и рис. 3, а следует, что мольная доля Х (в3 + ) при концентрации магния 10 4 -10 5 мас. % может достигать в оксидной фазе величин 0,3–0,6 при lg[O] = –2,2 и концентрации бора в металле от 0,001 до 0,1 мас. %.
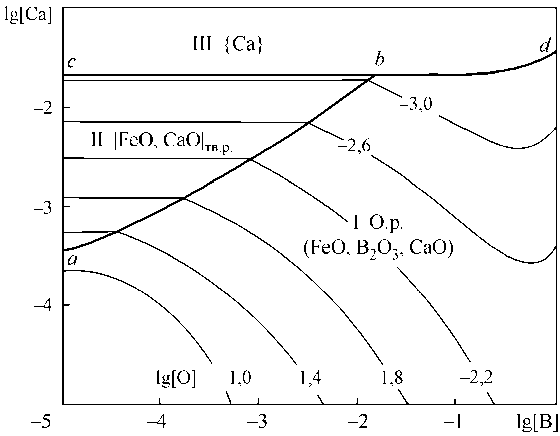
На рис. 4, а представлены результаты расчета координат ПРКМ Fe–B–Ca–O в виде проекции на плоскость составов при 1600 °С. В области I заданы составы жидкого металла, равновесного с оксидным расплавом; в области II – с твердым раствором оксидов на основе CaO. Линия no показывает проекцию области составов металла, равновесного с газообразным кальцием. Из рис. 4, а видно, что кальций участвует в раскислении при любых концентрациях – или в виде комплексного раскислителя с бором с образованием жидких оксидных включений, или в виде чистого раскислителя с образованием CaO. При концентрации кальция в жидком металле порядка сотых долей процента и концентрации бора порядка тысячных долей процента на раскисление будет расходоваться в основном кальций.
В табл. 4 также можно отметить, что при содержании в металле кальция на уровне 0,0001– 0,003 мас. % в оксидном расплаве х^ в3+ ) = 0,32-0,62. Концентрация бора при этом изменяется от 0,001 до 0,1 мас. %
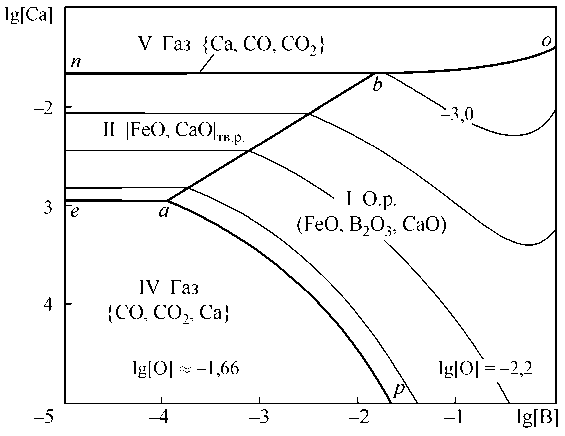
Изотермическое (1600 °С) и изосоставное ([C] = 0,1 мас. %) сечение ПРКМ Fe–B–Ca–O–C приведено на рис. 4, б. В области IV нанесены составы жидкого металла, равновесного с газовой фазой на основе СО ( p CO ≈ 0,95 атм), в области V – основе газообразного кальция ( p Ca ≈ 0,96 атм). Область IV характеризует постоянное содержание
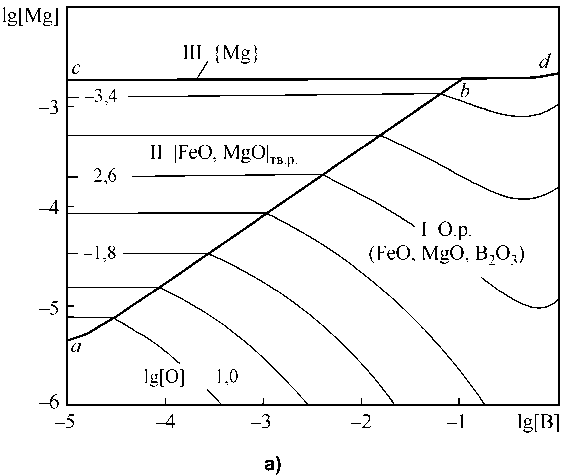
Рис. 3. ПРКМ системы Fe–B–Mg–O–C, T = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
б)
Таблица 3
Составы оксидного и металлического расплавов, отвечающие изокислородной линии lg[O] = –2,2 (рис. 3, а)
|
lg[Mg] |
lg[B] |
x ( Fe2 + ) |
x ( b 3 + ) |
x ( Mg2 + ) |
|
–4,0725 |
–3,00 |
0,004 |
0,317 |
0,679 |
|
–4,8177 |
–1,80 |
0,005 |
0,455 |
0,540 |
|
–5,6358 |
–1,00 |
0,011 |
0,596 |
0,393 |
а)
Рис. 4. ПРКМ системы Fe–B–Са–O–С, T = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
б)
Таблица 4
Составы оксидного и металлического расплавов, отвечающие изокислородной линии lg[O] = –2,2 (рис. 4, а)
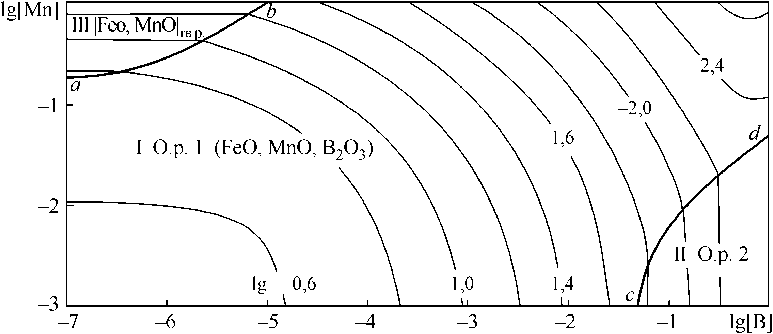
Были рассмотрены системы Fe–B–Mn–O–С ([C] = 0; 0,1 мас. %). На рис. 5, а представлены результаты расчета координат ПРКМ системы Fe–
B–Mn–O в виде проекции на плоскость составов при 1600 °С. Из вида ПРКМ следует, что в основном возможно образование жидких оксидных включений в данной системе. При концентрациях бора в жидком железе, отвечающих координатам
а)
б)
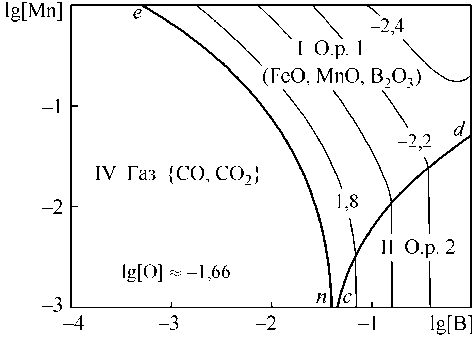
Рис. 5. ПРКМ системы Fe–B–Mn–O–C, T = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
а)
Рис. 6. ПРКМ системы Fe–B–Al–O–C, T = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
б)
линии cd , возможно образование оксидного расплава на основе B2O3. Изотермическое (1600 °С) и изосоставное (концентрация углерода 0,1 мас. %) сечение ПРКМ приведено на рис. 5, б. В области IV нанесены составы жидкого металла, равновесного с газовой фазой на основе СО. Эта область характеризует постоянное содержание кислорода в металле, которое определяется концентрацией углерода ([O] = 0,022 мас. %). Из рис. 5, б видно, что, например, при [Mn]< 0,1 мас. % и [В] < 0,01 мас. % раскислителем является углерод.
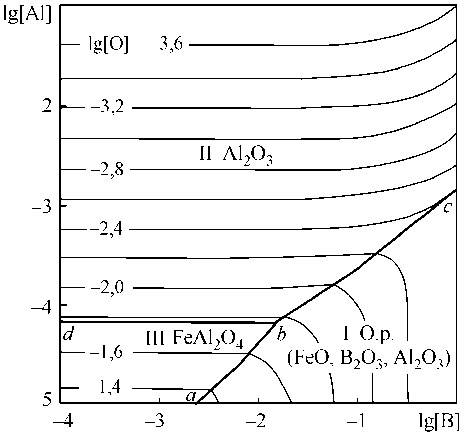
На рис. 6, а представлены результаты расчета координат ПРКМ Fe–B–Al–O в виде проекции на плоскость составов при 1600 °С. Из вида ПРКМ следует, что при концентрациях алюминия порядка 0,001–0,01 мас. % возможно образование в качестве неметаллического включения только корунда. Жидкие неметаллические включения при обычных концентрациях алюминия и бора в жидком железе не образуются.
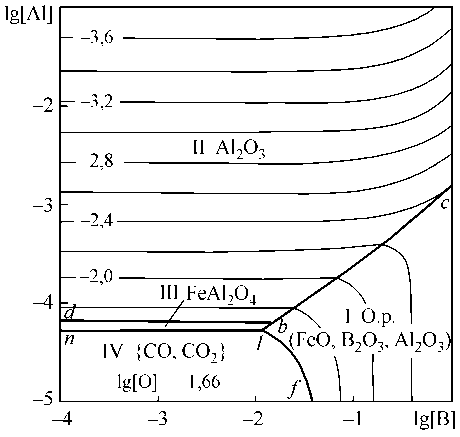
Рассчитано и построено изотермическое (1600 °С) и изосоставное ([C] = 0,1 мас. %) сечение ПРКМ системы Fe–B–Al–O–С (рис. 6, б). В области IV нанесены составы жидкого металла, равновесного с газовой фазой на основе СО. Эта область характеризует постоянное содержание кислорода в металле, которое определяется концентрацией углерода ([O] = 0,022 мас. %). Из рис. 6, б видно, что при обычных концентрациях раскислителя (алюминия) [Al] = 0,001 и [В] = 0,005 мас. % в равновесии с металлом будет только корунд и, следовательно, бор не будет окисляться кислородом металла.
Из табл. 6 и рис. 6, а следует, что в металле, содержащем тысячные доли бора, невозможно окисление бора в присутствии алюминия. Ощутимые количества окисленного бора могут появиться при образовании оксидного расплава (область I рис. 6, б).
Выполненные расчеты показывают, что в принципе предварительное глубокое раскисление стали алюминием, кальцием, и магнийсодержащими лигатурами создают условия для блокирования реакций окисления бора, вводимого на конечных стадиях рафинирования стали. Из работ А.Е. Сёмина и А.И. Потапова [4, 5] следует, что в основном перед введением бора в металл необходимо максимально снизить и содержание азота в стали путем введения сильных нитридообразующих элементов, таких как алюминий, титан, РЗМ. Причем нитридообразование будет происходить при температурах, близких к началу процесса кристаллизации стали, т. е. необходимо установить координаты ПРМ для систем Fe–Al–Ti–B–C–N–C.
Заключение
-
1. Установлены координаты поверхностей растворимости для систем Fe–B–Mg–O–C, Fe–B–Ca–O–C, Fe–B–Mn–O–C, Fe–B–Al–O–C, Fe–B–Si–O–C.
-
2. В результате термодинамического анализа определено, что при современных методах рафинирования стали, позволяющих достигнуть глубины рафинирования по кислороду до 0,0002 мас. %, введение бора после процесса раскисления не приводит к потерям эффективного бора за счет взаимодействия с остатками кислорода в стали.
-
3. Из последних литературных данных следует, что необходимо блокировать взаимодействие бора с азотом для получения стабильного содержания бора (эффективного бора) в стали путем введения сильных нитридообразующих компонентов и вакуумирования стали.
Работа поддержана грантом РФФИ № 13-08-12167.
Список литературы Термодинамический анализ реакций взаимодействия марганца, кремния, магния, кальция, алюминия с кислородом в борсодержащем расплаве на основе железа
- Еланский, Г.Н. Сталь и периодическая система элементов Д.И. Менделеева: учеб. пособие для вузов по направлению «Металлургия»/Г.Н. Еланский. -М.: МГВМИ, 2012 -196 с.
- Михайлов, Г.Г. Термодинамическое моделирование фазовых равновесий в оксидных системах, содержащих B2O3/Г.Г. Михайлов, Л.А. Макровец, Л.А. Смирнов//Вестник ЮУрГУ. Серия «Металлургия». -2014. -№ 14 (4). -С. 11-16.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСИС. -2009. -519 с.
- Потапов, А.И. Исследование процессов микролегирования стали бором с целью совершенствования технологии производства борсодержащей стали: автореф. дис. … канд. техн. наук/А.И. Потапов. -М.: МИСиС, 2013. -27 с.
- Влияние химического состава и режима аустенизации на прокаливаемость стали 35ГР/А.И. Потапов, И.Т. Маликов, В.И. Уразов, А.Г. Сёмин//Электрометаллургия, 2009. -№ 11. -С. 37-40.


