Термодинамический анализ систем «металл - кислород»
Автор: Леонович Борис Иванович, Трофимов Евгений Алексеевич, Дильдин Андрей Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.7, 2015 года.
Бесплатный доступ
На примере ряда систем «металл - кислород» (Cr-O, Mn-O, Fe-O и Ni-O) подробно описана методика термодинамического моделирования систем, включающих различные фазы переменного состава (металлический твёрдый и жидкий раствор, соединения с отклонениями от стехиометрии). Методика опирается на использование подрешёточной модели и полиномиальной модели Редлиха - Кистера. Продемонстрированы подходы к термодинамическому описанию жидких и твердых растворов кислорода в металле, а также оксидов различного состава и структурного типа (MeO, Me 3O 4 и Me 2O 3). Представлены выражения для энергий Гиббса рассмотренных фаз. Опираясь на описанные методики, построены фазовые диаграммы четырёх систем, а также температурные зависимости кислородного потенциала для изученных систем. Результаты расчёта сопоставлены с экспериментальными данными. Представленная информация может быть использована для анализа более сложных систем, включая системы, имеющие значение для металлургии.
Фазовые диаграммы, термодинамическое моделирование, сис- темы "металл-кислород", железо, хром, марганец, никель
Короткий адрес: https://sciup.org/147160304
IDR: 147160304 | УДК: 544.015.3
Текст научной статьи Термодинамический анализ систем «металл - кислород»
Сплавы и стали специального назначения, как правило, имеют довольно сложный состав. К числу их постоянных компонентов относятся хром, марганец, железо, никель и др. Взаимодействие этих элементов с растворенным кислородом приводит к образованию оксидных фаз. При производстве ферросплавов, лигатур, низколегированных сталей практическое значение имеют уже трехкомпонентные системы «основа - легирующий компонент - кислород». Расчет и анализ таких систем возможен, если известны термодинамические свойства основополагающих бинарных систем «металл - кислород».
Методика исследования
При термодинамическом моделировании фазовых равновесий в металлических сплавах, содержащих кислород, используется формализм и математический аппарат подрешеточной модели, в которой конфигурация раствора определяется совокупностью двух или более подрешеток [1 - 5].
Системы «металл – кислород» характеризуются образованием жидких и твердых растворов, а также оксидов различного состава и структурного типа (MeO, Me 3 O 4 и Me 2 O 3 ). На рис. 1–4 представлены диаграммы фазового равновесия и температурные зависимости кислородного потенциала систем Cr–O, Mn–O, Fe–O и Ni–O. При расчете областей устойчивости различных фаз были использованы термохимические параметры, приведенные в работах [6–13]. Сопоставление расчетных и экспериментальных значений проведено с использованием данных, представленных в работах [14–25].
Обсуждение результатов
Особенности моделирования фаз различных типов заслуживают обстоятельного обсуждения. Жидкие расплавы . Жидкая фаза в оксидных системах характеризуется интервалом несмешиваемости между металлическим и оксидным сплавами. Применительно к ионным расплавам состав жидкости, содержащей катионы металла и анионы кислорода, может быть определен следующим образом: ( Me iv i ) p (O 2 , Va - q ) q , где Me T‘ означает совокупность катионов с зарядом + v i , Va - гипотетическую вакансию с индуцированным зарядом - q . Подстрочные индексы p и q определяют электронейтральность и зависят от состава расплава следующим образом:
q = ^ '»м +"1 - (1)
p=2 y O -2 + q • ^- q .
В этих формулах y i обозначает концентрацию компонента расплава в пределах своей подрешетки. Следующее уравнение показывает связь y O –2 с молярной долей кислорода
_ q • У O -2
X~ -2 =
O p + q (1 - y Va - q )
.
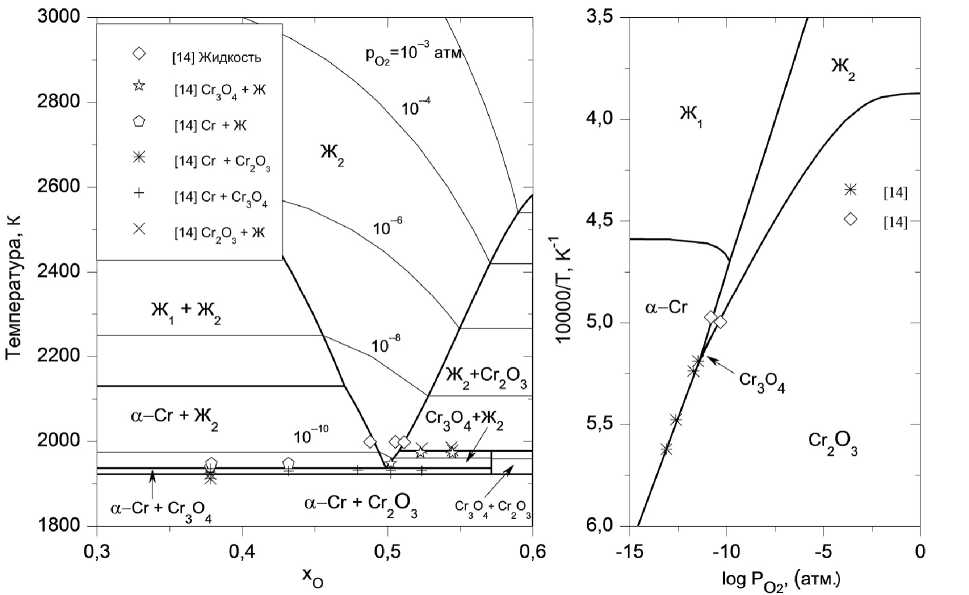
а) б)
Рис. 1. Фазовая диаграмма (а) и температурная зависимость кислородного потенциала (б) системы «хром–кислород»
Молярная энергия Гиббса бинарной системы «металл – кислород» задается уравнением
Gm = ^ УМе+ vi УO-2 GMe,+vi :O-2 + iii
+pRTZyMe + vi ln(yMe + vi ) + qRT[УO-2 ln(УO-2 ) + УУа—q ln(yV^a—q )] + iii
+^ yMe,+vi УO-2 yVa-q LMe+ vi :O-2 ,Va-q ’ iii где GoM +vi q-2 - энергия Гиббса образования (2 + vi) молей жидкого сплава; GoM +vi - энергия Гиббса образования vi моль жидкого металла; Lij - температурно-зависимые коэффициенты, значения которых выражаются полиномами Редлиха – Кистера:
LVJ = LOj + Li:j (yi - yj) + L^j (yi - yj )2+... = EL"y (yt - yy)n .(5)
n
В приведенных уравнениях и далее в подстрочных индексах запятая разделяет компоненты в одной подрешетке, а двоеточие означает различные подрешетки.
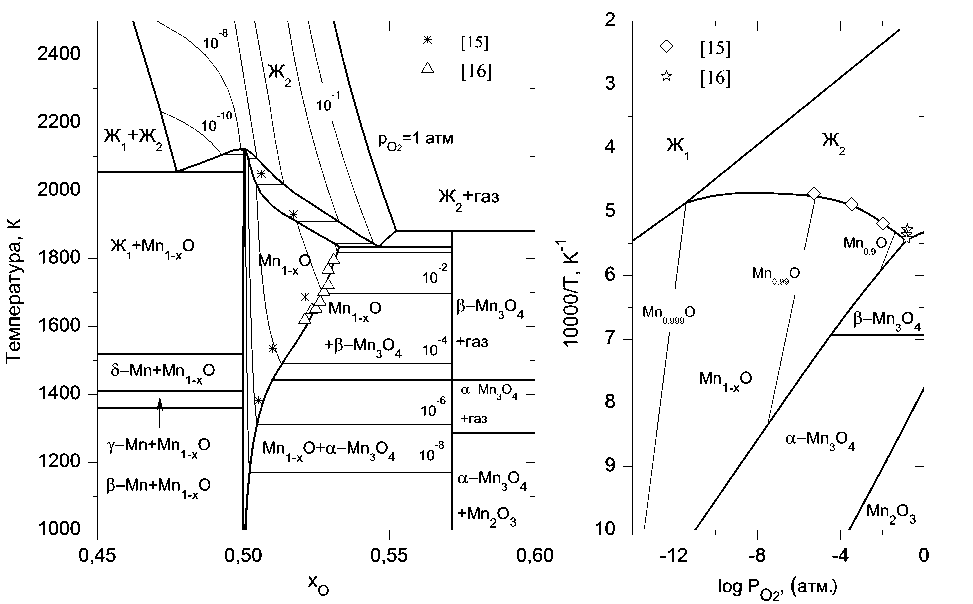
а) б)
Рис. 2. Фазовая диаграмма (а) и температурная зависимость кислородного потенциала (б) системы «марганец–кислород»
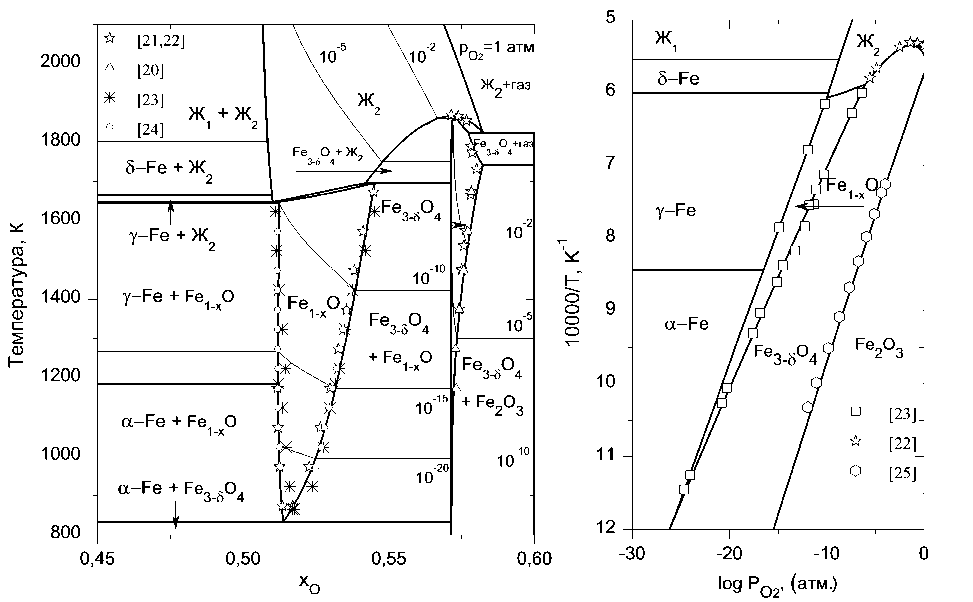
а)
б)
Рис. 3. Фазовая диаграмма (а) и температурная зависимость кислородного потенциала (б) системы «железо–кислород»
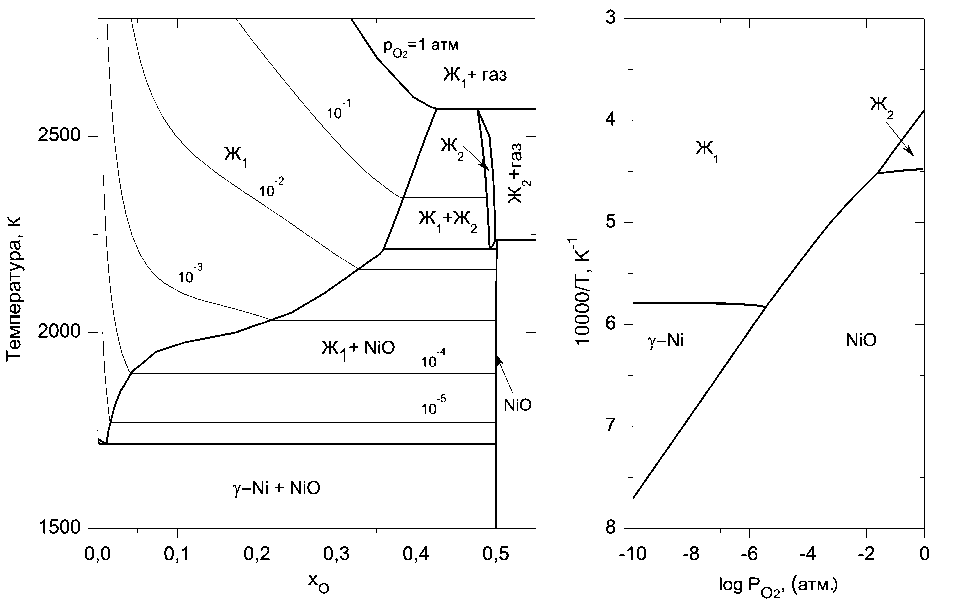
а)
б)
Рис. 4. Фазовая диаграмма (а) и температурная зависимость кислородного потенциала (б) системы «никель–кислород»
Парциальные молярные энергии Гиббса (химические потенциалы) могут быть вычислены по уравнению
G A : B
= G m
+^ m +d G m -z y i^ G'
d У a d y B i ( 5 y )
Области жидких расплавов, представленные на рис. 1–4, рассчитаны исходя из предположения о наличии в системах с хромом и никелем одного сорта катионов – Cr+3 или Ni+2 соответственно. В жидких растворах Fe–O и Mn–O устойчивыми считались два вида катионов – Me +2 и Me +3.
О.ц.к. и г.ц.к. – твердые растворы внедрения. Твердый раствор внедрения можно представить общей формулой ( Me ) a (O, Va ) c . В случае г.ц.к.-фазы а = с = 1, для о.ц.к.-фазы а = 1 и с = 3. Образование такого раствора можно также представить смешением гипотетических соединений Me a O c и Me a Va c . Молярная энергия Гиббса такого «трехкомпонентного» раствора (при y Me =1) может быть задана уравнением
G m = У O GMe :O + / Va G MeVa + cRT ( У O ln У O + / Va ln У Уа ) +
+ y O yVa [ L MeOVa + ( y O y Va ) L Me :O, Va + ( y O y Va ) L Me^-.OVa ] + G m
Магнитная составляющая энергии Гиббса задается формулой
GmarH. = RT ln(P +1) f (t) , где t = T/TC; TC и в - значения температуры Кюри и магнетона Бора соответственно.
При т < 1:
.
f ( т ) = 1 —
79 т- 1
474 ( 1
140 p 494 ( p
— 1
т т
т 15 И
v 6 + 135 + 600 v
A .
При т > 1:
f ( т ) =
г
т
-5 - ]5 - 25 A
т т
—
V 10 + 315 + 1500 y
A ,
где A = 15125 + 15975 ( j — 1 ) . Значение р определяется структурным типом раствора. Для о.ц.к. - растворов р = 0,4 и p = 0,28 для структуры г.ц.к.
Состав твердого раствора определяется мольными долями веществ в каждой подрешетке: y O = ( a / c ) x O /(1 – x O ) и y C + y Va = 1. (11)
Монооксиды ( Me O). В структуре монооксидов переменного состава кислород образует г.ц.к.-решетку, а ионы металла занимают октаэдрические позиции. В общем случае состав фазы может быть описан формулой ( Me + 2, Me +3, Va )1(O-2)1. При описании нестехиометрического оксида железа (вюстита) была использована модель комбинирования энергий, предложенная Хиллертом [1, 5]:
Gm y Me + 2 G Me + 2:O — 2 + y Me + 3 G Me + 3:O
2 + y VaGVa :O — 2 +
+ RT ( y Me + 2 ln y Me + 2 + y Me + 3 ln y Me + 3 + y Va ln y Va ) + G m 6'
,
где переменные ум ^+2 и ум ^.3 - доля мест в металлической подрешетке, занятой двухвалентными и трехвалентными ионами. При этом yM ^+2 + ум g+2 + yV a = 1.
Избыточная энергия Гиббса G m изб может быть описана полиномом Редлиха – Кистера (5):
Gm yM e + 2 y Me + 3 [ L Mee + 2, Me + 3 :O — 2 + ( y Me + 2
—
УМе + 3 ) L Mee + 2, Me + 3:O
2 ] +
+ y Me + 2 y Va [ L Mee + 2,Va :O — 2 + ( y Me + 2
—
+ y Me + 3 y Va [ L Me + 3, Va :O — 2 + ( y Me + 3
—
y Va ) L Mee + 2,Va :O y Va ) L Me + 3 ,Va :O
2 ] +
.— 2 ].
Потенциал кислорода нестехиометрического монооксида рассчитывается как разница молярных энергий Me 2 O 3 и MeO [12]:
G O 2 = 2 G Me 2 O 3
—
4 G Me O = 4 G Me + 3:O — 2
—
4 G Me + 2:O
2 + 2 G Va:O —2 .
При использовании уравнения (6)
и значения G o :O -2 = 0 формула преобразуется следующим
образом:
У .4
G = 4( G 0
O 2 v Me
—
GMe + 2 ) + RT ln
y Me + 3 y Va
I y Me + 2
+
У
+ 2(2 У ме + 2
—
2 e + з
—
y Me + 2 y Me + 3 ) L Me + 2, Me + 3 O
.—2 +
+ 4[( y Me + 2 y Me + 3 ) + y Me + 2 y Me + 3 ( y Me + 3
y Me + 2 2)] L Me + 2, Me + 3 :O — 2 .
В приведенной модели мольные доли могут быть рассчитаны из долей мест y i с использованием формул:
„ _ yMe + 2 + y Me + 3
x Me = , , ,
1 + y Me + 2 + y Me + 3
и X O =------------- 1 + y Me + 2 + y Me + 3
.
Максимальное значение y Me +2 =2/3, так что модель для фазы монооксида может таким образом описать диапазон составов для x O от 0,5 до 0,6.
Шпинельные фазы (Me 3 O 4 ). Структура шпинели имеет ионы кислорода в г.ц.к. подрешетке с двухвалентными и трехвалентными металлическими ионами в октаэдрических и тетраэдрических позициях. Число мест в октаэдрической подрешетке равно числу мест кислорода, тогда как тетраэдрическая подрешетка имеет в два раза больше мест. В такой структуре шпинели могут быть заняты только половина октаэдрических мест и одна восьмая тетраэдрических мест. В нормальной шпинели трехвалентные ионы занимают октаэдрические позиции, а двухвалентные – тетраэдрические.
При термодинамическом моделировании свойств оксидов наиболее сложно описывается магнетит (Fe 3 O 4 ). В работе [12] эта фаза описана как с избытком железа, так и с избытком кислорода. При низких температурах магнетит – обращенная шпинель с тетраэдрическими позициями, заполненными Fe+3. При этом октаэдрические места заняты совместно ионами Fe+3 и Fe+2. При повышении температуры магнетит трансформируется в нормальную шпинель и перед плавлением он почти неупорядочен. Таким образом, структура стехиометрического магнетита может быть представлена следующим образом: (Fe+2, Fe+3) 1 (Fe+2, Fe+3) 2 (O–2) 4 .
Молярная энергия Гиббса стехиометрической шпинели в зависимости от состава и температуры может быть описана уравнением tootoo
+ y Fe +3 y Fe +2 G Fe +3 :Fe+2 :O-2 + y Fe +2 y Fe +3 G Fe +3 :Fe+2 :O-2 +
+ RT ( У Fe+2 ln У te +2 + У ^+3 ln У ) + Fe Fe Fe Fe
+2RT(yo 2 Inyo 2 + yo 3 In yo 3),
Fe Fe Fe Fe где надстрочные индексы t и o означают тетраэдрическую и октаэдрическую решетки соответственно.
Введем обозначения: y* +3 = x , y . +2 = 1 - x , y o +3 = 1 - 0,5 x , y o +2 = 0,5 x . Fe Fe Fe Fe
Тогда уравнение для энергии Гиббса будет иметь вид:
+ RT [ x In x + (1 - x ) ln(1 - x )] +
+2 RT [(1 - 0,5 x) ln(1 - 0,5 x) + 0,5 x In 0,5 x ].(18)
Между ионами различной валентности имеет место обменная реакция. При равновесии упорядочение описывается следующим уравнением [12]:
< V t V0
°>5 В условиях повышенных температур и высоких значений потенциала кислорода для магнетита характерно отклонение от стехиометрии, что может быть учтено добавлением избытка Fe+3 в октаэдрические позиции соответствующего числа вакансий для поддержания электронейтральности. Измененная структура будет иметь вид (Fe+2, Fe+3)1 (Fe+2, Fe+3,Va)2(O–2)4. Если обозначить концентрацию вакансий yFa, такую структуру можно описать как Fe3_gO4, где 8=2yVa. На рис. 3 расчет нестехиометрического магнетита проведен по уравнению, полученному обработкой экспериментальных данных [20]. Другие шпинельные структуры считались стехиометрическими. Оксидные фазы (Me2O3). Общее название – корунд. Структура корунда моделируется тремя подрешетками (Me+2,Me+3)2(Me+3,Va)1(O"2)3. Goe+y^O^ определяет величину Go чистого полуторного оксида Me2O3. Обозначив концентрации компонентов y' первой подрешетки и y" - второй, уравнение для энергии Гиббса гомогенной фазы будет иметь вид: Gm yMe+2 yMe+3 GMe+2: Me+3:O-2 + yMe+3 УМй+3 GMe+3: Me+3:O-2 + +VMe+2 yVaGMe+2: Va :O-2 + VMe+3 yVaGMe+3: Va :O-2 + +2RT(VMe+2 lnVMe+2 +VMe+3 ln УMe+3) +RT(У"мe+3 ln УMe+3 +V'ValnV'Va )■ (20) На рис. оксидные фазы Me2O3 рассчитаны без учета возможности отклонения от стехиометрии. Заключение На примере ряда систем Cr–O, Mn–O, Fe–O и Ni–O описана методика термодинамического моделирования систем, включающих различные фазы переменного состава (металлический твёр- дый и жидкий раствор, соединения с отклонениями от стехиометрии и др.). Представлены выражения для энергий Гиббса рассмотренных фаз. Построены фазовые диаграммы, а также температурные зависимости кислородного потенциала для изученных систем. Результаты расчёта сопоставлены с литературными экспериментальными данными. Представленная информация может быть использована для анализа более сложных систем, включая системы, имеющие значение для металлургии.
Список литературы Термодинамический анализ систем «металл - кислород»
- Hillert.M, Staffanson L.J. The Regular Solution Model for Stoiohiometric Phases and Ionic Melts. Acta Chemica Scandinavica. 1970, vol. 24, no. 10, pp. 3618-3626.
- Sundman B., Agren J. A Regular Solution Model for Phases with Several Components and Sublattices, Suitable for Computer Applications. J. Phys. Chem. Solids. 1981, vol. 42, pp. 297-301.
- Hillert M., Jansson B., Sundman B., Agren J. A. Two-Sublattice Model for Molten Solutions with Different Tendency for Ionization. Metallurgical Transactions A. 1985, vol. 16A, no. 2, pp. 261-266.
- Sundman B. Modification of the Two-Sublattice Model for Liquids. CALPHAD. 1991, vol. 15, no. 2, pp. 109-119.
- Barry T.I., Dinsdale A.T., Gisby J.A., Hallstedt B., Hillert M., Jansson B., Sundman B., Taylor J.R. The Compound Energy Model for Ionic Solutions with Applications to Solid Oxides. J. Phase Equilibria. 1992, vol.13, no. 5, pp. 459-475.
- Povoden E., Grundy A. N., Gauckler L. J. Thermodynamic Reassessment of the Cr-O System in the Framework of Solid Oxide Fuel Cell (SOFC) Research. J. Phase Equilibria and Diffusion. 2006, vol. 27, no. 4, pp. 353362.
- Taylor J.R., Dinsdale A.T. A Thermodynamic Assessment of the Cr-Fe-O System. Z. Metallkunde. 1993, vol. 84, no. 5, pp. 335345.
- Kjellqvist L., Selleby M., Sundman B. Computer Coupling of Phase Diagrams and Thermochemistry. 2008, no. 32, pp. 577592.
- Wang M., Sundman B. Thermodynamic Assessment of the Mn-O System. Metallurgical Transaction B. 1992, vol. 23B, no. 12, pp. 821831.
- Grundy A.N., Hallstedt B., Gauckler L.J. Assessment of the Mn-O System. J. Phase Equilibria. 2003, vol. 24, no. 1, pp. 21-31.
- Kjellqvist L., Selleby M. Thermodynamic Assessment of the Fe-Mn-O System. J. Phase Equilibria and Diffusion. 2010, vol. 31, no. 2, pp. 113134.
- Sundman B. As Assessment of the Fe-O System. J. Phase Equilibria. 1991, vol. 12, no 1. pp. 127-140.
- Taylor J.R., Dinsdale A.T. A Thermodynamic Assessment of the Ni-O, Cr-O and Cr-Ni-O Systems Using the Ionic Liquid and Compound Energy Models. Z. Metallkunde. 1990, bd. 81, h. 5, s. 335345.
- Toker N.Y., Darken L.S.,. Muan A. Equilibrium Phase Relations and Thermodynamics of the Cr-O System in the Temperature Range of 1500 °C to 1825 °C. Metall. Trans. B. 1991, 22(2), pp. 225-232.
- Tromel G, Fix W., Koch K., Schaberg F. The Phase Diagram of the Manganese-Oxygen System. Erzmetall. 1976, 29, pp. 234-237 (in German).
- Schmahl N.G., Hennings D.F.K. The Phase Diagram of the Mn3O4-MnO System and Its Pressures of Dissociation. Arch. Eisenhuttenwes., 1969, 40, pp. 395-399 (in German).
- Keller M., Dieckmann R. Defect Structure and Transport Properties of Manganese Oxides: (I) The Nonstoichiometry of Manganosite (Mn1-O). Ber. Bunsenges. Phys. Chem., 1985, 89, pp. 883-93.
- O’Neill H.S., Pownceby M.I. Thermodynamic Data From Redox Reactions at High Temperatures. II. The MnO-Mn3O4 Oxygen Buffer and Implications for the Thermodynamic Properties of MnO and Mn2O3. Contrib. Mineral. Petrol., 1993, 114, pp. 315-20.
- Wriedt H.A. The FeO (IronOxygen) System. J. Phase Equilibria, 1991, vol. 12, no. 2, pp. 170-200.
- Dieckmann R. Defects and Cation Diffusion in Magnetite (IV): Nonstoichiometry and Point Defect Structure of Magnetite (Fe3-O4). Ber. Bunsenges. Phys. Chem. 1982, 86, pp. 112118.
- Darken L.S., Gurry R.W. The System iron-oxygen. 1. The wustite field and equilibria. J. Amer. Soc., 1945, vol. 67, pp. 1398-1412.
- Darken L.S., Gurry R.W. The System iron-oxygen. 2. Equilibrium and thermodynamics of liquid oxide and other phases. J. Amer. Soc., 1946, vol. 68, pp. 798-816.
- Vallet P., Raccah P. On the Studies of Thermodynamic Properties of Ferrous (in French). Mem. Sci. Rev. Metall., 1965, vol. 62, pp. 1-29.
- Лыкасов А.А., Карел К., Мень А.Н., Варшавский М.Т., Михайлов Г.Г. Физико-химические свойства вюстита и его растворов. Свердловск: УНЦ АН СССР, 1987. 230 с.
- G. G. Charette, S. N. Flengas Thermodynamic Properties of the Oxides of Fe, Ni, Pb, Cu, and Mn, by EMF Measurements. J. Electrochem. Soc., 1968, vol. 115, no. 8, pp. 796-804.


