Термодинамический анализ системы H2 - O2 - C
Автор: Кузнецов Юрий Серафимович, Качурина Ольга Ивановна, Малютина Елена Михайловна, Вяткин Герман Платонович, Гольдштейн Владимир Яковлевич, Дукмасов Владимир Георгиевич, Чаплыгин Борис Александрович, Пластинин Борис Глебович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
В гетерогенной смеси «Н2 - О2 - С» при повышенных температурах в результате протекания реакций окисления, ре акции водяного газа и двух реакций газификации углерода об разуется газовая смесь (H2 - H2O - CO - CO2). В работе выполнен термодинамический анализ возможных процессов, протекающих при температурах 700-1500 К в системе «Н2 - О2 - С». Определены равновесные параметры получающихся газовых композиций - их состав и окислительно-восстановительнные свойства. В любой газовой смеси, содержащей H2O и (или) CO2, весьма низкую концентрацию кислорода, образующегося в результате диссоциации H2O и CO2, принято определять величиной атм). При заданном общем давлении эта величина рассчитывается по составу газовой смеси и справочной информации по реакциям диссоциации H2O или CO2. Результаты выполненного анализа представляются двумя номограммами. Такие номограммы, во-первых, являются наглядным, альтернативным табличному, способом представления весьма обширной информации по свойствам сложных газовых атмосфер. Во-вторых, с использованием номограмм и справочной информации по упругостям диссоциации оксидов металлов можно оценить параметры восстановления этих оксидов. В бинарных газовых смесях (CO - CO2) и в водяном газе (H2 - H2O - CO - CO2) при определенных сочетаниях состава и температуры возможно образование сажистого углерода. Этим объясняется существование ограничений при температурах ниже ~ 1100 К в получении водяного газа с любыми концентрациями компонентов. Возможны различные по технологической и экономической целесообразности способы получения газовых смесей. В частности, при нагревании паров воды в контакте с избытком углерода до ~ 1100 К получается практически чистая эквимолярная смесь (H2 - CO) с высоким восстановительным потенциалом. Введение в эту систему водорода позволяет получить газовые смеси с чрезвычайно низким давлением кислорода, и это делает термодинамически возможным восстановление оксида любого металла. Проанализирована целесообразность представления полученной информации трехмерной диаграммой, построенной на концентрационном треугольнике «Н2 - О2 - С». Учет реакций образования метана приводит к заметным изменениям равновесных параметров газовых смесей лишь при температурах ниже примерно 900 К.
Водород, кислород, углерод, оксиды водорода и углерода, водяной газ, диссоциация паров воды и диоксида углерода, кислородный потенциал, сажистый углерод, hydrogen аnd carbon oxides
Короткий адрес: https://sciup.org/147232516
IDR: 147232516 | УДК: 546.26 | DOI: 10.14529/met180401
Текст научной статьи Термодинамический анализ системы H2 - O2 - C
Важнейшие металлургические процессы восстановления металлов практически всегда осуществляются с использованием твердого углерода и газовых фаз, основой которых является водяной газ H2 – H2O – CO – CO2. В реальных технологиях, например [1–8], создаются оптимальные параметры процессов восстановления металлов: избыток углерода (кокса), температура, состав газовой смеси. Любой процесс получения металлов из окси- дов связан с приготовлением восстановительной газовой смеси [9–13]. Выбор способа приготовления смеси должен базироваться на результатах термодинамического анализа системы H2 – O2 – C при повышенных температурах [9]. Результаты анализа вместо многочисленных громоздких таблиц можно представить различными номограммами [14] либо пространственной диаграммой, построенной на концентрационном треугольнике H2 –O2 – C [9].
Точки области I на концентрационном треугольнике (рис. 1) определяют возможные концентрации компонентов смеси H2O – CO2 – O2. Штриховые линии 1, 2 и 3 определяют газовые смеси, концентрации кислорода в которых равны 75, 50 и 25 мол. %. Область II определяет возможные параметры состояния водяного газа. Квазибинарное сечение nk, определяющее концентрацию смеси H2O – CO2, следует при повышенных температурах считать условной линией, разделяющей области I и II. На самом деле в смеси H2O – CO2 из-за диссоциации H2O и CO2 присутствуют незначительные количества O2, H2, CO и тем большие, чем выше температура. Штриховая линия 4, положение которой зависит от температуры, определяет состав водяного газа со следами H2, CO и O2.
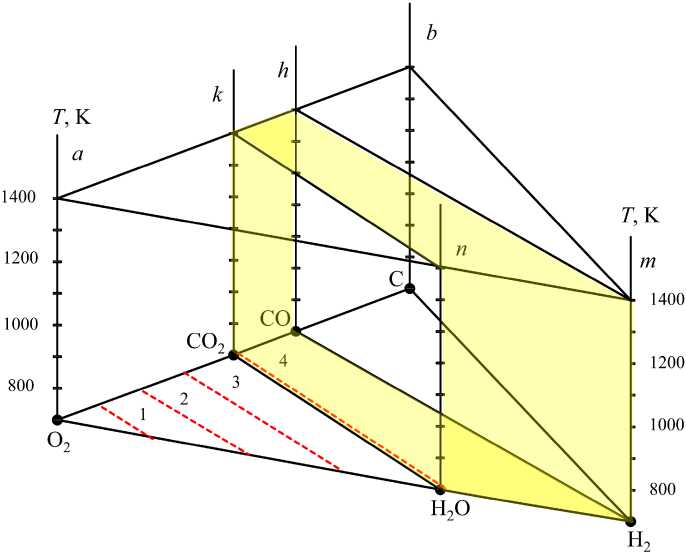
Рис. 1 а . Пространственная диаграмма системы C – O 2 – H 2 для интервала температур 700–1400 К
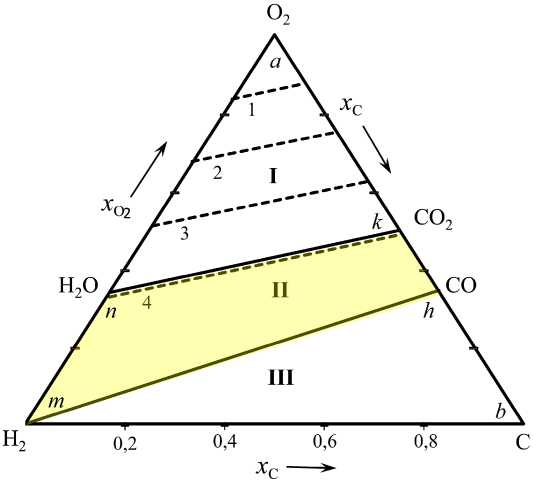
Рис. 1 б . Концентрационный треугольник системы H 2 – O 2 – C
Нижняя граница области II тоже не совпадает с линией квазибинарного сечения mh. Положение этой границы зависит от температуры и при температурах ниже 1100 К несовпадение границы с линией mh весьма существенно. Для определения положения этой граничной линии следует рассчитать возможные параметры равновесия водяного газа с углеродом Н2 – Н2О – СО – СО2 – С. Эти параметры должны определяться совместными равно- весиями реакции водяного газа и двух реакций газификаций углерода (стандартное изменение энергии Гиббса здесь и далее определяется в Дж):
В соответствии с правилом фаз Гиббса такая трехкомпонентная двухфазная система при фиксированном давлении и заданной температуре имеет одну степень свободы с = к – ф = 3 – 2 = 1.
Следовательно, для решения системы трех уравнений необходимо задавать какой-либо параметр равновесной системы. Если задать концентрацию СО, получаем такие уравнения для расчетов xCO , xH O и xH при заданной концентрации xCO и P = 1 атм:
x CO2
x C 2 O ;
K 2 ;
H2 +CO2=H2O+CO,
A r G T (1) = 36 580 - 33,465 ■ T ;
1 x CO x CO2 x H 2 O = ----ТЛ---
C+CO = 2CO,
2 (2)
A r G T (2) = 172140 - 177,7 ■ T ;
C+H O=CO+H ,
2 2 (3)
A G ^ (3) = 135 560 - 144,235 ■ T .
Из этих трех реакций лишь две независимые – любая из них может быть получена комбинацией двух других. Если рассматривать совместные равновесия, например, двух независимых реакций (1) и (2), то получаем систему трех расчетных уравнений с четырьмя неизвестными:
K 1
p H 2 O ■ p CO p H 2 ■ p CO 2
x . x A G (1)
x H2O x CO
—2------ = e RT ; (4)
x h2 ■ x CO 2
2 2 _ A r G T (2)
K2 _ A» _ xCO ■ p = e RT ;(5)
pCO2
^ xi _ xCO + xH2O + xCO2 + x H2 = 1.
x _ 1 x CO ( x CO / K 2 ) ;
H 2 1 + ( x CO / K 3 ) ;
xH2 _ 1 ■ xco _ a xH2O K1 xCO2
В соответствии с методом комбинирования реакция (3) получается вычитанием уравнения реакции (1) из уравнения реакции (2), то есть отношение констант K 2/ K 1 равно константе равновесия K 3.
Для примера в табл. 1–3 приведены ре- зультаты расчетов возможных составов равновесного с углеродом водяного газа для трех температур 800, 1000 и 1500 К, а на рис. 2 штриховыми линиями приведены нижние границы области II для шести температур в интервале 700–1500 К. Эти штриховые линии являются проекциями на концентрационный треугольник следов пересечения изотермиче-
Таблица 1
Параметры равновесия систем «Н 2 – Н 2 О – СО – СО 2 – С», вычисленные при заданных концентрациях СО, Т = 800 К, 1 атм
|
x CO |
x CO2 |
x H2O |
x H 2 |
(x x H O lg x, V H2 7 |
1g [ x C0^ 1 V x co 7 |
lg( p O 2 , атм ) |
|
0 |
0 |
0 |
1 |
– |
– |
– ∞ |
|
0,01 |
9,07Л0 -3 |
0,199 |
0,9610 |
–1,6839 |
–0,0424 |
–27,85 |
|
0,02 |
3,63 ■Ю -2 |
0,2768 |
0,6069 |
–0,3819 |
0,2584 |
–27,25 |
|
0,03 |
8,16 ^ 10 -2 |
0,3409 |
0,5475 |
–0,22058 |
0,4346 |
–26,89 |
|
0,05 |
0,2267 |
0,3684 |
0,3549 |
0,0162 |
0,6564 |
–26,45 |
|
0,0571 |
0,2959 |
0,3511 |
0,2959 |
0,0743 |
0,7145 |
–26,33 |
|
0,07 |
0,4442 |
0,2877 |
0,1981 |
0,1621 |
0,8025 |
–26,16 |
|
0,08 |
0,5802 |
0,2121 |
0,1277 |
0,2203 |
0,8605 |
–26,04 |
|
0,09 |
0,7344 |
0,1143 |
0,0612 |
0,2716 |
0,9117 |
–25,94 |
|
0,0920 |
0,7678 |
0,0920 |
0,0482 |
0,28907 |
0,9215 |
–25,92 |
|
0,0996 |
0,9004 |
0 |
0 |
– |
0,9560 |
–25,85 |
Таблица 2
|
x CO |
x CO2 |
x H2O |
x H2 |
x H O lg x„ к H2 J |
1 1 x CO2 1 lg l1 к x CO J |
lg( p O2 , атм ) |
|
0 |
0 |
0 |
1 |
– |
– |
- то * |
|
0,001 |
5,12 - 10 -7 |
3,7 - 10 -3 |
0,9953 |
–2,426 |
–3,290 |
–26,96 |
|
0,03 |
4,61 - 10 -4 |
0,0112 |
0,9588 |
–1,9325 |
–1,813 |
–23,95 |
|
0,05 |
1,28 - 10 -3 |
0,0164 |
0,932 |
–1,7540 |
–1,5907 |
–23,56 |
|
0,10 |
5,12 - 10 -3 |
0,0305 |
0,864 |
–1,4529 |
–1,2905 |
–22,96 |
|
0,20 |
0,0205 |
0,0513 |
0,728 |
–1,1520 |
–0,9892 |
–22,36* |
|
0,30 |
0,0461 |
0,0625 |
0,591 |
–0,9757 |
–0,8134 |
–22,01 |
|
0,40 |
0,0819 |
0,0639 |
0,454 |
–0,8516 |
–0,6888 |
–21,76* |
|
0,50 |
0,1281 |
0,0557 |
0,316 |
–0,7538 |
–0,5914 |
–21,56 |
|
0,60 |
0,1844 |
0,0376 |
0,178 |
–0,6752 |
–0,5133 |
–21,41* |
|
0,70 |
0,251 |
0,0097 |
0,0393 |
–0,6076 |
–0,4454 |
–21,27 |
|
0,7283 |
0,2717 |
0 |
0 |
– |
–0,4325 |
–21,24* |
* Информация приведена на рис. 5 линиями 5-9.
Таблица 3
|
x CO |
x CO2 |
x H2O |
x H2 |
x H O lg x„ к H2 J |
1 1 x CO2 1 lg l1 к x CO J |
lg( p O2 , атм ) |
|
0 |
0 |
0 |
1 |
– |
– |
- » * |
|
0,05 |
1,3-Ю -6 |
7,3 - 10 -5 |
0,95 |
–4,1144 |
–4,5865 |
–19,71 |
|
0,10 |
5,1-Ю -6 |
1,4-Ю -4 |
0,90 |
–3,8081 |
–4,2915 |
–19,12* |
|
0,20 |
2,0 - 10 -5 |
2,5-Ю -4 |
0,80 |
–3,5051 |
–4,0015 |
–18,54 |
|
0,30 |
4,6 - 10 -5 |
3,2-Ю -4 |
0,70 |
–3,3399 |
–3,8165 |
–18,17* |
|
0,40 |
8,2 - 10 -5 |
3,7-Ю -4 |
0,60 |
–3,2099 |
–3,6865 |
–17,91 |
|
0,50 |
1,3-Ю -4 |
3,8-Ю -4 |
0,50 |
–3,1192 |
–3,5864 |
–17,71* |
|
0,60 |
1,9-Ю -4 |
3,7 -Ю-4 |
0,40 |
–3,0339 |
–3,5015 |
–17,54 |
|
0,70 |
2,5-Ю -4 |
3,2-Ю -4 |
0,30 |
–2,9720 |
–3,4465 |
–17,43* |
|
0,80 |
3,3-Ю -4 |
2,5-Ю -4 |
0,20 |
–2,9031 |
–3,3865 |
–17,31 |
|
0,90 |
4,1 - 10 -4 |
1,4-Ю -4 |
0,10 |
–2,8539 |
–3,3415 |
–17,22* |
|
0,9995 |
5 ⋅ 10–4 |
0 |
0 |
– |
– |
–17,14* |
* Информация приведена на рис. 2 линиями 1-7.
Параметры равновесия систем «Н 2 – Н 2 О – СО – СО 2 – С», вычисленные при заданных концентрациях СО, T = 1000 К, 1 атм
Параметры равновесия системы «Н 2 – Н 2 О – СО – СО 2 – С», вычисленные при заданных концентрациях СО, T =1500 К, 1 атм
скими плоскостями криволинейной поли-термической поверхности (рис. 3), определяющей состав водяного газа в равновесии с углеродом. Слева все изотермы сходятся в точке m, первые строки табл. 1–3. Справа изотермы пересекают линию hk в точках, координаты которых определяют концентрацию смеси CO2 – CO, равновесной с углеродом, последние строки табл. 1–3. Каждая из множества точек на таких изотермах определяет возможный состав водяного газа, равновесного с углеродом. При температуре 1500 К в водяном газе, равновесном с углеродом, концентрации H2O и CO2 практически равны нулю и нижняя граница области II совпадает с квазибинарным сечением mh. Штриховые линии, соединяющие точки граничных линий с точкой b, являются конодами, соответствующими строго определенным величинам кислородных потенциалов газов (расчет приведен ниже). Концы конод определяют природу и состав равновесных фаз. На рис. 2 показаны коноды для температуры 1500 К (табл. 3), на рис. 4 – для 800 К (табл. 1) и на рис. 5 – для 1000 К (табл. 2).
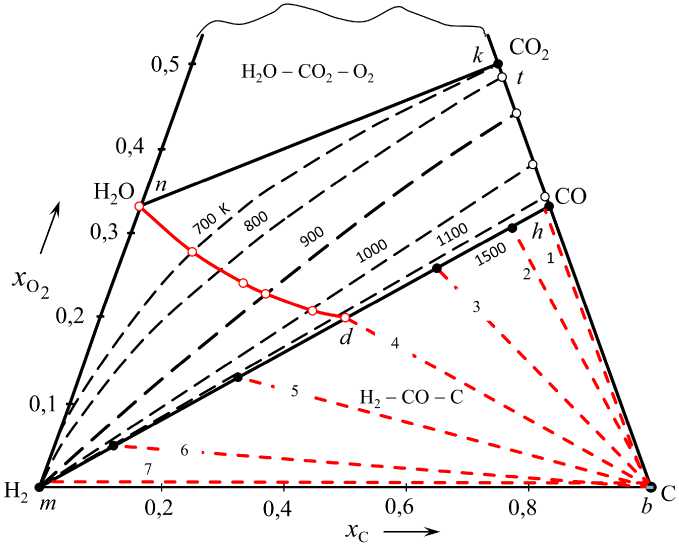
Рис. 2. Изотермы параметров водяного газа, равновесного с углеродом: изотермы 700–1500 К определяют нижние границы области II; линии 1–7 определяют кислородный потенциал водяного газа, равновесного с углеродом при 1500 К, lg( pO^, атм) = -17,14 (1), –17,22 (2), –17,49 (3), –17,71 (4), –18,17 (5), –19,12 (6) и – ∞ (7), табл. 3; линия nd – параметры водяного газа, получающегося при нагревании паров воды в контакте с избытком углерода, табл. 8
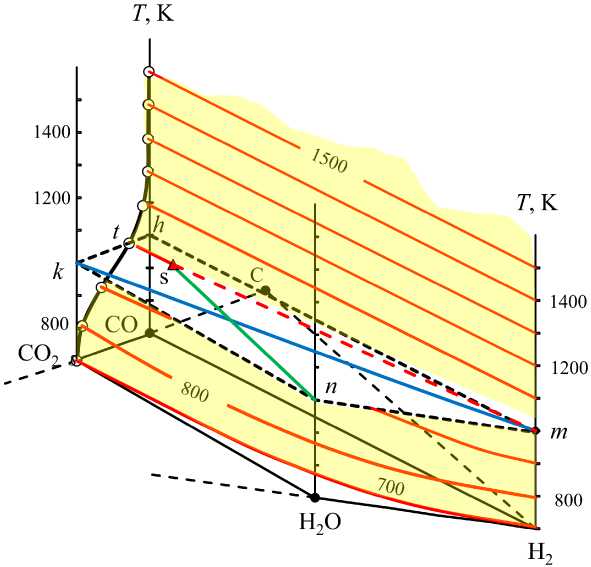
Рис. 3. Поверхность параметров системы (Н 2 – Н 2 О – СО – СО 2 – С): tmnkt – область возможных cоставов водяного газа в отсутствии углерода при 1000 К, линия km – cоставы водяного газа, получающегося из (Н 2 – СО 2 ), линия ns – cоставы водяного газа, получающегося из (Н 2 О – СО)
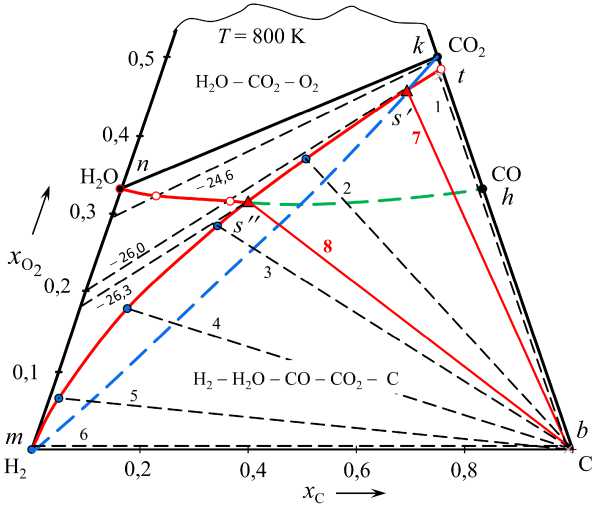
Рис. 4. Примеры возможных параметров водяного газа при 800 К: линия ks ′ – газ получается нагреванием исходных смесей (Н 2 – СО 2 ) состава a o / d o = 0,14 / 0,86 (точка s ′ ), 1/9, СО 2 ; линия ns ′′ – газ получается нагреванием исходных смесей (СО – Н 2 О), c o / b o = 0 , 353 / 0,647 (точка s ′′ ), 3/7, 1/9, Н 2 О; коноды 1–6 определяют кислородный потенциал водяного газа, равновесного с углеродом, lg( p O , атм) = –25,85 (1), –26,04 (2), –26,89 (3), –27,25 (4), –27,85 (5) и – ∞ (6); конода 7 определяет кислородный потенциал водяного газа, получающегося из смеси (Н 2 – СО 2 ) и равновесного с углеродом, lg( p O , атм) = –25,92 ; конода 8 определяет кислородный потенциал водяного газа, получающегося из смеси (Н 2 О – СО) и равновесного с углеродом, lg( p O , атм) = –26,33
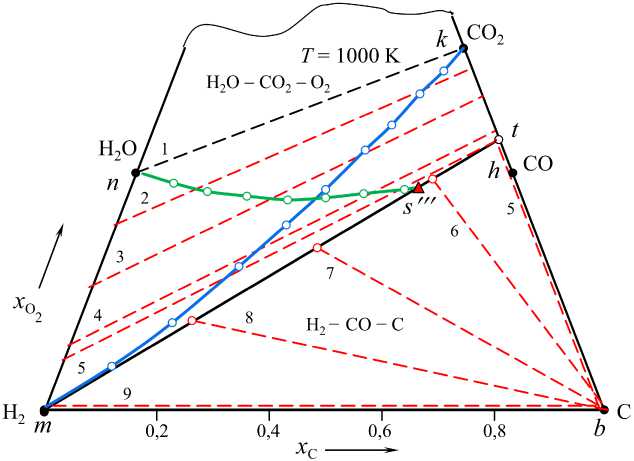
Рис. 5. Параметры водяного газа при 1000 К: линия mt – граница областей II и III определяет возможные параметры систем «H 2 – H 2 O – CO – CO 2 – C»; линии 1–5 определяют возможные составы и кислородный потенциал газа, lg( p O , атм) = –6,7 (1), –19 (2), –20 (3), –21 (4) и –21,24 (5); линии 6–9 определяют кислородный потенциал водяного газа, равновесного с углеродом –21,41 (6), –21,76 (7), –22,369 (8) и – ∞ (9); линия mk – газ получается нагреванием исходных смесей (Н 2 – СО 2 ); линии ns ′′′ t – газ получается нагреванием смесей (Н 2 О – СО)
Возможно множество способов получения водяного газа нагреванием какой-либо исходной системы. Каждый из них позволяет получить газ строго определенного состава, но нет единого способа, позволяющего получить водяной газ любого равновесного состава. Проиллюстрируем это несколькими примерами.
Пример 1 – получение водяного газа нагреванием до 800 и 1000 К смесей H 2 – CO 2 разного состава. Стандартная процедура расчета состоит в следующем:
|
Н 2 |
+ СО 2 |
= Н 2 О |
+ СО |
|
|
Исходный состав |
a o |
d o |
– |
– |
|
Равновесный состав |
( a o – x ) ( d o – x ) |
x |
x |
|
Здесь ao и do – числа молей Н2 и СО2 в исходной смеси, x – количества продуктов. При расчетах положим (ao + do) = 1 моль, тогда величины a = (ao – x), d = (do – x), b = x и c = x будут определять и количества и молярные доли компонентов равновесного водяного газа. Получаем для равновесия реакции (1)
K 1 =
.
( a o - x )( d o - x )
Решение этого квадратного уравнения (при K i ^ 1) таково:
x CO = x Н 2 О
0,5 • K i ± K i • a o • d o + 0,5 • K i f 1 - K i N 1 — K i I 1 — K i J
x h2 = ( a o - x );
x CO 2 = ( d o - x ).
Физический смысл имеет один из двух корней решения квадратного уравнения, причем для Ki < 1 перед квадратным корнем следует ставить знак «+», а для Ki > 1 - знак «-». При K1 = 1 (1093 К) из уравнения (8) получаем x = aoldo. (9*) ao + do
Результаты расчетов, табл. 4 и 5, линии mk на рис. 4 и 5 следует скорректировать из-за протекания реакции диссоциации
2CO = CO 2 + C.
В водяном газе, получающемся при нагревании до 800 К смесей состава a o / d o ≤ 0,14 / 0,86 (выделено жирным курсивом в табл. 4), реализуются состояния, определяемые фрагментом ks ′ линии mk на рис. 4. При нагревании смесей с a o / d o > 0,14 / 0,86 происходит выделение сажистого углерода и реализуются состояния, определяемые линией s ′ m (табл. 1). При нагревании до 1000 К смесей Н 2 – СО 2 любого состава выделение сажистого углерода не происходит, линия mk на рис. 5.
Таблица 4
Возможные ( курсив ) параметры равновесия водяного газа, получающегося при нагревании смесей (Н 2 , a o моль + СО 2 , d o моль) до 800 К
|
a o d o |
0,8 0,2 |
0,6 0,4 |
0,4 0,6 |
0,2 0,8 |
0,14/0,86 |
0,1/0,9 |
|
x СО = x H 2 O |
0,1153 |
0,1570 |
0,1570 |
0,1153 |
0,0920 |
0,0724 |
|
x H 2 |
0,6848 |
0,4430 |
0,2430 |
0,0848 |
0,0482 |
0,0276 |
|
x CO2 |
0,0848 |
0,2430 |
0,4430 |
0,6848 |
0,7678 |
0,8276 |
|
lg( p O 2 , атм) |
Состояния не реализуются |
–25,92 |
–25,64 |
|||
Таблица 5
Параметры равновесия водяного газа, получающегося при нагревании смесей (Н 2 , a o моль + СО 2 , d o моль) до1000 К
|
a o d o |
0,9 0,1 |
0,8 0,2 |
0,6 0,4 |
0,4 0,6 |
0,2 0,8 |
0,1 0,9 |
|
x СО = x H 2 O |
0,0866 |
0,1498 |
0,2183 |
0,2183 |
0,1498 |
0,0866 |
|
x H2 |
0,8134 |
0,6502 |
0,3817 |
0,1817 |
0,0502 |
0,0134 |
|
x CO2 |
0,0134 |
0,0502 |
0,1817 |
0,3817 |
0,6502 |
0,8134 |
|
lg( p O 2 , атм) |
–22,00 |
–21,33 |
–20,54 |
–19,89 |
–19,10 |
–18,44 |
Таблица 6
Возможные (курсив) параметры равновесия водяного газа, получающегося при нагревании смесей (Н2О, bo моль - СО, co моль) до 800 К
|
с o b o |
0,8 0,2 |
0,6 0,4 |
0,4 0,6 |
0,353/0,647 |
0,3/0,7 |
0,2/0,8 |
0,1/0,9 |
|
x H 2 = x CO 2 |
0,1870 |
0,3179 |
0,3179 |
0,2959 |
0,2636 |
0,1870 |
0,0973 |
|
x СО |
0,6130 |
0,2820 |
0,0820 |
0,0571 |
0,0364 |
0,0131 |
0,0027 |
|
x H2O |
0,0130 |
0,0820 |
0,2820 |
0,3511 |
0,4364 |
0,6130 |
0,8027 |
|
x H2 / x H2O |
14,328 |
3,8760 |
1,127 |
0,8428 |
0,604 |
0,35 |
0,1212 |
|
x СО / x CO 2 |
3,279 |
0,887 |
0,258 |
0,1930 |
0,1382 |
0,0698 |
0,0277 |
|
lg( p O 2 , атм) |
Состояния не реализуются |
–26,33 |
–26,04 |
–25,45 |
–24,65 |
||
Таблица 7
Параметры водяного газа, образующегося при нагревании до 1000 К смесей (Н2О, bo - СО, co моль)
|
с o b o |
0,9 0,1 |
0,777/0,223 |
0,7/0,3 |
0,5/0,5 |
0,3/0,7 |
0,1/0,9 |
|
x H2 = x CO2 |
0,0866 |
0,1837 |
0,1931 |
0,2267 |
0,1931 |
0,0866 |
|
x СО |
0,8134 |
0,5933 |
0,5069 |
0,2733 |
0,1069 |
0,0134 |
|
x H2O |
0,0134 |
0,0393 |
0,1069 |
0,2733 |
0,5069 |
0,8134 |
Пример 2 – получение водяного газа нагреванием смесей H 2 O – CO разного состава. Рассчитывается равновесие реакции
Н 2 О + СО = Н 2 + СО 2 (1*) с константой К ; = 1/ К 1 по уравнениям, аналогичным уравнениям (9):
x CO2 = х н2
0,5 • К
1 - К
K ' b +( " K 1 ;
1 - к ; ( 1 - к ; )
-
x H2O = b o x H2 ;
-
Х СО = co x CO2 .
Результаты расчетов по этим уравнениям, табл. 6 и 7, линии nh на рис. 4 и 5 тоже следует скорректировать из-за протекания реакции диссоциации
-
2CO = CO 2 + C.
В газе, получающемся при 800 К из смесей состава c o/ b o < 0,353/0,647 (выделено жирным курсивом в табл. 6), реализуются состояния, определяемые фрагментом ns ′′ линии nh на рис. 4. Состояния s ′′ h в равновесии не возможны – выделяется сажистый углерод и реализуются состояния, определяемые линией s ′′ t . При нагревании до 1000 К смесей Н 2 О – CО состава c o/ b o < 0,777/0,223 , табл. 7, реализуются состояния, определяемые линией ns ′′′ , рис. 5.
Пример 3 – получение водяного газа нагреванием паров воды в контакте с углеродом. Этот способ представляет наибольший практический интерес из-за простоты и незначительных затрат.
Образование водяного газа при нагревании паров воды в контакте с углеродом является следствием протекания трех реакций: в результате реакции (3) образуются H 2 и CO, диоксид CO 2 образуется по реакциям
CO + H 2 O = CO 2 + H 2 ;
-
2CO = CO 2 + C.
Углерод расходуется по реакции (3) и образуется сажистый углерод при диссоциации CO, реакция (2*) . Можно определить вклад каждой из реакций (3) и (2*) в расход и обра-
|
зование углерода системы: |
при нагревании |
исходной |
||
|
Исходное состояние Равновесие Равновесие |
C |
+ |
CO 2 – d s |
= 2CO; – c ( y – 2 s ) |
|
Исходное состояние Равновесие Равновесие |
C |
+ H 2 O b о b ( b о – y ) |
= CO – c ( y – 2 s ) |
+ H 2 – a y |
Здесь в первой строке после уравнений реакций показано количество паров воды в исходном состоянии b о моль. Во второй строке –
x H 2
a
S ; x H2O =
b
S ; x co =
c
S ; x CO 2
d
.
S
количества газов в системе после изотермической выдержки паров воды в контакте с углеродом. В третьей строке – то же самое с учетом вклада каждой из реакций газификации в образовании равновесной газовой фазы:
y – количество углерода (моль), вступившего в реакцию (3), s – количество углерода (моль), образовавшегося по реакции (2*).
Тогда константы равновесия реакций и
После замены в этих уравнениях a , b , c , d и ∑ на величины y , ( b о – y ), ( y – 2 s ), s и ( b о + y – s ) получаем и такие расчетные формулы:
5 = 2
—
y 2
4 K ;
- (b o (b o — У) + 2 У K 2
условие нормировки представляются такими
уравнениями:
K 3 =
Г c 2 )
d-SJ
S = a + b + c + d.
Решение этой системы трех уравнений с четырьмя неизвестными с учетом баланса по водороду и кислороду:
b o = a + b , b o = b + c + 2 d
представляется уравнениями:
a2 , , , a - c c=—K----------; b = bo—a; d=-^;
2 3 ( b o — a ) + a
K 2
a = у ; b = b o — у ; d = 5 ; c = у — 2 5 ;
S = a + b + c + d = bo + у — 5.
Из результатов расчетов (табл. 8) следует:
– при нагревании паров воды в контакте с избытком углерода получается водяной газ строго определенного состава в зависимости от температуры;
– получается газовая смесь, состав которой определяется точками пересечения линии nd c изотермами, рис. 2 и 6;
– при нагревании до температур выше примерно 1200 К получается практически чистая эквимолярная смесь CO – Н 2 (точка d , рис. 2) с высоким восстановительным потенциалом.
Из приведенных примеров следует, что нет единого способа получения водяного газа всех возможных составов, которые определяются бесконечным множеством точек в области II концентрационного треугольника,
Таблица 8
Параметры равновесия систем «Н 2 – Н 2 О – СО – СО 2 – С», получающихся при нагревании исходной системы «Н 2 О (1моль) – С», давление 1 атм, линия nd на рис. 2
|
T , К |
700 |
850 |
900 |
1000 |
1100 |
1300 |
1500 |
|
y = n C (15) |
0,3059 |
0,6265 |
0,7265 |
0,8860 |
0,9640 |
0,9960 |
0,9993 |
|
s = n C (2) |
0,1495 |
0,2476 |
0,2328 |
0,1207 |
0,0327 |
0,0021 |
0,00023 |
|
∑ n C = y – s |
0,1564 |
0,3789 |
0,4937 |
0,7653 |
0,9313 |
0,9939 |
0,9990 |
|
a , моль |
0,3059 |
0,6265 |
0,7265 |
0,8860 |
0,9640 |
0,9960 |
0,9993 |
|
b , моль |
0,6941 |
0,3735 |
0,2735 |
0,1140 |
0,0360 |
0,0040 |
0,0007 |
|
c , моль |
0,0069 |
0,1313 |
0,2608 |
0,6447 |
0,8986 |
0,9918 |
0,9988 |
|
d , моль |
0,1495 |
0,2476 |
0,2328 |
0,1207 |
0,0327 |
0,0021 |
0,00023 |
|
∑, моль |
1,1564 |
1,1389 |
1,4937 |
1,7653 |
1,9313 |
1,9939 |
1,9991 |
|
V , л |
66,38 |
96,11 |
110,23 |
144,8 |
174,2 |
212,6 |
245,9 |
|
x H 2 |
0,2645 |
0,4543 |
0,4864 |
0,5019 |
0,4991 |
0,4994 |
0,4999 |
|
x H2O |
0,6003 |
0,2709 |
0,1831 |
0,0646 |
0,0186 |
0,0021 |
0,0004 |
|
x CO |
0,0059 |
0,0953 |
0,1746 |
0,3652 |
0,4653 |
0,4974 |
0,4996 |
|
x CO2 |
0,1293 |
0,1795 |
0,1559 |
0,0683 |
0,0170 |
0,0011 |
0,0001 |
|
x H2O / x H2 |
2,2696 |
0,5963 |
0,3764 |
0,1287 |
0,0373 |
0,0042 |
0,0008 |
|
lg( x H 2 O / x H 2 ) |
0,356 |
–0,225 |
–0,424 |
–0,890 |
–1,429 |
–2,376 |
~ –3,1 |
|
x CO2 / x CO |
21,92 |
1,8835 |
0,8929 |
0,1870 |
0,0365 |
0,0022 |
0,0002 |
|
lg( x CO 2 / x CO) |
1,341 |
0,275 |
–0,049 |
–0,728 |
–1,437 |
–2,655 |
~ –3,7 |
|
(lg p O 2 ) |
–30,36 |
–25,04 |
–23,76 |
–21,84 |
–20,57 |
–18,89 |
–17,68 |
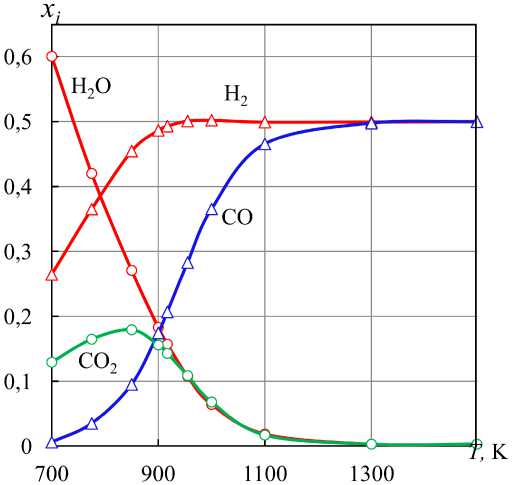
Рис. 6. Концентрации компонентов водяного газа, получающегося при нагревании паров воды в контакте с углеродом
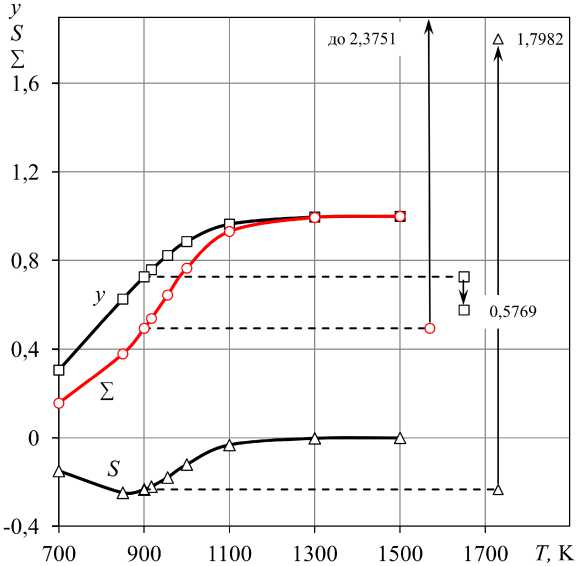
Рис. 7. Количества газифицированного углерода при нагревании исходной системы «Н 2 О (1 моль) – С»: y и ∑ n C – газификация углерода, s – сажистый углерод; стрелки – сравнение количеств газифицированного углерода при 900 К систем «Н 2 О (1) – С» и «Н 2 О (1) – СО 2 (9 моль) – С», табл. 2.26
рис. 1. Нагреванием, например, до 800 К смесей (H 2 – CO 2 ) и (H 2 O – CO) можно получить смеси, составы которых определяются линиями ks ′ и ns ′′ , рис. 4 и 5. Если нагревать до 800 К смеси [(H 2 –CO 2 )– H 2 O] и [(H 2 O–CO)–CO 2 ]
разного состава, то можно получить водяной газ любого состава в области mnkt, рис. 2. При нагревании до 800 К паров воды в контакте с углеродом получается водяной газ, состав которого определяется точкой пересечения линии nd с изотермой 800 К. Если же нагревать до 800 К смеси (H2 – H2O) разного состава в контакте с углеродом, то получается водяной газ с составом, определяемым любой точкой на линии ms′′.
Зависимости расходов углерода y , s по реакциям газификации (3), (2) и общего количества газифицированного углерода ∑ n C = y + s при нагревании Н 2 О – C представлены в табл. 7 и на рис. 7. Углерод газифицируется только по реакции (3) и с повышением температуры интенсивность газификации углерода парами воды повышается. При температурах выше ~ 1100 К имеет место 100 % расход паров на газификацию. Образующийся при газификации оксид СО диссоциирует с образованием сажистого углерода, s < 0. При этом наблюдается хорошо известное повышение термодинамической стабильности СО при температурах выше 1100 К. Расчетами показано, что добавление в систему Н 2 О – C диоксида углерода кардинально влияет на состав получающегося водяного газа и на газификацию углерода. Например, в табл. 9 приведены результаты расчетов равновесных параметров систем
«Н 2 – Н 2 О – СО – СО 2 – С», получающихся при 900 К в «Н2O (1 моль) – СО 2 ( d о ) – С» (варьировалось количество СO 2 при неизменном количестве Н2О). На рис. 7 стрелками показано сравнение количеств газифицированного углерода при 900 К и 1 атм в системе «Н 2 О (1моль) – С» и «Н 2 О (1моль) – СО 2 (9 моль) – С»:
-
- при b o / d o ^ да ( d o ^ 0) y ^ 0,7265, s ^ 0,2328, £ n C ^ 0,4937 моль;
-
- при b o/ d o ^ 0,1111 ( d o ^ 9) y ^ 0,5769, s ^ -1,7982, £ n C ^ 2,3751 моль.
При соотношении в исходной системе d о / b о ≥ ≥ 0,845 / 1 диссоциация CO с образованием сажистого углерода не происходит, углерод начинает газифицироваться диоксидом CO 2 , а при d о / b о ≥ 3,448 / 1 количество углерода, газифицированного диоксидом CO2, становится больше, чем парами воды.
В научной литературе принято количественно оценивать окислительные и восстановительные свойства газовой фазы кислородным потенциалом n o = RT In p о либо вели-
чиной lg( p O , атм) [3, 4, 14, 15]. Расчетная
формула для lg( p O , атм) получается из анализа равновесия реакций диссоциации H 2 О или СО 2 :
2H O =2H + O ,
2 2 2 (11)
A G y (11) = 492 230 - 108,24 ■ T ;
2CO =2CO + O ,
2 2 (12)
Ar G y (12) = 565 390 - 175,17 ■ T ;
lg[ P о2 ,атм] = 2 ■ lg
^H V H2 7
+ lg K p (11) =
= 2 ■ lg
. H 2 O xH
V H2 7
25708 T
+ 5,653;
Таблица 9
Параметры равновесия систем «Н 2 – Н 2 О – СО – СО 2 – С», получающихся при нагревании до 900 К исходных систем «Н 2 O ( b o ) – СО 2 ( d o ) – С», 1 атм
|
b о |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
d о |
0 |
0,5 |
0,845 |
1 |
2 |
3 |
~ 3,448 |
9 |
9 |
|
y = n C (15) |
0,7265 |
0,6635 |
0,6427 |
0,6360 |
0,6108 |
0,5990 |
~ 0,595 |
0,5769 |
– |
|
s = n C (2*) |
0,2328 |
0,0875 |
0 |
–0,0368 |
–0,2678 |
–0,4907 |
~ –0,595 |
–1,7982* |
1,9436* |
|
∑ n C = y – s |
0,4937 |
0,5760 |
0,6427 |
0,6728 |
0,8786 |
1,0897 |
1,190 |
2,3751* |
1,9436* |
|
a , моль |
0,7265 |
0,66346 |
0,6427 |
0,63598 |
0,6108 |
0,5990 |
~ 0,595 |
0,5789 |
– |
|
b , моль |
0,2735 |
0,33654 |
0,3573 |
0,36402 |
0,3892 |
0,4010 |
~ 0,405 |
0,4211 |
– |
|
c , моль |
0,2608 |
0,4884 |
0,6414 |
0,7096 |
1,1463 |
1,5804 |
~ 1,785 |
4,1754 |
3,8872 |
|
d , моль |
0,2328 |
0,5875 |
0,8456 |
0,9632 |
1,7322 |
2,5093 |
~ 2,853 |
7,2018 |
7,0564 |
|
∑, моль |
1,4936 |
2,0759 |
2,4870 |
2,6728 |
3,8786 |
5,0897 |
~ 5,638 |
12,3772 |
10,9436 |
|
V , л |
110,2 |
153,2 |
183,54 |
197,3 |
286,2 |
375,6 |
416,1 |
913,4 |
807,6 |
|
x H 2 |
0,4864 |
0,3196 |
0,2584 |
0,2379 |
0,1575 |
0,1177 |
0,1055 |
0,0468 |
– |
|
x H2O |
0,1831 |
0,1621 |
0,1437 |
0,1362 |
0,1003 |
0,0788 |
0,0718 |
0,0340 |
– |
|
x CO |
0,1746 |
0,2352 |
0,2579 |
0,2655 |
0,2956 |
0,3105 |
0,3166 |
0,3373 |
0,3552 |
|
x CO2 |
0,1559 |
0,2830 |
0,3400 |
0,3604 |
0,4466 |
0,4930 |
0,5061 |
0,5819 |
0,6448 |
|
(lg p O 2 ) |
–23,76 |
–23,50 |
–23,42 |
–23,40 |
–23,30 |
–23,26 |
–23,25 |
–23,19 |
–23,14 |
x
CO 2
lg[ P o2 , атм] = 2 • lg
+ lg Kp (12) = к XCO
Для любой сколь угодно сложной газовой смеси, в которой присутствуют СО 2 и Н 2 О, в том числе и для водяного газа, кислородный
lg (XC02 ^ XCo)
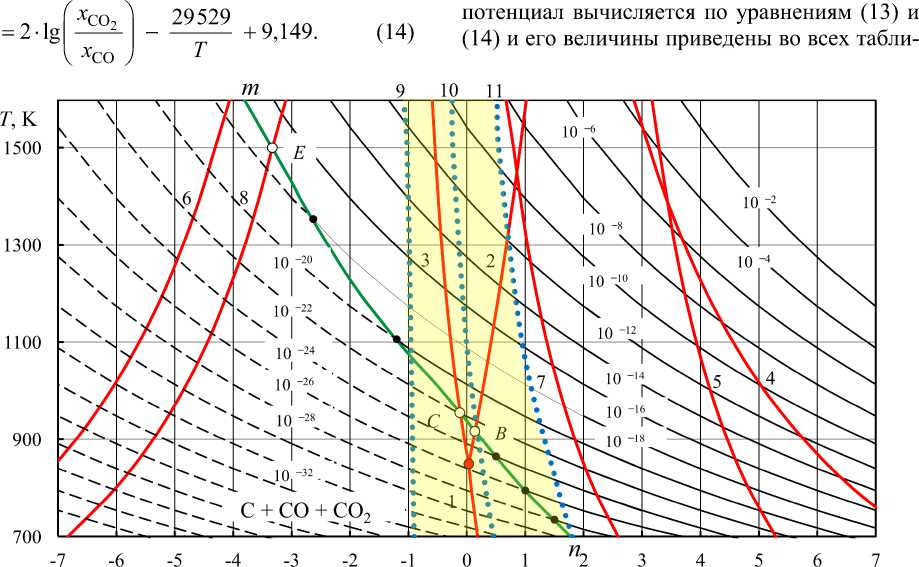
Рис. 8. Номограмма « lg
^CO"
V xCO J
– p O – T » для газовых смесей, содержащих СО 2 и СО, 1 атм
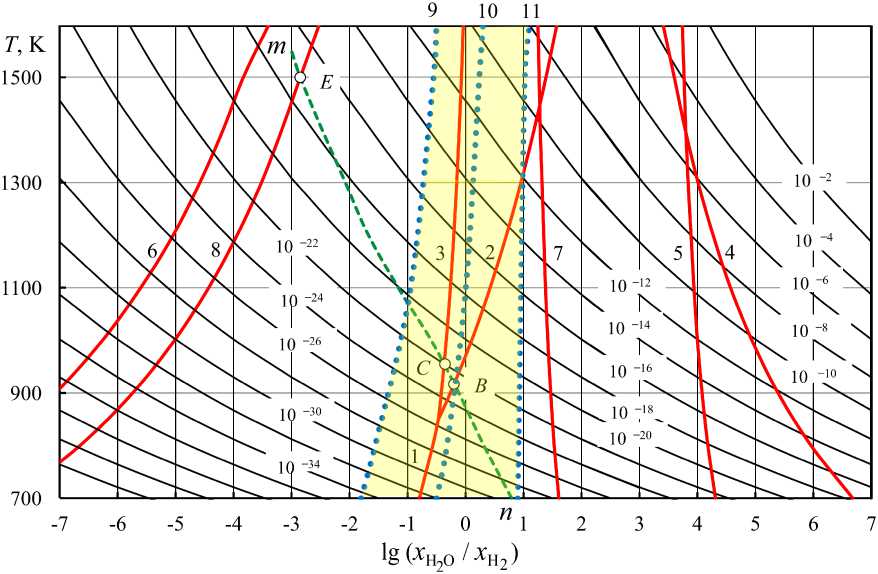
Рис. 9. Номограмма « lg
– pO – T» для газовых смесей, содержащих Н2О и Н2, 1 атм x H2O
xH V H2
цах настоящей публикации, а на рис. 5 для примера представлена графическая информация о кислородном потенциале на концентрационном треугольнике H2 – O2 – C для 1000 К. Соотношение положения крайних точек изобар кислорода 1–5 в области II определяется константой равновесия реакции водяного газа:
K 1 = 'CO x . , x c. = K 1 , x H (15) x H 2 x H 2 O x CO 2 x H 2 O
Результаты расчетов lg( p O2 ) по уравнениям (13) и (14) могут быть представлены и номограммами, предложенными более полувека назад [16] и незаслуженно забытыми (рис. 8 и 9). Линия nm на этих рис. 8, 9 определяет условия диссоциации CO с образованием сажистого углерода или параметры равновесия водяного газа с присутствующим в качестве самостоятельной фазы углеродом. Номограммы позволяют определять параметры газовых смесей (Н 2 О – Н 2 ), (СО 2 – СО) и (Н 2 – Н 2 О – СО – СО 2 ), при которых возможно восстановление оксида металла. Для примера на рис. 8 и 9 линиями 1–8 показаны параметры восстановления Fe 3 O 4 до Fe и до FeO, FeO до Fe, Cu 2 O до Cu, Mn 3 O 4 до MnO, MnO до Mn, CoO до Co и Cr 2 O 3 до Cr. Положения этих линий определяются расчетом констант равновесия соответствующих реакций восстановления либо по упругостям диссоциации оксидов [17].
Список литературы Термодинамический анализ системы H2 - O2 - C
- Есин, О.А. Физическая химия пирометаллургических процессов / О.А. Есин, П.В. Гельд. - Изд. 2-е. - М.: Металлургиздат, 1962. - Ч. 1.
- Гольдштейн, Н.Л. Водород в доменном процессе / Н.Л. Гольдштейн. - М.: Металлургия, 1971. - 208 с.
- Попель, С.И. Теория металлургических процессов: учеб. пособие для вузов / С.И. Попель, А.И. Сотников, В.Н. Бороненков. - М.: Металлургия, 1986. - 463 с.
- Теория металлургических процессов: учебник / Д.И. Рыжонков, П.П. Арсентьев, В.В. Яковлев и др. - М.: Металлургия, 1989. - 392 с.
- Дигонский, С.В. Роль водорода в восстановлении оксидов металлов твердым углеродом / С.В. Дигонский, В.В. Тен // Альтернативная энергетика и экология. - 2009. - № 11 (79). - С. 45-55.
- Дигонский, С.В. Карботермическое восстановление оксидного сырья в неравновесных химических системах / С.В. Дигонский // Технология металлов. - 2008. - № 8. - С. 3-7.
- Патент RU 2111271 С1. Способ получения металлов из их сульфидов / С.В. Дигонский, Н.А. Дубинин, Е.Д. Кравцов. - Заявл. 22.10.96; опубл. 20.05.98.
- Патент RU 2033431 С1. Способ получения металлов / В.В. Дигонский, С.В. Дигонский, В.Е. Горбовский. - Заявл. 02.04.91; опубл. 20.04.95.
- Строкина, И.В. Изменения окислительно-восстановительных свойств газовой фазы системы C - O2 - H2 / И.В. Строкина, Н.Ф. Якушевич // Изв. вузов. Черная металлургия. - 2011. - № 6. - С. 3-5.
- Якушевич, Н.Ф. Определение параметров окислительно-восстановительных процессов в системе Fe - C - O2 - H2 / Н.Ф. Якушевич, И.В. Строкина, О.А. Полях // Изв. вузов. Черная металлургия. - 2011. - № 8. - С. 13-18.
- Гришин, А.М. О несоответствии кинетических закономерностей термодинамическим предпосылкам реакций газификации углерода H2O и CO2. / А.М. Гришин, В.К. Симонов, И.С. Щеглова // Изв. вузов. Черная металлургия. - 2013. - № 7. - С. 64-67.
- Дубинин, А.М. Оптимальные параметры паровой газификации углей в газогенераторе с заторможенным циркуляционным псевдоожиженным слоем / А.М. Дубинин, С.П. Маврин // Изв. вузов. Черная металлургия. - 2016. - Т. 59, № 11. - С. 773-780.
- Перспективы использования политопливного газогенератора в практике работы доменных цехов / Г.С. Подгородецкий, А.А. Третяк, В.Б. Горбунов, Л.А. Полулях // Изв. вузов. Черная металлургия. - 2016. - Т. 59, № 12. - С. 879-885.
- Термодинамика восстановления железа из оксидов / Г.П. Вяткин, Ю.С. Кузнецов, Г.Г. Михайлов, О.И. Качурина. - Челябинск: Издат. центр ЮУрГУ, 2017. - 346 с.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М.: Издат. Дом МИСиС, 2009. - 520 с.
- Muan, A. Phase eqilibria among oxides in steelmaking / A. Muan, E.F. Osborn. - New York: Pergamon Press Limited, 1965.
- Казачков, Е.А. Расчеты по теории металлургических процессов / Е.А. Казачков. - М.: Металлургия, 1988. - 288 с.


