Термодинамический анализ системы хром-никель-азот
Автор: Леонович Б.И., Гусинская К.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 13 (189), 2010 года.
Бесплатный доступ
С использованием подрешеточной модели проведен термодинамический анализ трехкомпонентной системы хром-никель-азот. Результаты расчета равновесных состояний системы представлены в виде изотермических сечений и фазовых диаграмм. Рассчитаны и построены политермические разрезы фазовых диаграмм с постоянным значением концентрации хрома и активности азота в сплаве.
Термодинамическая модель, фазовая диаграмма, система хром -никель - азот
Короткий адрес: https://sciup.org/147156640
IDR: 147156640 | УДК: 541.123
Текст научной статьи Термодинамический анализ системы хром-никель-азот
Никельхромовые сплавы являются основой жаростойких и жаропрочных сплавов. Специфические свойства этих сплавов в значительной степени определяются содержанием в них азота. Повышенное содержание азота в расплаве в процессе охлаждения и кристаллизации металла приводит к образованию нитридных и карбонитридных включений, которые могут оказывать значительное влияние на размер зерна, снижать окалиностой-кость, пластичность и живучесть сплавов, а в случае неблагоприятной формы и расположения могут служить причиной хрупкого разрушения металла. Поэтому экспериментальное и теоретическое исследование образования равновесных фаз в этих сплавах, и в частности определение взаимной растворимости компонентов в этих сплавах, имеет первостепенное значение.
При термодинамическом описании металлических сплавов, содержащих азот, использована модель регулярного раствора Хиллерта-Стеффан-сона [1], которая может быть применима к системам Мх-М1-^, содержащим два растворителя Мх и М2 с образованием раствора замещения и одно вещество N, образующее растворы внедрения. Таким образом, вакансии V в подрешетке внедрения рассматриваются как дополнительный компонент системы.
При термодинамическом анализе фазовых равновесий в трехкомпонентной системе Cr-Ni-N необходимо знать свойства веществ, образующихся в двухкомпонентных системах хром-никель, хром-азот и никель-азот. Диаграмма состояния двухкомпонентной системы хром-никель приведена в исследовании [2] (рис. 1, а). Данная система характеризуется наличием в твердом состоянии двухфазной области у + а. В сплавах системы Me-N возможно образование твердых растворов и фаз внедрения е гексагональной структуры на основе химического соединения Me2N (рис. 1, б, в). Система хром-азот характеризуется образованием нестехиометрического нитрида хрома структуры г.ц.к. [2, 3].
Система хром-никель-азот была предметом многочисленных экспериментальных и теоретических исследований [2-4]. Установлено, что в этой системе образуются трехкомпонентный жидкий раствор и тройные твердые растворы внедрения структуры о.ц.к. (а), г.ц.к. (у) и г.п.у. (s). Взаимодействие компонентов растворов приводит к образованию нитрида хрома нестехиометрического состава (Cr, Ni)N.
Жидкий расплав. Молярная энергия Гиббса гомогенного трехкомпонентного сплава задается уравнением
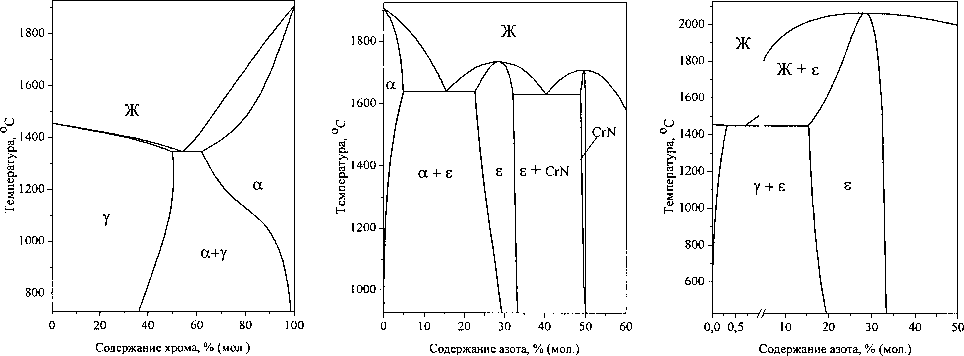
Рис. 1. Диаграммы состояния двухкомпонентных систем Cr-Ni (a), Cr-N (б) и Ni-N (в)
Gm " хСг^Сг + xN^N + xNi^Ni + ^ПхСг lnxCr +
+xN hl XN + XNi In XNi) + XCrXNi 4cr,Ni + хСгхнДзг,Н + +xNxNiZN?Ni +*сгхнХм(хсг^да +xNZ^rjNNi + xNi^Cr,N,Ni)’ (1)
где X, - молярные доли компонентов раствора; Gf - энергия Гиббса чистого компонента; R - универсальная газовая постоянная; Т - абсолютная температура; Ту - температурно-зависимые параметры модели, значения которых выражали полиномами Редлиха-Кистера
Ту^Е^-ХуТ . (2)
и=0
Парциальные молярные энергии Гиббса (химические потенциалы) могут быть вычислены по уравнению [5]:
з
Ц,=Ст + £(бУ
>2
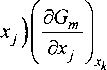
где Ьу - символ Кронекера ( Ьу = 0 при г * j и 5у=1 при г = /).
Твердые растворы внедрения (а, у, s) и CrN. В таких растворах металлические вещества (никель и хром) образуют подрешетку замещения, а азот и вакансии V - подрешетку внедрения. Тогда такой твердый раствор внедрения можно представить общей формулой (Cr,Ni)a(N, Р)с. Образование такого раствора можно представить смешением гипотетических соединений JaNc, AaVc, В^с и BaVc, а молярную энергию Гиббса такого «четырехкомпонентного» раствора - уравнением
Gm = УСтУу^гУ + УСгУм^СгН + ЖТг^№Г +
+У№Ун^№к + ^Wcr In УСг + Ум In УМ) + +c(yN lnyN + Уу ln>) + G®6,(4)
где
Gm = УСгУм (Ун^Сг,№:Н + Уг^Сг,№:К ) +
+Уг Ум (УСг^СгМУ + Ум^М:ИУ )•
Параметры L вычисляются по формуле (2), а состав твердого раствора определяется мольными долями веществ в каждой подрешетке:
Усг = W(1 -^n) И №+Усг= 1;(6)
№ = (a/c>N/(l -xN) и № +ук= 1,(7)
где а и с числа межузельных промежутков в металлической подрешетке. Их значения приведены в таблице.
В уравнении (4) в подстрочных индексах запятая разделяет компоненты в одной подрешетке, а двоеточие означает различие подрешеток.
Парциальные молярные энергии Гиббса гипо тетических компонентов твердого раствора определяются по формуле [7, 8]:
с -с 1 ^Gm । v ^Gm
^Ут ^У) ^=Cr,Ni,N,K ^Ук где i и / - элементы замещения и внедрения соответственно. Парциальные величины реальных компонентов определяются следующим образом:
Gi = Giy » ^N = Gi:M ” Giy • л-фаза. В трехкомпонентной системе хром-никель-азот при температурах менее 1200 °C возможно образование химического соединения стехиометрического состава Cr12j8Ni7j2N4. Молярная энергия Гиббса образования этого химического соединения может быть представлена формулой
Gm = Ум^СгМгК + ^’ 2ЛТ(уСг In уСг + JNi Ь yNj) .
Термохимические данные и температурнозависимые параметры модели, необходимые для расчета, получены при оптимизации экспериментальных данных и приведены в таблице [2, 3].
Графические зависимости результатов расчета по полученным соотношениям представлены на
Параметры модели при расчете системы хром-никель-азот*, Дж/моль
|
Фаза |
Параметр |
Примечание |
|
Жидкая фаза (Ж) |
С^ж) = G^ +16 414,686 -9,39ПТ— 3,82318-10"2177 |
Т< 1455 |
|
С^ж) =Я^98-9549,775 +268,5987-43,1 Лп7 |
Г> 1455 |
|
|
L^ = -1276-5,38737 |
||
|
|
||
|
=14 981 |
||
|
го(ж) --йОДОО bCr,Ni,N |
||
|
Раствор -о.ц.к. (а) (а=1; с=3) |
с^оцк) = G^ + 8715,084-3,5567 |
|
|
G^K) = G^ +3/20^ +200 000+2007 |
||
|
L*^)y =21 310-13,65827 |
||
|
Z^k = 25 800-7,89277 |
||
|
Раствор -г.ц.к. (у), включая CrN ^а=\; с=1) |
G^ruK) =17^98-5179,159+ 117,8547-22,09671n7-0,004840772 |
К 1455 |
|
G“'rllK) = 7/298- 27 098,655 + 279,1357--43,171n7 + 1,12753995-10317-9 |
Т> 1455 |
|
|
G^K> = G^ + 1/20^ + 38 680 + 143,097--10,971n7 + 0,0043872 |
||
|
7^, =8347- 12,10387 |
||
|
=29 895-16,38387 |
||
|
£сда+ =-661 270 + 3057 |
||
|
Раствор -г.п.у. (е) (а=1; с=0,5) |
G^ = G^^ + 1046 + 1,2557 |
|
|
G*^) = G^K) + 1/4G^™^ - 4409 + 72,937- 7,3671n7 + 0,0061472 |
||
|
<",&<-1443 |
||
|
Фазал |
G“^rN = 12,8С^ГОЦК) +7,2G°(™K) +2G^- 651 800 + 3167 |
|
|
Газ |
^ге^ = Я2°98 - 7358,85 + 17,20037- 16,369971n7--6,5Ю7-10^72-3,ОО971О"873 + 563 0707-1 |
* Термохимические данные для системы хром - азот приведены в работе [б].
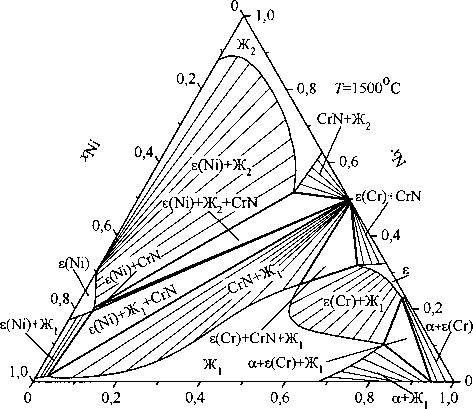
рис. 2 в виде изотермических сечений в интервале температур 1500... 1000 °C. Откуда следует, что при 1500 °C (рис. 2, а) первично кристаллизующими фазами в этой системе будут твердые растворы a, s(Cr), s(Ni) и химическое соединение CrN. При небольших содержаниях хрома металлический сплав может сосуществовать с кристаллической фазой внедрения e(Ni) либо нитридом хрома; средним содержаниям хрома отвечает гомогенный жидкий расплав. В сплавах, обогащенных хромом, первично кристаллизующейся фазой является феррит.
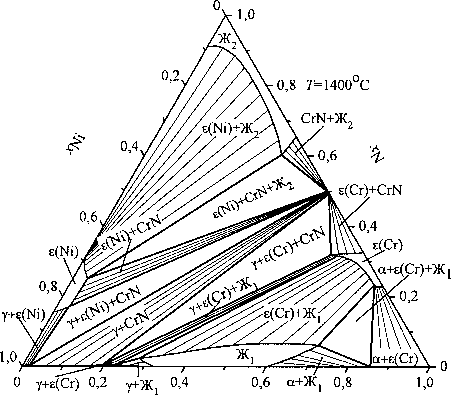
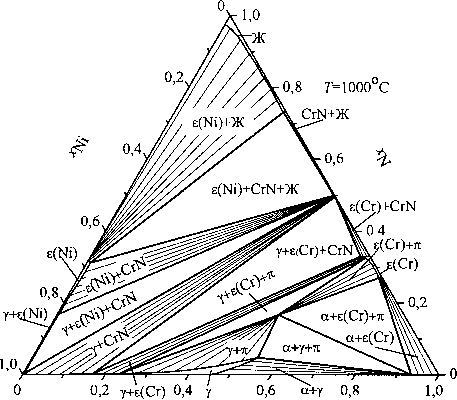
При снижении температуры до 1400 °C (рис. 2, б) область жидкого расплава значительно уменьша ется, а при небольших концентрациях хрома те же фазы равновесны аустениту. При этом изменяется также состав и количество равновесных неметаллических фаз.
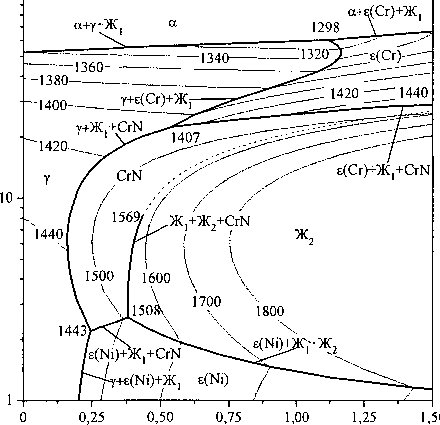
Комплекс фаз, образующихся при кристаллизации жидкого расплава, графически представлен на рис. 3 линиями трехфазного равновесия с участием жидкости. Области между кривыми определяются как политермические поверхности растворимости компонентов в расплаве, равновесном с одной из кристаллизующихся фаз. Для данной системы характерно наличие четырех нонвариантных равновесий с участием металлического расплава.
Сг
б)
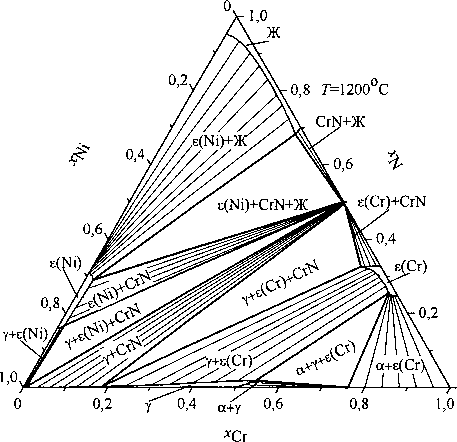
Рис. 2. Изотермические сечения системы хром - никель - азот при температуре, °C: 1500 (а), 1400 (б), 1200 (в), 1000 (г)
*Сг
Изотермическое сечение при 1200 °C (рис. 2, в) характеризуется отсутствием жидкого расплава и значительной протяженностью кривой двухфазного равновесия у + CrN, а снижение температуры приводит к образованию тройного химического соединения тг-фазы (рис. 2, г).
На изотермических сечениях при заданной концентрации одного из компонентов можно установить последовательность фазовых превращений и определить количественные соотношения равновесных фаз. Однако наиболее представительными и удобными для анализа являются политермиче-ские разрезы при постоянной концентрации одного из компонентов. На рис. 4 приведено такое по-литермическое сечение, соответствующее общему содержанию хрома в системе 20% (по массе). Графическая зависимость позволяет установить последовательность образования равновесных фаз в исследованной системе при охлаждении жидкого расплава.
Выводы. Проведен термодинамический анализ и изучены фазовые равновесия в трехкомпонентной системе хром - никель - азот. Рассчитаны и построены изотермические сечения в интервале температур 1000... 1600 °C. Рассчитана проекция поверхности ликвидуса и установлен комплекс первично кристаллизующихся фаз. Результаты расчета представлены также в виде политермиче-ских разрезов с постоянным содержанием хрома и одинаковым значением активности азота в системе.
Содержание азота в жидкости, % мае.
Рис. 3. Диаграмма трехфазных равновесий с участием жидкого сплава
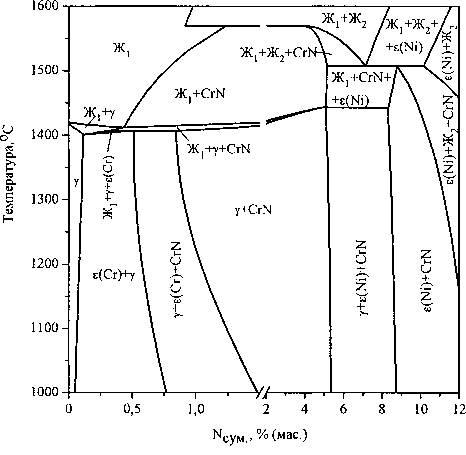
Рис. 4. Политермический разрез диаграммы состояния системы хром - никель - азот при общем содержании хрома в системе 20 % (по массе)
Список литературы Термодинамический анализ системы хром-никель-азот
- Hillert, М. The Regular Solution Model for Stoichiometric Phases and Ionic Melts./M. Hillert, L.I. Staffanson//Acta Chem. Scand. -1970. -Vol. 24, №10.-P. 3618-3626.
- Frisk, K. A Thermodynamic Evaluation of the Cr-Fe-Ni-N System/K. Frisk//Z. Metallkunde. -1991. -Bd. 82, H 2. -S. 108-117.
- Frisk, K. A Thermodynamic Evolution of the Cr-N, Fe-N, Mo-N and Cr-Mo -N System/K. Frisk//CALPHAD. -1991. -V. 15, № 1. -P. 79-106.
- Tschiptschin, A.P. Predicting Microstructure Development During High Temperature Nitriding of Martensitic Stainless Steels Using Thermodynamic Modeling/A.P. Tschiptschin//Materials Research -2002. -Vol. 5, № 3. -P.257-262.
- Люпис, К. Химическая термодинамика материалов: пер. с англ./К. Люпис; под ред. Н.А. Ватолина, А.Я. Стомахина. -М.: Металлургия, 1989. -503 с.
- Леонович, Б.И. Термодинамический анализ системы железо -хром -азот/Б.И. Леонович, Б.В. Ощепков//Вестник ЮУрГУ. Серия «Металлургия». -2009. -Вып. 12. -№14. -С. 21-26
- Sundman, В. A Regular Solution Model for Phases with Several Components and Sublattices, Suitable for Computer Applications/B. Sundman, J. Agren//Phys. Chem. Solids. -1981. -Vol. 42. -P. 297-301.
- Sundman, B. The Sublattice Model/B. Sundman, J.Agren//Mat. Res. Soc. Symp. Proc. -1983. -Vol. 19.-P. 115-127.


