Термодинамический анализ системы железо-сера
Автор: Лукоянова Светлана Вадимовна, Леонович Борис Иванович, Дильдин Андрей Николаевич, Вахитова Елена Рафаиловна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 36 (253), 2011 года.
Бесплатный доступ
Проведен термодинамический анализ, рассчитан комплекс равновесных фаз и построена диаграмма состояния системы Fe-S.
Подрешеточная модель, железо, сера, пирротин, фазовое равновесие, диаграмма состояния
Короткий адрес: https://sciup.org/147156683
IDR: 147156683 | УДК: 541.123
Текст научной статьи Термодинамический анализ системы железо-сера
Эффективность процессов, связанных с удалением серы из стали, является актуальной в черной металлургии. При анализе реакций десульфурации жидкого расплава основополагающей является система железо-сера, а также комплекс равновесных фаз, образующихся в этой системе.
При термодинамическом анализе системы Fe-S использована подрешеточная модель М. Хиллерта [1-3]. При этом предполагается квазирегулярная структура жидкого расплава, когда в подрешетках, образованных металлом и серой, имеются вакансии ( Va ). Так что структуру такого расплава можно отобразить общей формулой (Fe, Va 1)(S, Va 2).
В рамках этой модели молярная энергия Гиббса может быть представлена уравнением
7^ ж _ Г’О(ж) । Г’О(ж) I Г’О(ж) I G m = yVa1 yVa 2 G Va 1: Va 2 + y Fe y Va 2 G Fe Va 2 + yVa 1 y S G Va 1S +
+ У Fe y s G oes') + RT ( V ln V + У Fe In У Fe + y Va 2 In y Va 2 +
ж(Va2)r'(S)
+ У S In У s ) + y Va 1 У Fe y Va 2 L Va 1Fe + y Va 1 У Fe y s L Va 1FeS +
, tж(Va 1) , r'(Fe)zi\
+yVa2УSyVa 1 LVa2S + yVa2 УSУFeLVa2S , где yi - число мест в подрешетке; yFe + yVa 1 = = yS + yVa2 = 1; Lkj - температурно-зависимые параметры модели, значения которых выражаются полиномами Редлиха-Кистера:
Т ( k ) — ro( k ) . r1( k )(т Y Air2 k )(Y V 'l2
L ij = L ij + L ij ( x i - x j ) + L ij ( x i - x j ) . (2)
В данной системе образуется нестехиометрический сульфид железа FeS x (пирротин). В исследовании [3] предполагается, что в области низких содержаний серы концентрация вакансий ( yVa 1 ) в жидком железе невелика и ими можно пренебречь. Для сульфидного расплава, наоборот, считается небольшой концентрация yVa 2. Их концентрация существенно возрастает вблизи области существования пирротина.
Парциальные молярные энергии Гиббса гипотетических компонентов бинарной системы вычисляли по формуле
Г . д G m д G m v д Gm
Gi:j = Gm +^+ ,--LУк -- дyi дyj к дyk
( к = Fe, Va 1,S, Va 2).
Тогда в соответствии с уравнением (1) парциальные молярные энергии Гиббса компонентов расплава, обогащенного железом (верхний индекс (Fe)), будут иметь вид:
G 1 '(Fe) х//~|О(ж) /~<о(ж) x , //~<о(ж) /~<о(ж) х , S ( ) = (1 - У Fe )( G ValS - G ValVa 2 ) + У Fe ( G Fes ) - G FeЩ2 ) +
+ RT ln[( y s /(1 - y s)] - y Fe (1 - У Fe ) L VV F^ +
+ У Fe (1 - 2 У s ) L VI21 + У Fe (1 - У Fe )(2 У Fe - 1) L VV^ +
+ У Fe (1 - У Fe ) ^ (1 - 2 У Fe ) L^ Fe + (1 - У Fe )[1 - 6 y s (1 - У д )] Х
■ L VV^ + У Fe [1 - 6 У s (1 - y s )] L VV FeS ; (4)
G Fe Va 2 = G Fe: Va 2 + (1 - y Fe ) y S ( G FeS - G Fe Va 2 +
+ G Va 1S + G Va 1Va 2 ) + RT ln[ У Fe (1 - У s )] +
+ (1 - y Fe )(1 - y S - y Fe + 2 y Fe y S ) L VV Fe +
+ y s (1 - У Fe )(1 - 2 y Fe ) L VS Fe + y s (1 - У Fe )(2 y s - 1) L Xf +
+ yS (1 - y S - y Fe - 2 y Fe y S ) L Va2S + y S[(1 - 3 y S + 2 y s ) + + y I e(6 y s - 6 yS - 1)] L as + y s(1 - y i e)(6 y s - 6 yS - 1) L VVa s2) + + y S(1 - y Fe)(6 y Fe - 6 y Fe + 1) L V SlFe + (1 - y Fe)[ y Fe(1 - 2 y Fe ) - - (1 - У s )(6 У Fe - 6 y Fe + 1)] C^. (5)
В случае расплава, обогащенного железом, содержание серы в подрешетке рассчитывается из соотношения y s = x s /(1 - x s).
Аналогично были определены парциальные характеристики и расплава, обогащенного серой.
Энергия обмена вакансий ( G V a 1: Va 2) в различных подрешетках также рассчитывалась по формуле (3). При этом было получено соотношение:
Лукоянова С.В., Леонович Б.И., Дильдин А.Н., Вахитова Е.Р.
Термодинамический анализ системы железо–сера
ж o(ж)o(ж)o(ж)o(ж)
G Va 1Va 2 = G Va 1Va 2 + y Fe y S( G Va 1S + G Fe Va 2 G Va 1Va 2
- G F^) ) + RT ln[(1 - y Fe )(1 — y s )] + y Fe [(1 - y Fe ) y s +
+ y Fe(1 - y s) LVa1 Fe) + y Fe y S(2 y Fe - 1) L a Fe +
+ y S[ y Fe (1 - y s) + y S(1 - y Fe)] L a S ) +
+ y S y Fe (2 y S - 1) L Va 2S + y Fe [(1 - y Fe ) y S (1 - 2 y Fe ) +
+ (3 - 4 y F e)] L^ a ,2e) + ysy Fe [6 y Fe (1 - y Fe) - 1] L ^ e +
Fe Va 1Fe S Fe Fe Fe Va 1Fe
+ y s [ y Fe (1 - y s )(1 - 2 y s ) + (1 - y Fe ) y s (3 - 4 y s )] <£) + + y Fe y S (6 y S - 6 y S - 1) L VFS , (6)
где G Va 1 Va 2 - GVa 1 Va 2 = 0 •
В случае твердых растворов внедрения при достаточно малых значениях концентрации серы молярная энергия Гиббса и парциальные энергии компонентов раствора могут быть рассчитаны в предположении регулярного раствора [3]:
G m = x Fe G Fe: Va + x S G I?e:S + RT ( x Fe ln x Fe + x S ln x s ) +
+ X Fe X S L Fe: Va + G m , (7)
В этой формуле магнитная составляющая энергия Гиббса определяется формулой
G m Mar = RT ln( p + 1) • f ( t ), (8)
где p Fe = 2,22; t = T / Tc Fe; T^ = 1043 K - температура Кюри железа;
f ( t ) = 1 - 0,9053 t 3 - 6,8 ^ 10 - 3 t 9 - 1,53 t 15 при t <1;
f ( T ) = - 6,417 • 10 - 2 t- 5 - 2,037 • 10 - 3 t- 15 - 4, 278 t- 25 при T <1.
Результаты расчета растворимости серы в твердых и жидких растворах представлены на рис. 1.
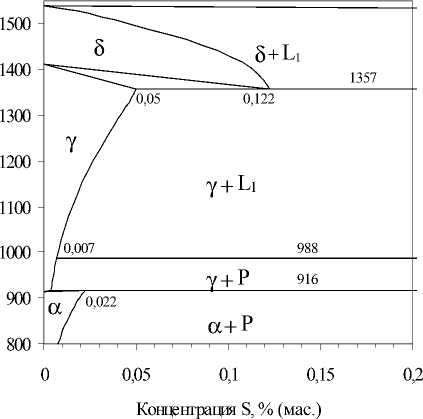
Рис. 1. Растворимость серы в твердых растворах системы Fe–S
Термохимические параметры системы железо–сера [3]
|
Фаза |
Параметр, Дж/моль |
|
Жидкость (Ж) |
G Fe Va 2 - G Fe(ГЦК) =- 11274 + 163,878 T - 22,03 T ln T + 4,1755 • 10 - 3 T 2 G Va S - 1 G So2 (ra3) =- 65357 + 165,396 T - 13,513 T ln T G 0eS - G 0е (ГЦК ) - 1 G s'(газ) =- 157578 + 200,119 T - 19,252 T ln T FeS Fe 2 S2 o( Va 1) o( Va 2) L Va 2Fe = L Va 1S = 1001 L Va FS) = 31761 - 9,202 T Z V FS) = 10761 + 0,477T L V2.Fe = 79779 - 45,139 T L VS2Fe = 57510 - 17,082 T |
|
Пирротин (Р) |
G FeS - G Fe (ГЦК) - 1 G so2 (ra3) =- 150957 + 15,076 T + 5,598 T ln T G Va S - -2 G So2 (ra3) = 6433 + 145,376 T L VaFe =- 126374 - 69,27 T |
|
ГЦК ( Y ) |
G '(ГЦК) - 1 g '(газ) =- 30000 + 50 T S 2 S 2 L ™ = 11442 - 24,855 T |
|
ОЦК ( a ) |
G FeОЦК) - G FeГЦК) = 1462,4 - 8,282 T + 1,15 T ln T - 0,00064 T 2 G '(оЦК) - 1 g ' (газ) = - 31000 + 50 T S 2 S 2 2 (ОЦК) =- 27053 - 8,18 T |
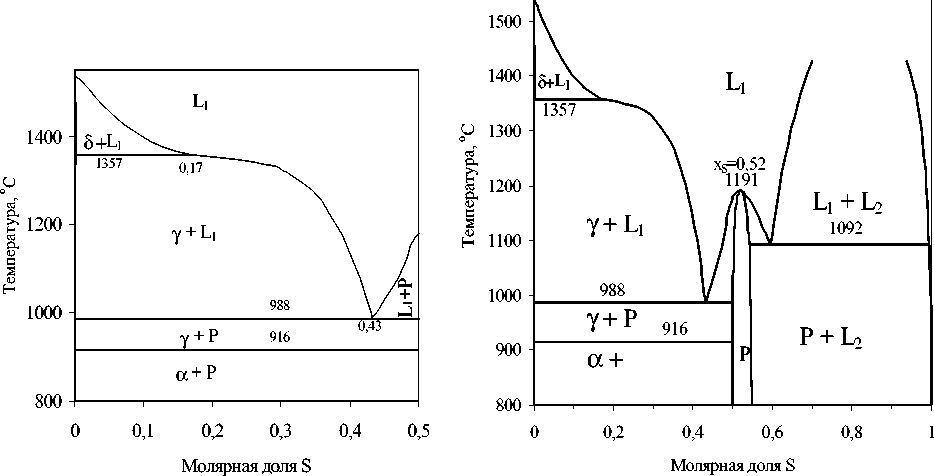
Рис. 2. Диаграмма состояния системы Fe–FeS
Рис. 3. Диаграмма состояния системы железо–сера
С позиции подрешеточной модели были также рассчитаны термодинамические свойства пирротина (Р). При этом парциальные молярные энергии Гиббса представлены уравнениями:
G S P = G V o a (S P ) + RT ln(1 - y Fe ) + y F2e L S V ( aP F)e ;
G F P e = G FoeS - G V o a S + RT ln[ y Fe /(1 - y Fe )] - (9)
- (2 y Fe - 1) L S V ( a P F)e .
Параметры модели определены в соответствии с экспериментальными данными активности серы в пирротине [3]. Термохимические данные, использованные в расчете, представлены в таблице.
Графическое представление равновесных фаз в полусистеме Fe–S показано на рис. 2. В этом интервале концентраций имеют место два нонвари-антных превращения с участием жидкого расплава: перитектическое (при температуре 1357 °С) и эвтектическое (при 988 °С).
На рис. 3 по результатам расчетов приведена диаграмма состояния системы железо – сера.
Работа выполнена в рамках реализации научной программы Министерства образования и науки РФ «Развитие научного потенциала высшей школы (2009–2011 годы)», код проекта – 713 (10909).
Список литературы Термодинамический анализ системы железо-сера
- Hillert, M. The Regular Solution Model for Stoichiometric Phases and Ionic Melts/М. Hillert, L.I. Staffanson//Acta Chem. Scand. -1970. -Vol. 24, № 10. -P. 3618-3626.
- Sundman, B. The Sublattice Model/B. Sundman, J. Agren//Mat. Res. Soc. Symp. Proc. -1983. -Vol. 19. -P. 115-127.
- An Assessment of the Fe-S System Usinq a Two-Sub lattice Model for the Liquid Phase/A. Fernandez, M. Hillert, B. Jansson and B. Sundman//Metallurgical Transactions B. 1981. -Vol. 12B, № 12. -P. 745-754


