Термодинамический анализ восстановления оксидов железа в газовых смесях (CO-H2) в присутствии углерода
Автор: Кузнецов Юрий Серафимович, Михайлов Геннадий Георгиевич, Качурина Ольга Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.17, 2017 года.
Бесплатный доступ
Обсуждены особенности процессов восстановления оксидов железа Fe3O4 до FeO и FeO до Fe в газовых смесях H2 (ao, моль) - CO (co, моль) в контакте с углеродом при нагревании до T = 850…955 К при давлении 1 атм. Общее количество газов в исходной смеси задавалось (ao + co) = 1 моль, а соотношение ao/co варьировалось в пределах от 1/0 до 0/1. Рассчитаны параметры получающихся равновесных систем: Fe3O4 - FeО - Н2 (a) - Н2О (b) - СО (c) - СО2(d) - С, FeO - Feа- Н2 (a) - Н2О (b) - СО (c) - СО2 (d) - С. Определены условия выделения сажистого углерода и его количества. Рассчитаны параметры реакций газификации углерода парами воды Н2О и диоксидом СО2. Вычислены общий и удельный расходы углерода. Рассчитаны количества восстановленных оксидов Fe3O4 и FeO. По результатам этих расчетов определены соотношения восстановительных способностей Н2 и СО γ = b/d. Для восстановления и Fe3O4 до FeO, и FeO до Fe это соотношение изменяется от 0 до 5,76 в зависимости от температуры и величины ao/co. Показано, что восстановление Fe3O4 до FeO при температуре ~ 917 К характеризуется величиной γ = 2,30 и большими количествами восстановленного оксида. Восстановление FeO до Fe при ~ 955 К характеризуется величиной γ = 1,71 и большими количествами восстановленного оксида.
Оксиды железа, восстановление, водяной газ, газификация углерода
Короткий адрес: https://sciup.org/147157114
IDR: 147157114 | УДК: 669.11 | DOI: 10.14529/met170401
Текст научной статьи Термодинамический анализ восстановления оксидов железа в газовых смесях (CO-H2) в присутствии углерода
Фазовые равновесия, реализующиеся при
восстановлении оксидов железа в различных газовых атмосферах в присутствии углерода, обсуждаются в литературе в связи с появлением новых низкотемпературных технологий. В работах [1, 2] обсуждались процессы восстановления оксидов железа в атмосфере водяного газа в присутствии избытка углерода в качестве самостоятельной фазы и особенности графической интерпретации результатов
C+CO2 = 2CO,
A r G T (2) = 172140 - 177,7 ■ T ;
C+H O=CО+H , 2 2
A r G T (3) = 135 560 - 144,235 ■ T ;
Fe O +CO=3FeO+CO , 3 4 2
A GT (4) = - 10 034 - 38,635 ■ T In T + 271,78 ■ T ;
термодинамических расчетов равновесных состояний систем (рис. 1, 2):
Fe 3 O 4 – Fe α – Н 2 – Н 2 О – СО – СО 2 – С; ( а ) Fe 3 O 4 – FeО – Н 2 – Н 2 О – СО – СО 2 – С; ( b ) FeO – Fe α ,γ,ж – Н 2 – Н 2 О – СО – СО 2 – С. ( c )
Равновесные параметры таких систем определялись в работах [1, 2] расчетом совмест-
ных равновесий таких реакций: H2+CO2=H2O+CO,
A r G T (1) = 36 580 - 33,465 ■ T ;
Fe O +H =3FeO+H O, 3 4 2 2
A r G T (5) = 26 546 - 38,635 ■ T In T + 238,315 ■ T ;
FeO+CO=Feα+CO2,
Ar GT (6) = - 21785 + 25 ■ T,
Т < 1185 К;
FeO+H2 =Feα +H2O,
ArGT (7) = 14 799 - 8,465 ■ T,
Т < 1185 К.
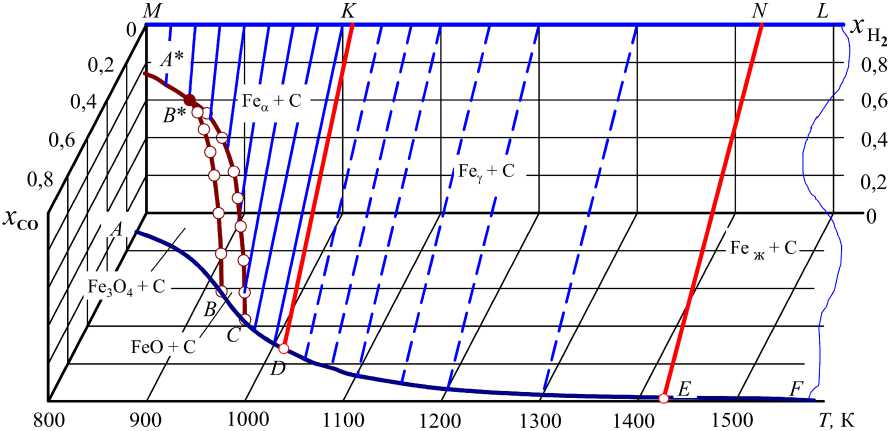
Рис. 1. Области на диаграмме фазовых равновесий в системах «оксиды железа – CO – CO2 – Н2 – Н2O – С »: область ( Fe α + C ) – изотермы от 800 до 1011 К соответствуют концентрациям C в Fe α от ∼ 0 до 0,0195 %; область ( Feγ + C ) – изотермы от 1011 до 1427 К соответствуют концентрациям C в Feγ от ∼ 0,69 до 2,08 %; границы областей: ( Fe α + C ) и ( Fe γ + C ) – 1011 К, Fe α (0,0195 % C ), Fe γ (0,69 % C ), ( x CO Ix γCO ) = 0,7623/0,2377;
( Fe γ + C ) и ( Fe ж + C ) – 1427 К, Fe γ (2,08 % C ), Fe ж (4,26 % C ), ( x CO I x CO ) ≈ 0,999/0,001
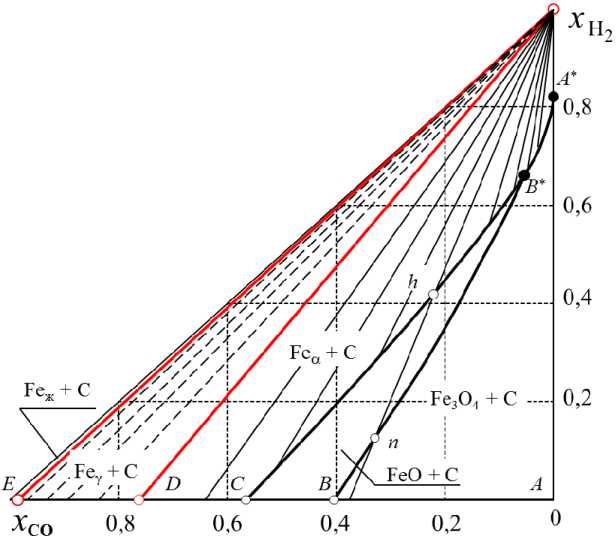
Рис. 2. Проекции линий и изотерм диаграммы фазовых равновесий в системах «оксиды железа – CO – CO2 – Н2 – Н2O – С » [1, 2]
На пространственной диаграмме фазовых равновесий (рис. 1) в системах (а), (b) и (c) линиями представлены три параметра (температура, молярные доли газов-восстановителей Н2 и СО в водяном газе), определяющие возможность восстановления оксидов. Рис. 2 представляет изотермические сечения этой пространственной диаграммы. Являющаяся основой технологических газовых атмосфер, смесь (Н2 – Н2О – СО – СО2) может быть получена разными способами. При выборе оптимального способа в частной технологии переработки железных руд следует учитывать особенности фазовых равновесий систем. В настоящей работе приводится анализ процессов при нагревании исходных систем:
Fe 3 O 4 – H 2 ( a o , моль) – СО ( c o ) – С, FeO – H 2 ( a o , моль)– СО ( c o ) – С.
Для примера детально рассмотрим процессы, протекающие в закрытых системах FeO – H 2 ( a o ) – СО ( c o ) – С при изотермических выдержках выше 850 К при давлении 1 атм. При расчетах параметров перехода исходных систем в равновесия следует определить: количества газов H2, H2O, СО и СО 2 и состав равновесного водяного газа; расход углерода; количество железа, восстановленного H 2 и СО и оценить восстановительные способности водорода и монооксида углерода. Для решения этих задач необходимо определить параметры совместных равновесий пяти возможных в системе реакций (1)–(3), (6) и (7), лишь три из которых независимы. Предлагается такая методика расчета совместного равновесия таких трех независимых реакций:
FeO + H 2 = Fe a + H 2 O FeO + CO = Fe a + CO 2
С + H 2 O = H 2 + CO
– a o c o
(z – y ) ( a o – z + y ) ( c o – x + y )
a o – c o –
( a o – z + y ) (z – y ) ( c o – x + y ) x
Здесь в первой строке после уравнений химических реакций указаны исходные количества H2 и CO, во второй строке – числа молей компонентов водяного газа в состоянии равновесия:
y определяет количество газифицированного углерода, а также количества CO и H 2 , получающиеся по реакции газификации (3);
x определяет число молей оксида СО, затраченного на восстановление, или число молей восстановленного по реакции (6) железа, или число молей полученного при этом СО 2 ;
z определяет число молей водорода, затраченного на восстановление, или число молей восстановленного по реакции (7) железа.
Получаем для общего количества газов в состоянии равновесия:
E « Газ = ( a o - z + y ) + ( z - y ) + ( c o - x + y ) + x = ( a o + c o + y ).
-
(8)
-
(9)
Тогда для констант равновесия выбранных реакций имеем:
( c o - x + y) * ( a o - z + y) n x ( z - y )
K 3 — * P; K 6 — ; K 7 —.
( a o + c o + y ) * ( z - y ) ( c o - x + y ) ( a o - z + y )
Решение системы трех уравнений (9) при 1 атм позволяет определить количественные изменения твердых и газовой фаз:
— K7K3 (1 + K6) (ao + co) - eo y [1-K7 K3 (1 + K6 )]
z — K7 * ao + (1 + K 7) * y ; x — K 6( с o + y)
(1 + K 7 ) ; ( 1 + K 6 ) .
После подстановки выражения (10) в формулу (8) получаем, что общее количество газов в равновесной системе при заданной температуре зависит только от количества водорода в исходной системе:
( a o + c o + y ) =
s —
a o
.
1 - K 7 K 3 (1 + K 6 )
В этом просматривается особая роль водорода, на которую обращали внимание специалисты [3, 4]. Состав равновесного водяного газа определяется уравнениями:
e„ + y - x x z - y a„ + y - z oo xCO — ; xCO2 — ; xH2O — ; xH2 — a o + с o + y 2 ao + с o + y 2 ao + с o + y 2 a o + с o + y
.
Количества восстановленного железа, соотношение восстановительных способностей Н 2 и СО, а
также доля железа, восстановленного водородом, рассчитываются по уравнениям:
E n Fe = x + z ; Y — z/x ; a H 2 = z /( x + z ).
Количества H2 и СО в исходной системе могут быть любыми. Здесь приведены результаты расчетов по уравнениям (8)–(14) для ограниченного количества исходных газов ( a o + c o ) = 1 моль, табл. 1–4 и рис. 3–8.
Таблица 1
Параметры перехода системы FeO – Н2 ( a o = 1 моль) – С в равновесную систему
FeO – Fe α – Н2 ( a o – z + y ) – Н2О ( z – y ) – СО ( y – x ) – СО2 ( x ) – С при изотермических выдержках в интервале температур 850…955 К, P = 1 атм
|
T , К |
850 |
870 |
890 |
910 |
930 |
950 |
955 |
|
[1– K 7 K 3 (1 + K 6 )] |
0,8868 |
0,8219 |
0,7251 |
0,5834 |
0,3792 |
0,0895 |
~ 0 |
|
y |
0,1277 |
0,2167 |
0,3791 |
0,7141 |
1,6370 |
10,169 |
~ 1941 |
|
x |
0,06627 |
0,1086 |
0,1836 |
0,3343 |
0,7412 |
4,4552 |
~ 843 |
|
z |
0,3819 |
0,4802 |
0,6516 |
0,9954 |
1,9269 |
10,467 |
~ 1942 |
|
а = a o – z + y |
0,7458 |
0,7365 |
0,7275 |
0,7187 |
0,7102 |
0,7016 |
0,7 |
|
b = z – y |
0,2542 |
0,2635 |
0,2725 |
0,2813 |
0,2898 |
0,2984 |
0,3 |
|
с = y – x |
0,0614 |
0,1081 |
0,1955 |
0,3798 |
0,8958 |
5,7161 |
~ 1097 |
|
d = x |
0,0663 |
0,1086 |
0,1836 |
0,3343 |
0,7413 |
4,4571 |
~ 843 |
|
∑ ni газ = a + b + c + d |
1,1277 |
1,2167 |
1,3791 |
1,7141 |
2,6371 |
11,173 |
~ 1942 |
|
V , л |
78,6 |
86,8 |
100,6 |
130,4 |
201,1 |
870,4 |
15 ⋅ 104 |
|
x H 2 |
0,6612 |
0,6053 |
0,5275 |
0,4193 |
0,2693 |
0,0628 |
∼ 0,00036 |
|
x H 2 O |
0,2255 |
0,2166 |
0,1976 |
0,1641 |
0,1099 |
0,0267 |
0,00013 |
|
x CO |
0,0545 |
0,0889 |
0,1418 |
0,2216 |
0,3397 |
0,5116 |
0,5652 |
|
x CO 2 |
0,0588 |
0,0893 |
0,1331 |
0,1950 |
0,2811 |
0,3989 |
0,4344 |
|
∑n Fe = x+ z |
0,4482 |
0,5889 |
0,8352 |
1,3297 |
2,6681 |
14,922 |
~ 2785 |
|
γ = z /x |
5,7639 |
4,4208 |
3,5493 |
2,9776 |
2,5997 |
2,3494 |
2,3010 |
|
α H = z /(x + z ) |
0,8522 |
0,8155 |
0,7802 |
0,7486 |
0,7222 |
0,7014 |
0,6971 |
|
∑ n С |
0,128 |
0,217 |
0,379 |
0,714 |
1,637 |
10,18 |
~ 1942 |
|
∑ n С / ∑n Fe |
0,2856 |
0,3685 |
0,4538 |
0,5370 |
0,6135 |
0,6527 |
0,6973 |
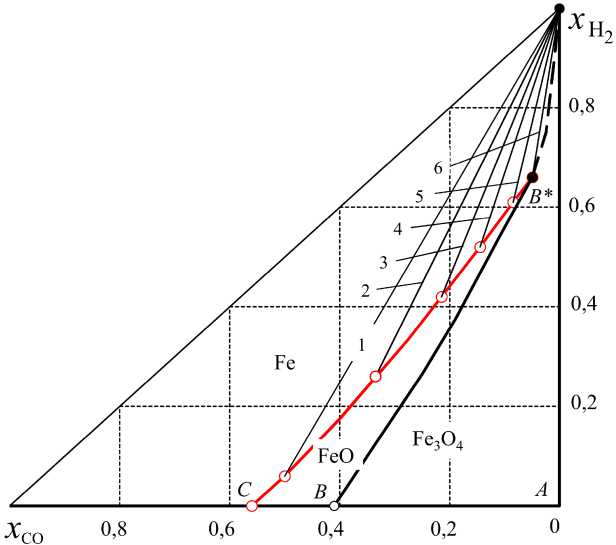
Рис. 3. Восстановление FeO до Fe при изотермических выдержках исходной системы FeO – Н2 – С , давление 1 атм: 1 – Т = 950 К, γ = 2,3494; 2 – 930 К, γ = 2,5997; 3 – 910 К, γ = 2,9776; 4 – 890 К, γ = 3,5493; 5 – 870 К, γ = 4,4208; 6 – 850 К, γ = 5,7639
В табл. 1 и рис. 3 приведены результаты расчетов параметров системы, получающейся при изотермических выдержках смеси FeO – H2 (1 моль) – С для крайнего случая co = 0 – отсутствие в исходной системе CO. На рис. 3 изотермические линии 850…950 К, соединяющие точку xH = 1 с точками линии B*C, условно показывают изменение газовой фазы при переходе исходной системы в равновесные состояния. Вычисленные концентрации компонентов водяного газа, равновесного со смесью FeO – Fe – C, совпадают с концентрациями, полученными в работах [1, 2] расчетами возможных равновесий систем FeO – Feα – Н2 – Н2О – СО – СО2 – С (см. рис. 1 и 2) без задания какого-либо исходного состояния. Введение в систему FeO – С водорода приводит не только к процессу восстановления FeO до Fe по реакции (7), но и активирует реакцию восстановления (6) в результате образования по реакции газификации (3) оксида углерода СО. Этот эффект значительно усиливается с ростом температуры, о чем можно судить по количеству образовавшегося СО2. Кардинальные изменения процессов восстановления водородом в присутствии углерода иллюстрирует рис. 4. На этом рисунке информация о равновесных параметрах системы, получающейся при нагревании исходной системы FeO – Н2(ao) – С (линия 10) сопоставлена с информацией о параметрах восстановления FeO в газовой смеси Н2 (ao) – СО (bo) без углерода – линии 1–9. Этот рисунок без линии 10 впервые привел Н.Л. Гольдштейн [3].
Из результатов расчетов следует, что при изотермической выдержке переход системы FeO – Н 2 – С в равновесное состояние сопровождается увеличением количества газов. При повышенных температурах это увеличение становится весьма значительным: если к моменту достижения равновесия при 850 К количество газов увеличивается на 13 %, то при 955 К в 1942 (!) раза, что объясняется реакциями газификации. При этом количество водорода в состояниях равновесия практически не меняется. Из этого следует, что весь
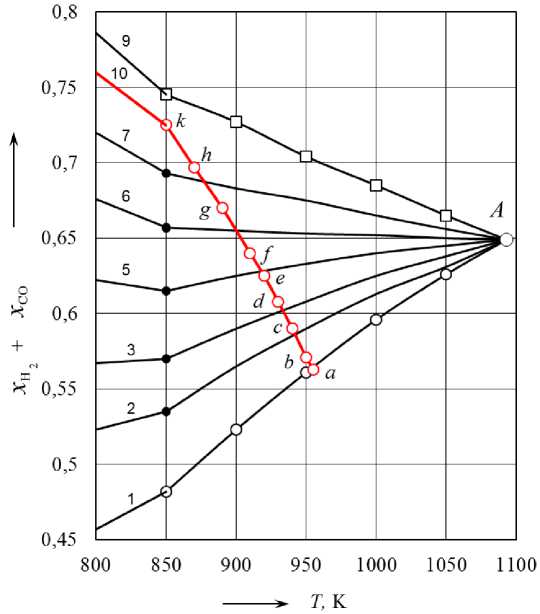
Рис. 4. Суммы равновесных концентраций H 2 и СО при восстановлении оксида FeO в смесях Н2 ( a o ) – СО ( c o ) в отсутствии (линии 1–9) и присутствии (линия 10) углерода: линия 1 – a o / c o = 0; 2 – 0,25; 3 – 0,5; 4 – 0,75; 5 – 1; 6 – 2; 7 – 3; 8 – 4; 9 – ∞ ; точки на линии 10: a – a o/ c o = 0; b – 0,0983; c – 0,3276; d – 0,6109;
e – 0,9624; f – 1,4004; g – 2,6380; h – 4,6138; k – 7,8339
получающийся по реакции газификации (3) водород полностью расходуется на восстановление. Решающее влияние на общее количество газов оказывает реакция газификации углерода диоксидом СО 2 . В предложенной методике расчетов в выбранные три независимые реакции включена реакция газификации (3). Однако из положения изотермических линий на рис. 3 видно, что в любом состоянии до равновесного в газовой фазе отношение ( x CO/ x CO2 ) факт меньше ( x CO/ x CO2 ) равн , характеризующего равновесие реакции (2). Поэтому при изотермических выдержках системы FeO – Н 2 – С протекают обе реакции газификации, а величина y в равновесном состоянии включает общее количество газифицированного углерода. Это подтверждается расчетом материального баланса по количествам СО и Н 2 , получившихся к моменту достижения равновесия.
Баланс по СО – количество СО, получившегося по реакциям (2) и (3), должно быть равным затратам его на восстановление плюс количество его в газовой фазе:
n со (2) + n со (3) = x + Z n™ • x CO .
Например:
850 К, n СО (2) + n СО (3) =
= 0,06627 + 1,1277·0,0545 = 0,1277 = y ;
955 К, n СО (2) + n СО (3) =
= 843 + 1942·0,5652 = 1942 = y .
Баланс по Н 2 – количество Н 2 , получившегося по реакции (3), должно быть равным затратам его на восстановление плюс количество его в газовой фазе минус исходное количество:
n H2 = n H2 (7) + z nT * x H2 - 1 =
= z + z nT • x H 2 • x CO - 1.
Например:
870 К, n = 0,4802 + 1,2167·0,6053 –1 = H 2
= 0,2166 = y ;
950 К, n = 10,467 + 11,173·0,0628 – 1 = H 2
= 10,169 = y .
Таким образом, восстановление FeO до Fe в системе FeO – Н 2 – С по реакции (7) активирует реакцию газификации (3) и реакцию восстановления (6), протекание которой, в свою очередь, активирует реакцию газификации (2).
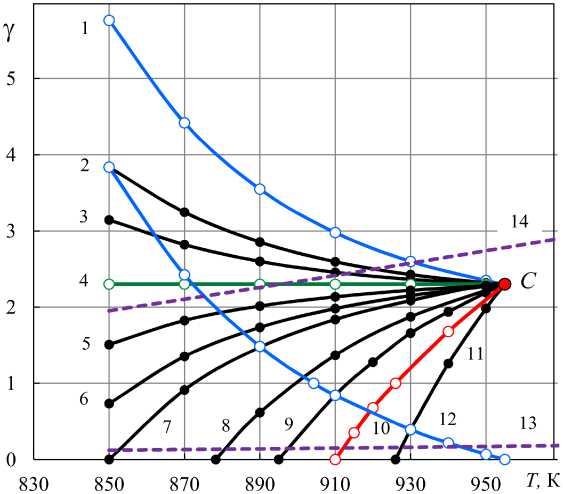
Рис. 5. Соотношение восстановительных способностей Н2 и СО по отношению к FeO при нагревании различных исходных систем: « FeO – Н 2 ( a o ) – С» – линия 1; « FeO – Н 2 ( a o ) – СО ( c o ) – С» с разными количествами Н 2 и СО : 2 – a o / c o = 0,8868/0,1132, 3 – 0,852/0,148, 4 – 0,8133/0,1867 , 5 – 0,78/0,22, 6 – 0,75/0,25, 7 – 0,724/0,276, 8 – 0,65/0,35, 9 – 0,5834/0,4166 (табл. 3), 11– 0,3792/0,6208; « FeO – Fe – Н 2 О ( b o ) – С» – линия 10, не опубликовано; « FeO – Н2 ( a o* ) – СО ( c o* ) – С» – линия 12 при отношениях a o* / c o* , обеспечивающих неизменность количества газа, табл. 1; « FeO – Н2 ( a o ) – СО ( c o )», a o / c o = 1/4 и 4/1 – линии 13 и 14, работа [3]
В результате такого взаимовлияния в закрытой системе при затрате 1 моля (!) водорода восстанавливается при 955 К около 2785 моль (!) оксида FeO.
Поскольку при нагревании системы FeO – Н 2 – С железо восстанавливается и водородом, и оксидом СО можно сравнивать восстановительные способности Н 2 и СО γ = z /x . Видно, линия 1 рис. 5, что величина γ изменяется от 5,76 при 850 К до 2,3 при 955 К. Следовательно, устоявшееся суждение, что при 1093 К (820 °С) восстановительные способности Н 2 и СО одинаковы, а при температурах < 1093 К монооксид СО более сильный восстановитель, нельзя транслировать на все возможные способы организации процессов восстановления.
Если нагревать исходную систему FeO – H 2 ( a o ) – СО ( c o ) – С с любым соотношением С = a o / c o , то параметры равновесного водяного газа получающейся системы FeO – Fe α – Н2 – Н 2 О – СО – СО 2 – С рассчитываются по уравнениям (10)–(14) и определяются той же линией B*C , рис. 1–3, 6, 7 и 8 a . Однако количественные изменения газовой фазы характеризуются некоторыми особенностями. Расчеты количественных изменений фаз при нагревании этих систем до температур 850…955 К выполнялись для произвольных соотношений количеств Н2 и СО при неизменной сумме ( a o + c o ) = 1 моль. Примеры расчетов приведены в табл. 2–4 и на рис. 6–8.
Обнаружены две особенности процессов при нагревании исходной системы. Одна из них состоит в том, что общее количество газов в равновесии зависит от температуры и количества водорода в исходной системе a o , но не зависит от количества монооксида углерода c o , уравнение (12). Вторая особенность следует из того же уравнения (12). Знаменатель [1– K 7 K 3(1 + K 6)] в этом уравнении в интервале температур 850…955 К принимает значения от 0,8868 до 0. Если, например, задать a o = 0,8868 ( c o = 0,1132 моль), то после выдержки исходной системы при 850 К, при этой температуре [1- K 2 - K 4 - (1 + K 1 )] = 0,8868, в результате совокупности процессов общее количество газов остается неизменным – равным единице, табл. 2 и линия GB* на рис. 6. Следовательно, углерод не вовлекается в процессы газификации и восстановления. Если же задать исходные количества a o = 0,5834, c o = 0,4166 моль, то после выдержки исходной системы при 910 К, при этой температуре
[1- K 2 - K 4 - (1 + K 1 )] = 0,5834, суммарное количество газов в системе не изменится, табл. 3 и линия G′ B* на рис. 7. Таким образом, существует такая по составу исходная газовая смесь (H 2 – СО), восстановление оксида FeO в которой при строго определенной температуре не приводит к увеличению общего количества газов, то есть в процессах восстановления оксида углерод не расходуется. В табл. 4 и на рис. 8 представлены некоторые сочетания температуры нагрева и состава исходной газовой смеси, при которых не изменяется общее количество газов. Так как в этом случае углерод не расходуется, то соотношение восстановительных способностей H2 и СО γ равно отношению концентраций x H O и x CO в равновесном газе [1, 2].
В общем случае при нагревании до температур 850…955 К исходных систем FeO – Н 2 ( a o ) – СО ( c o ) – С с разными составами газовой фазы соотношение γ восстановительных способностей Н2 и СО изменяется в пределах от 0 до 5,76. В зависимости от состава смеси (Н 2 – СО) это соотношение может возрастать, уменьшаться или оставаться неизменным с повышением температуры, рис. 5.
Обсудим теперь количественные изменения всех фаз при нагревании до температур 850…955 К систем FeO – Н 2 ( a o ) – СО ( c o ) – С с произвольными количествами Н2 и СО. Сделаем это на примере нагревания до разных температур исходной системы FeO – Н 2 (0,5834 моль) – СО (0,4166 моль) – С.
Результаты расчетов процессов в этой системе приведены в табл. 3. После выдержки этой системы при 910 К в получившемся равновесном состоянии FeO – Fe α – Н 2 ( a ) – Н 2 О ( b ) – СО ( c ) – СО 2 ( d ) – С общее количество газов останется неизменным ( a + b + c + d ) = ( a o + c o) = = 1 моль, см. выделенный жирным курсивом столбец табл. 3. На рис. 5 этому соответствует линия 9, на рис. 7 этому соответствует линия G′h′ , при этом углерод не расходуется , остальные линии условно отражают изменение состава газовой фазы при переходе системы в состояние равновесия при других температурах.
Если эти температуры ниже 910 К , то Σ = ( a + b + c + d ) < ( a o + c o ) = 1 моль, так как при этих температурах интегральная характеристика реакций восстановления и реакции газификации [1– K 2 K 4 (1 + K 1 )] > 0,5834, табл. 3. Это означает, что и в этом случае углерод
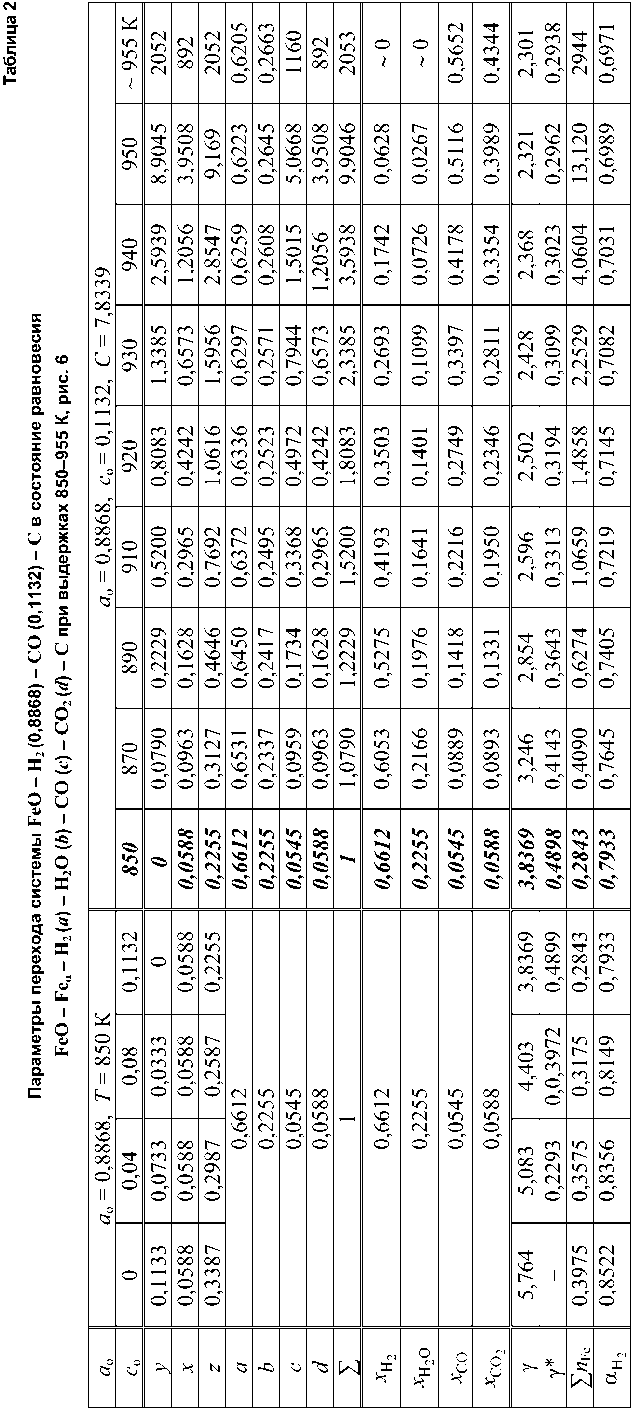
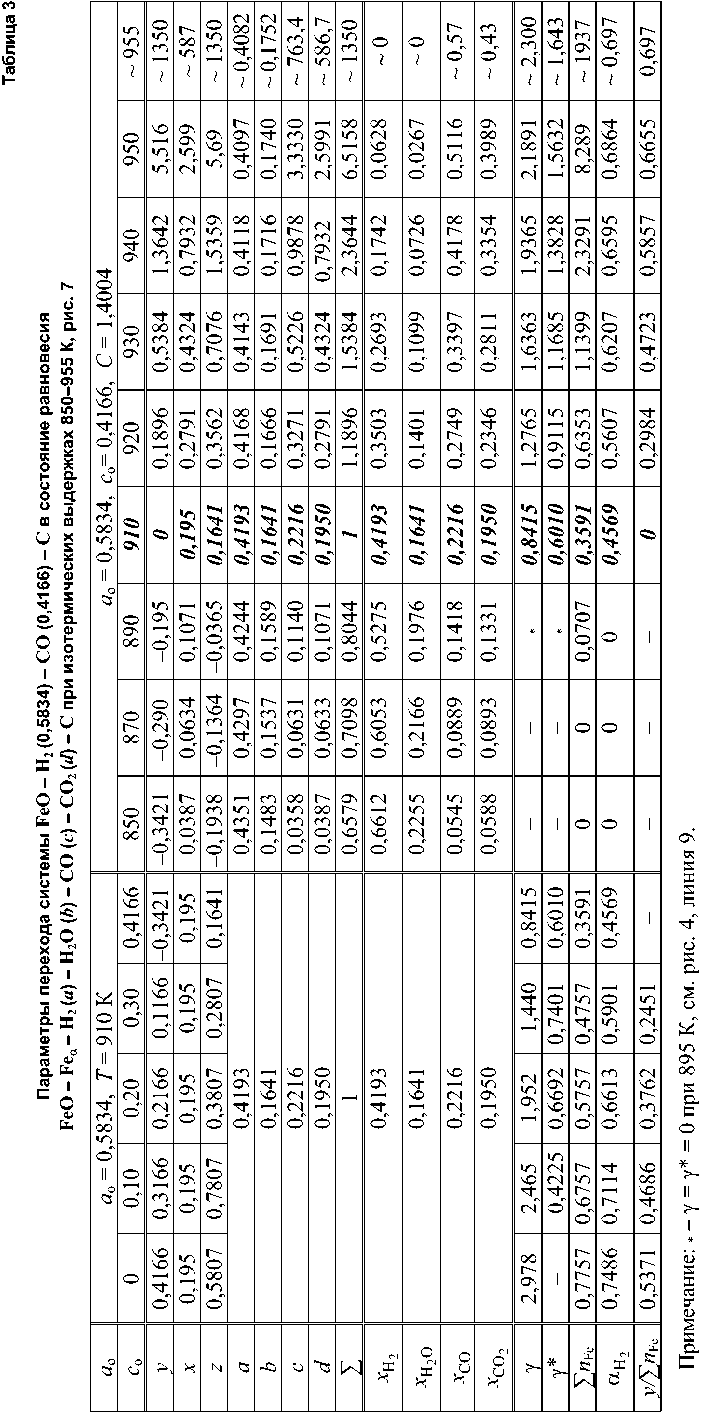
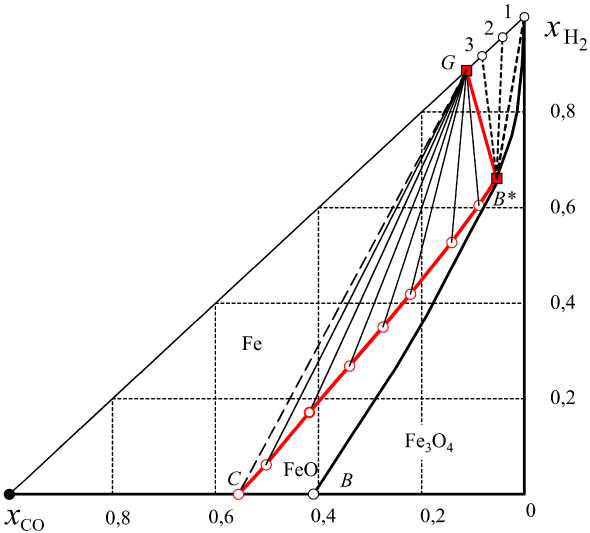
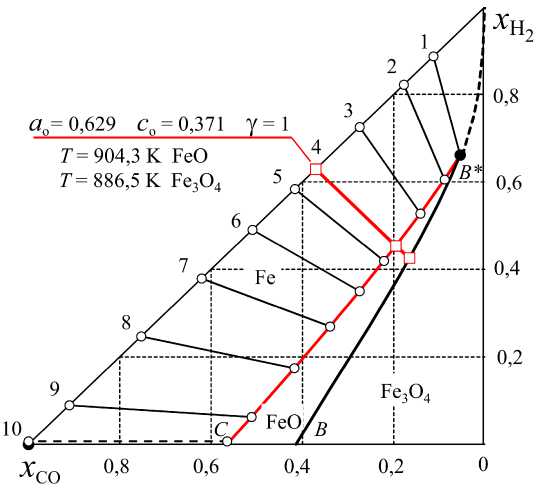
Рис. 6. Параметры перехода системы FeO – Н2 (0,8868) – СО (0,1132) – С в состояние равновесия FeO – Fe α – Н2 ( a ) – Н2О ( b ) – СО ( c ) – СО2 ( d ) – С при изотермических выдержках: 850 К (линии 1, 2, 3 и GB* ) – ∑ = 1 моль, 870, 890, 910, 920, 930, 940, 950 и 955 К (линия GC ) – ∑ > 1 моль пунктирные линии 3, 2, 1 – нагревание систем с неизменным количеством водорода a o = 0,8868 моль и убывающим от 0,1132 до 0 количеством СО
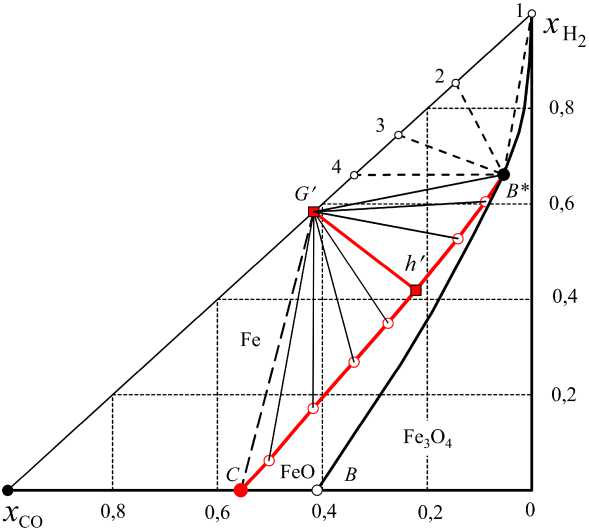
Рис. 7. Параметры перехода системы FeO – Н2 (0,5834) – СО (0,4166) – С в состояния равновесия FeO – Feα – Н2 (a) – Н2О (b) – СО (c) – СО2 (d) – С при изотермических выдержках: 850 (линия G′B*), 870, 890 К – ∑ < 1 моль; 910 К (линия G′h′ ) – ∑ = 1 моль; 920, 930, 940, 950 и 955 К (линия G′C) – ∑ > 1 моль; пунктирные линии 4, 3, 2, 1 – нагревание систем с неизменным количеством водорода ao = 0,5834 моль и убывающим от 0,4164 моль до 0 количеством СО не расходуется на восстановление оксида. Однако углерод не является абсолютно инертной фазой – он выступает катализатором образования сажистого углерода. На это расходуются и Н2 и СО, что снижает эффективность восстановления. Это подтверждает мнения исследователей – выделение сажистого углерода тормозит процесс восстановления оксида, однако это не только кинетическая, но и термодинамическая характеристика системы. Если же температура нагрева системы выше 910 К, то S > (ao + co) = 1 моль, табл. 3, так как при этих температурах интегральная характеристика реакций [1– K2K4(1 + K1)] < 0,5834. Это означает, что углерод расходуется в процессе восстановления оксида – повышается эффективность восстановления из-за многократной регенерации H2 и CO. При этом существенно увеличивается количество газовой фазы. В результате такой «восстановительно-газификационной карусели» при T ^ 955 К концентрации H2 и Н2О становятся весьма малыми, а количество FeO, восстановленного до Fe, весьма значительно. Свидетельством реализации такой «восстановительно-газифи-кационной карусели» являются показанные на рис. 9 результаты расчетов количеств продуктов в газовой и твердых фазах, получающихся при изотермических выдержках.
Тот факт, что за исключением одного единственного сочетания С = a o / c o и температуры в процессах восстановления оксидов либо расходуется углерод, либо получается сажистый углерод, исключает возможность оценки восстановительных способностей H2 и СО величиной x H O / x CO [3]. Для количественной оценки соотношения восстановительных способностей Н2 и СО следует использовать величину у = z]x и долю железа, восстановленного водородом aH2 = z /( x + z ), табл. 3 и рис. 5.
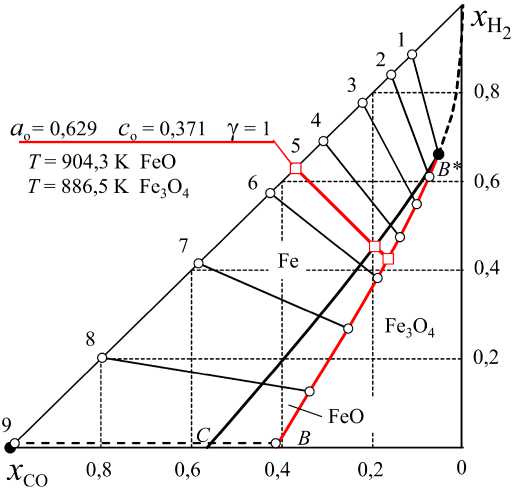
Аналогичные расчеты можно выполнить для восстановления оксида Fe 3 O 4 при нагревании систем Fe 3 O 4 – Н 2 ( a o ) – СО ( c o ) – С. Для этого рассчитываются совместные равновесия реакций (3), (4) и (5). Соотношения между компонентами газовой фазы определяются теми же уравнениям (10)–(14) с заменой констант равновесия K 6 и K 7 на K 4 и K 5 . Количества восстановленного оксида Fe 3 O 4 водородом и оксидом СО определяются величинами z и x , а полученного оксида FeO – величинами 3z и 3 x . Некоторые результаты расчетов приведены на рис. 8 и 10.
Результаты вышеприведенных вычислений позволяют оценить полный и удельный расход углерода на восстановление Fe 3 O 4
Таблица 4
Количество восстановленного железа в отсутствии расхода углерода при переходе исходной системы FeO – Н 2 ( a o ) – СО ( c o ) – С в равновесную FeO – Fe α – Н 2 ( a ) – Н 2 О ( b ) – СО ( c ) – СО 2 ( d ) – С ;
( a + b + c + d ) = ( a o + c o ) = 1 моль , a o = [1 – K 2 K 4 (1 + K 1 )]
|
T , К |
850 |
870 |
890 |
904,3 |
910 |
930 |
940 |
950 |
~ 955 |
|
a o |
0,8868 |
0,8219 |
0,7251 |
0,6290 |
0,5834 |
0,3792 |
0,2468 |
0,0845 |
0,0004 |
|
c o |
0,1132 |
0,1781 |
0,2749 |
0,3710 |
0,4166 |
0,6208 |
0,7532 |
0,9155 |
0,9996 |
|
a o/ c o |
7,8339 |
4,6138 |
2,6380 |
1,6954 |
1,4004 |
0,6109 |
0,3276 |
0,0983 |
0,0004 |
|
y |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
x |
0,0588 |
0,0893 |
0,1331 |
0,1754 |
0,1950 |
0,2811 |
0,3355 |
0,3765 |
0,4023 |
|
z |
0,2255 |
0,2166 |
0,1976 |
0,1754 |
0,1641 |
0,1098 |
0,0728 |
~ 0 |
~ 0 |
|
a |
0,6613 |
0,6053 |
0,5275 |
0,4536 |
0,4193 |
0,2693 |
0,1742 |
0,0628 |
~ 0 |
|
b |
0,2255 |
0,2166 |
0,1976 |
0,1754 |
0,1641 |
0,1099 |
0,0726 |
0,0267 |
~ 0 |
|
c |
0,0545 |
0,0890 |
0,1418 |
0,1956 |
0,2216 |
0,3397 |
0,4179 |
0,5116 |
0,5652 |
|
d |
0,0588 |
0,0893 |
0,1331 |
0,1754 |
0,1950 |
0,2811 |
0,3355 |
0,3989 |
0,4344 |
|
n Fe |
0,2843 |
0,3059 |
0,3307 |
0,3508 |
0,3591 |
0,3909 |
0,4083 |
0,3454 |
0,3284 |
|
γ |
3,8377 |
2,4256 |
1,4845 |
1,000 |
0,8416 |
0,3911 |
0,2163 |
~ 0 |
~ 0 |
|
γ* |
0,4902 |
0,5257 |
0,5627 |
0,5900 |
0,6009 |
0,6403 |
0,6604 |
0,6808 |
0,6911 |
|
a H 2 |
0,7933 |
0,7081 |
0,5974 |
0,5000 |
0,4569 |
0,2811 |
0,1783 |
~ 0 |
~ 0 |
Примечания: a = a o + y – z = x H , b = z – y = x H O , c = c o + y – x = x CO , d = x = x CO , n Fe = x + z ; γ = z / x , γ* = γ/ С , С = a o / c o .
б)
Рис. 8. Концентрации исходных смесей (Н 2 – СО), при которых нагревание оксида не изменяет общее количество газа: а) FeO, координаты точек 1 (850 К)…10 (955 К), см. табл. 1; б) Fe 3 O 4 , координаты точек 1 (850 К) … 9 (917 К)
до FeO и FeO до Fe. Расчет полного расхода углерода y по уравнению (10) может быть проверен на основании очевидного утверждения, что весь газифицированный по двум реакциям (2) и (3) углерод переходит в газовую фазу в виде CO и CO 2 (см. табл. 1, 3, 4):
I nn С = I n^- X co + I n^ x CO 2 = y .
На рис. 9 приведены вычисленные полные расходы углерода для разных систем FeO – Н 2 ( a o ) – СО ( c o ) – С при температурах 850…955 К.
Удельные расходы y* = y L n Fe = y(xx + z ) представлены на рис. 11. Удельные затраты углерода меньше единицы, как это следует
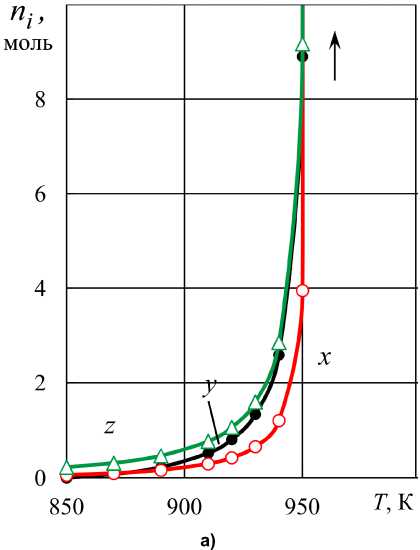
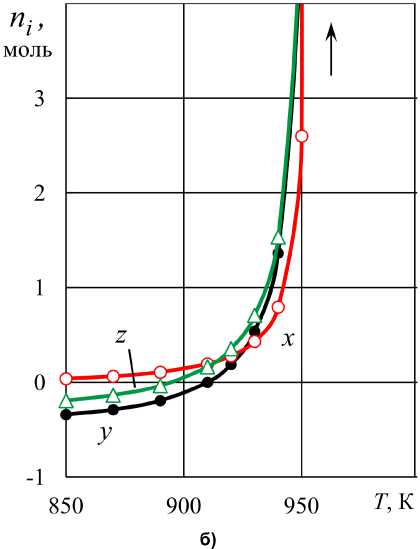
Рис. 9. Количества железа, восстановленного водородом ( z ), монооксидом углерода ( x ) и количества затраченного углерода ( y ) при нагревании исходных систем FeO – Н 2 ( a o ) – СО ( c o ) – С : а) a o = 0,8868, c o = 0,1132 при T → 955 К: y → 2052, x → 892, z → 2052;
б) a o = 0,5834, c o = 0,4166 при T → 955 К: y → 1350, x → 587, z → 1350;
в) a o = 0,3792, c o = 0,6208 при T → 955 К: y → 877, x → 381, z → 877
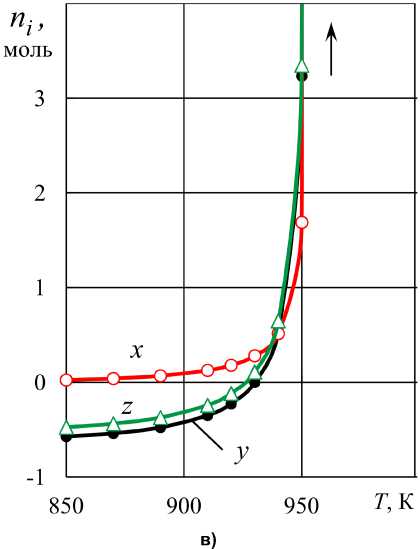
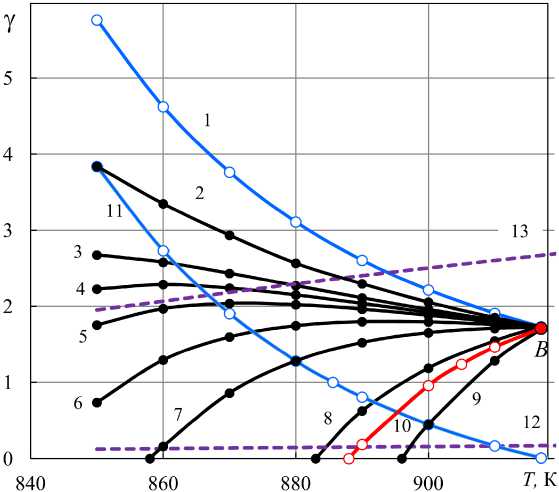
Рис. 10. Соотношение восстановительных способностей Н2 и СО по отношению к Fe3O4 при нагревании различных исходных систем: « Fe3O4 – Н2 ( a o моль) – С» – линия 1, работа [1]; « Fe3O4 – Н2 ( a o моль) – СО ( c o моль) – С» с разными количествами Н 2 и СО : 2 – a o / c o = 0,8868/0,1132, 3 – 0,83/0,17, 4 – 0,81/0,19, 5 – 0,79/0,21, 6 – 0,75/0,25, 7 – 0,6911/0,3089, 8 – 0,55/0,45, 9 – 0,4154/0,5846; « Fe3O4 – Fe – Н2О ( b o моль) – С» – линия 10, не опубликовано; « Fe 3 O 4 – Н 2 ( a o * ) – СО ( c o * ) – С» – линия 11 при отношениях a o * / c o * , обеспечивающих неизменность количества газа; « Fe3O4 – Н2 ( a o моль) –
СО ( c o моль) » , a o / c o = 1/4 и 4/1 – линии 12 и 13, [3]
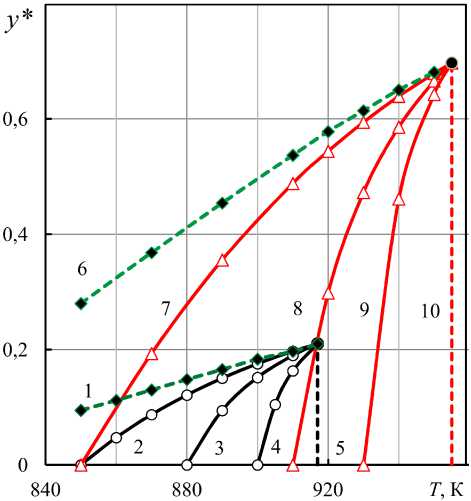
Рис. 11. Удельный расход углерода на восстановление оксидов железа: линия 1 – нагревание системы «Fe 3 O 4 – Н 2 – С», работа [1], 2 – «Fe 3 O 4 – Н 2 (0,8868) – СО (0,1132 моль) – С», 3 – «Fe 3 O 4 – Н 2 (0,6611) – СО (0,3389 моль) – С», 4 – «Fe 3 O 4 – Н 2 (0,4154) – СО (0,5846 моль) – С», 5 – «Fe 3 O 4 – СО – С» работа [4]; линия 6 – нагревание системы «FeO– Н 2 – С», работа [1], 7 – «FeO – Н 2 (0,8868) – СО (0,1132 моль) – С», 8 – «FeO – Н 2 (0,5834) – СО (0,4166 моль) – С», 9 – «FeO – Н 2 (0,37892) – СО (0,6208 моль) – С», 10 – «FeO – СО – С» работа [4]
ожидать из стехиометрии реакций прямого восстановления:
Fe 3 O 4 + C = 3Fe O + CO 2 ;
FeO + C = Fe + CO.
При 917 К удельный расход углерода на восстановление Fe3O4 до FeO составляет не менее 0,21 моль С/моль Fe3O4. При температуре 955 К удельный расход углерода на восстановление FeO до Fe составляет около 0,697 моль С/моль FeO или 0,697 · 12/55,847 = 0,150 г С/г Fe.
Выводы
-
1. Для систем Fe 3 O 4 – Н 2 ( a o ) – СО( c o ) – С и FeO – Н 2 ( a o ) – СО ( c o ) – С существуют такие сочетания температуры T * и С* = ( a o / c o )* (независимо от абсолютных величин a o и c o), при которых после изотермической выдержки в равновесных состояниях сумма чисел молей компонентов образовавшегося водяного газа равна ( a o + c o ). Это означает, что углерод не расходуется на восстановление оксида. При нагревании исходной системы до температур ниже T * происходит выделение сажистого углерода. Это приводит к торможению процессов восстановления, так как и Н 2 и СО расходуются на процессы, обратные реакциям газификации углерода. Следовательно, наблюдаемое в экспериментах отрицательное влияние выделения сажистого углерода на процессы восстановления объясняется не только кинетическими торможениями. При нагревании до температур выше T * существенно повышается интенсивность восстановления, расходуется углерод и имеет место своеобразная «восстановительно-газификацион-ная карусель», приводящая к экспоненциальному возрастанию расхода углерода и количеств продуктов реакций.
-
2. Термодинамическая оценка соотношения восстановительной способности Н2 и СО для оксидов железа в присутствии углерода показала изменение её в пределах от γ = 5,76 до 0 в интервале температур 850…955 К в зависимости от исходного состава смеси (Н 2 – СО). Показано, что величина γ может уменьшаться, увеличиваться или не зависеть от температуры. Это противоречит общепри-
нятому утверждению о равенстве восстановительных способностей H 2 и СО при 1093 К и возрастании восстановительной способности H2 с повышением температуры – информация основана на пересечении кривых наложенных диаграмм фазовых равновесий систем «оксиды – СО – СО 2 » и «оксиды – H 2 – H 2 О».
-
3. В закрытой системе Fe 3 O 4 – Н 2 ( a o ) – СО( c o ) – С полное восстановление Fe 3 O 4 до FeO возможно при температуре ~ 917 К, если в исходной газовой фазе отношения ( a o / c o ) < < 7,83. В закрытой системе FeO – Н 2 ( a o ) – СО( c o ) – С полное восстановление FeO до Fe возможно при температуре ~ 955 К, если в исходной газовой фазе отношения ( a o / c o ) < 7,83. При этом начальное количества водорода и оксида СО могут быть весьма незначительными.
-
4. Удельный расход углерода при восстановлении Fe3O4 до FeO составляет 0,21 моль С/моль Fe3O4, а при восстановлении FeO до Fe составляет 0,697 моль С/моль FeO. Для восстановления Fe3O4 до Fe удельный расход углерода составляет:
0,210 + 3 · 0,697 = 2,3 моль С/3 моль Fe или
-
2, 3 · 12/3 ·55,847 = 0,165 г С/г Fe.
Список литературы Термодинамический анализ восстановления оксидов железа в газовых смесях (CO-H2) в присутствии углерода
- Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа в присутствии углерода/Г.П. Вяткин, Г.Г. Михайлов, Ю.С. Кузнецов и др. -Изв. вузов. Черная металлургия. -2013. -№ 4. -С. 12-17 DOI: 10.3103/S0967091213040153
- Михайлов, Г.Г. Системный анализ процессов восстановления оксидов железа/Г.Г. Михайлов, Ю.С. Кузнецов, О.И. Качурина. -Металлы. -2014. -№ 2. -С. 10-15.
- Гольдштейн Н.Л. Водород в доменном процессе/Н.Л. Гольдштейн. -М.: Металлургия, 1971. -208 с.
- Дигонский, С.В. Роль водорода в восстановлении оксидов металлов твердым углеродом/С.В. Дигонский, В.В. Тен. -Альтернативная энергетика и экология. -2009. -№ 11 (79). -С. 45-55.


