Термодинамический анализ возможности использования расплавов системы BaO-Na2O-Fe2O3 для выращивания кристаллов гексаферрита бария
Автор: Винник Денис Александрович, Трофимов Евгений Алексеевич, Галкина Дарья Павловна, Чернуха Александр Сергеевич, Живулин Владимир Евгеньевич, Стариков Андрей Юрьевич, Резвый Александр Владимирович, Сенин Анатолий Владимирович, Михайлов Геннадий Георгиевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.17, 2017 года.
Бесплатный доступ
Представлены результаты проведенного исследования системы BaO-Na2O-Fe2O3. С учетом экспериментальных данных подобраны и оптимизированы самосогласованные наборы значений термодинамических параметров, позволяющие моделировать реализующиеся в этой системе фазовые равновесия. Сформирована пользовательская база данных, позволяющая проводить расчеты с помощью программного пакета FactSage. С помощью программного пакета FactSage рассчитаны фазовые диаграммы ряда оксидных систем. Результаты расчетов для систем BaO-Fe2O3, Na2O-Fe2O3, BaO-Na2O представлены в виде T-x диаграмм. Для системы BaO-Na2O-Fe2O3 результаты представлены в виде изотермических и политермических разрезов, а также в форме поверхности ликвидуса. Показано, что полученные результаты позволяют рационально подходить к выбору режимов выращивания кристаллов из расплава и, в частности, позволяют определять концентрационные и температурные интервалы, в которых процесс выращивания кристаллов будет наиболее эффективен. Анализ полученных результатов привел к выводу о том, что использование в качестве растворителя оксида натрия позволяет снизить температурный интервал выращивания кристаллов гексаферрита с 1351-1465 °С (в двойной системе) до 1116-1268 °С (на разрезе BaFe12O19-Na2O). Полученные результаты будут востребованы для рационального выбора режимов выращивания кристаллов гексагональных ферритов из оксидного расплава.
Ферриты бария и натрия, термодинамическое моделирование, фазовые диаграммы, кристаллизация оксидных расплавов
Короткий адрес: https://sciup.org/147157100
IDR: 147157100 | УДК: 548.55 | DOI: 10.14529/met170305
Текст научной статьи Термодинамический анализ возможности использования расплавов системы BaO-Na2O-Fe2O3 для выращивания кристаллов гексаферрита бария
Разработка физико-химических параметров, обеспечивающих стабильное образование кристаллов гексаферрита бария (BaFe 12 O 19 ) и твердых растворов на его основе из оксидных систем [1], требует детальной информации о фазовых равновесиях, реализующихся в многокомпонентных системах. Одним из наиболее распространенных оксидов-растворите-лей, используемых для получения кристаллов гексаферрита из оксидного расплава (флюса), является оксид натрия.
Вероятно, первой научной статьей, наиболее полно отражающей результаты роста объемных монокристаллов гексаферрита бария из раствора системы Fe2O3–BaO–Na2O, была публикация [1]. Авторы Р.Дж. Гамбино и Ф. Леонгард провели системное исследование возможности выращивания кристаллов из растворителя на основе Na2O, установили оптимальный комплекс физико-химических параметров, обеспечивающих кристаллообразование фазы гексаферрита, а также максималь- ный размер кристаллов и их массовый выход. В рамках изучения возможности выращивания кристаллов BaFe12O19 из расплава системы Fe2O3–BaO–Na2O был проведен ряд экспериментов. Исходные компоненты (Fe2O3, BaCO3 и Na2CO3) смешивались в сухом виде до однородной консистенции. Полученную смесь помещали в 50 см3 закрытый платиновый тигель, нагревавшийся до температур от 1200 до 1300 °С в печи сопротивления. Как только печь достигла требуемой температуры, расплав медленно охлаждался с контролируемой скоростью 4,5 °C/ч. По достижении температуры тигля 900 °C печь выключалась и самопроизвольно охлаждалась до комнатной температуры. Полученные образцы кристаллов после необходимой подготовки исследовали посредством рентгеноструктурного анализа (метод Дебая–Шерера с использованием излучения Kα Fe). Также авторами этой работы были получены кривые охлаждения. В ходе исследования образцы нагревали до 1250 °С и затем охлаждали до температуры 360 °С в те- чение часа. Температура образца и печи непрерывно регистрировалась. Для обеспечения воспроизводимости результатов исследования для каждого состава были сделаны как минимум по две кривые.
Несмотря на большой срок, прошедший со времени опубликования этой работы, а также интерес других исследователей к использованию Na 2 O в качестве компонента флюса для выращивания кристаллов BaFe 12 O 19 , до настоящего времени в литературе отсутствует полноценная информация о фазовой диаграмме системы BaO–Na 2 O–Fe 2 O 3 .
В рамках настоящей работы была поставлена задача проведения термодинамического анализа системы BaO–Na2O–Fe2O3, моделирования фазовых равновесий, реализующихся в этой системе, что является чрезвычайно важным, поскольку позволит определить концентрационные и температурные интервалы, обеспечивающие кристаллизацию гексаферрита из оксидного расплава.
Используемые методы
В процессе исследования для подбора термодинамических характеристик, оптимизации модельных параметров и расчета фазовых диаграмм использовался программный комплекс FactSage (версия 7.0) [2, 3], произведенный «Thermfact» (Canada) and «GTT Technologies» (Germany), и созданные в процессе исследования базы термодинамических данных, ключевые данные о содержании которых представлены в табл. 1–3. Значения
Таблица 1
Термодинамические характеристики оксида бария
|
BaO (твёрдый) |
Δ H 298 = –548 104 Дж/моль |
S 298 = 72,069 Дж/(моль ⋅ К) |
|
298,150–799,109 К |
C p = 48,8610816 + 0,0088948188 ⋅ T – 379 724,7031/ T 2 * |
|
|
799,109–2286,000 К |
C p = 50,610128561 + 0,006918282002 ⋅ T – 494 977,8498/ T 2 * |
|
|
BaO (жидкий) |
T пл = 2286 К \ |
Δ H пл = 59 000 Дж/моль |
|
298,150–643,773 К |
C p = 47,972692738 + 0,010207731 ⋅ T – 333 748,541/ T 2 * |
|
|
643,773–1600,010 К |
C p = 51,320488471 + 0,006589285554 ⋅ T – 755 792,448/ T 2 * |
|
|
1600,010–5000,000 К |
C p = 66,944 * |
|
* – результат аппроксимации данных, представленных в справочнике [4].
Таблица 2
Термодинамические характеристики двойных оксидов
|
BaFe 2 O 4 (твёрдый) |
Δ H 298 = –1 518 000 Дж/моль * |
S 298 = 123,2 Дж/(моль ⋅ К) * |
|
298,150–2500,000 К |
C p = 138,6 + 0,08742 ⋅ T – 929 857,89/ T 2 [5] |
|
|
BaFe 12 O 19 (твёрдый) |
Δ H 298 = –5 698 000 Дж/моль * |
S 298 = 528,6 Дж/(моль ⋅ К) * |
|
298,150–725,000 К |
C p = 348,6 + 1,16882 ⋅ T [6] |
|
|
725,000–2000,000 К |
C p = 695,79 + 0,1546 ⋅ T [6] |
|
|
Ba 2 Fe 2 O 5 (твёрдый) |
Δ H 298 = –2 109 000 Дж/моль * |
S 298 = 189,2 Дж/(моль ⋅ К) * |
|
298,150–2500,000 К |
C p = 187,1 + 0,09592 ⋅ T – 1 278 526,46/ T 2 [5] |
|
|
Ba 2 Fe 6 O 11 (твёрдый) |
Δ H 298 = –3 891 800 Дж/моль * |
S 298 = 365,7 Дж/(моль ⋅ К) * |
|
298,150–2500,000 К |
C p = 398,94 + 0,1195 ⋅ T – 5 991 000/ T 2 [6] |
|
|
Ba 3 Fe 2 O 6 (твёрдый) |
Δ H 298 = –2 660 300 Дж/моль * |
S 298 = 262,8 Дж/(моль ⋅ К) * |
|
298,150–2500,000 К |
C p = 235,6 + 0,10443 ⋅ T – 1 627 195,02/ T 2 [5] |
|
|
NaFeO 2 (твёрдый 1) |
Δ H 298 = –703 000 Дж/моль * |
S 298 = 88,341 Дж/(моль ⋅ К) [7] |
|
298,150–1620,000 К |
C p = 110,95 + 0,0076933 ⋅ T – 2 552 200/ T 2 [7] |
|
|
1620,000–2000,000 К |
C p = 125,52 ** |
|
|
NaFeO 2 (твёрдый 2) |
T 1 → 2 = 870 К [7] |
Δ H 1 → 2 = 41,84 Дж/моль [7] |
|
298,150–1620,000 К |
C p = 110,95 + 0,0076933 ⋅ T – 2 552 200/ T 2[7] |
|
|
1620,000–2000,000 К |
C p = 125,52 ** |
|
|
NaFeO 2 (твёрдый 3) |
T 2 → 3 = 1270 К [7] |
Δ H 2 → 3 = 2177 Дж/моль [7] |
|
298,150–1620,000 К |
C p = 110,95 + 0,0076933 ⋅ T – 2 552 200/ T 2 [7] |
|
|
1620,000–2000,000 К |
C p = 125,52 ** |
|
Окончание табл. 2
|
NaFeO 2 (жидкий) |
T пл = 1620 К** |
Δ H пл = 49 371 Дж/моль** |
|
298,150–1620,000 К |
C p = 110,95 + 0,0076933 - T - 2 552 200/ T 2 [7] |
|
|
1620,000–2000,000 К |
C p = 125,52 ** |
|
|
Na 3 FeO 3 (твёрдый) |
Δ H 298 = –1 179 334 Дж/моль * |
S 298 = 174,68 Дж/(моль - К) * |
|
298,150–1600,000 К |
C p = 189,26 + 0,024847 - T - 850 712/ T 2 - 9672/ T *** |
|
|
Na 8 Fe 2 O 7 (твёрдый) |
Δ H 298 = –2 834 990 Дж/моль * |
S 298 = 435,7 Дж/(моль - К) * |
|
298,150–1300,000 К |
C p = 456,8311 + 0,066853 - T - 29 015,8/ T *** |
|
|
Na 3 Fe 5 O 9 (твёрдый) |
Δ H 298 = –2 917 510 Дж/моль * |
S 298 = 372,75 Дж/(моль - К) * |
|
298,150–1405,000 К |
C p = 441,846326104 + 0,065797653036 - T - 8 489 155,0276/ T 2 -- 2,11312505784 - 10-5 - T 2 *** |
|
* – результат оптимизации;
** – заимствовано из базы SGPS (SGTE pure substances database, v13.1, 2013);
*** – заимствовано из базы FToxid (FACT oxide compounds, 2015).
Таблица 3
Параметры модели, использованные для описания оксидного расплава
Для описания энергии Гиббса оксидного расплава для всех исследуемых систем использована двухподрешеточная модель ионной жидкости [8, 9]. Компонентами катионной подрешетки считаются положительные ионы (Ba2+, Fe3+, Na+). Анионная подрешетка состоит из ионов O2–. Для описания отклонения раствора компонентов подрешеток от идеальности использовались полиномы Редлиха – Кистера.
В рамках модели жидкость рассматривается как фаза, которая может быть описана общей формулой
(Ba2+, Fe3+, Na+) p (O2–) q , (1) где p и q – числа ионов (катионов и анионов, соответственно), вычисляемые по специальным формулам [8, 9].
Все расчеты выполнены исходя из предположения об общем давлении в системе, равном 1 бар.
Результаты расчетов и их обсуждение
Термодинамическое описание тройной системы потребовало предварительного описания двойных систем BaO–Fe 2 O 3 , Na 2 O–Fe 2 O 3 и BaO–Na 2 O. На рис. 1–3 представлены результаты расчета фазовых диаграмм этих систем.
Анализ фазовой диаграммы системы BaO–Fe 2 O 3 показывает, что для выращивания
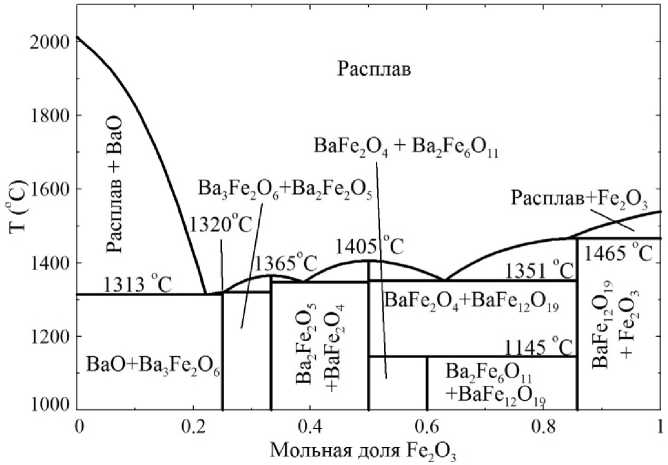
Рис. 1. Фазовая диаграмма системы BaO–Fe 2 O 3
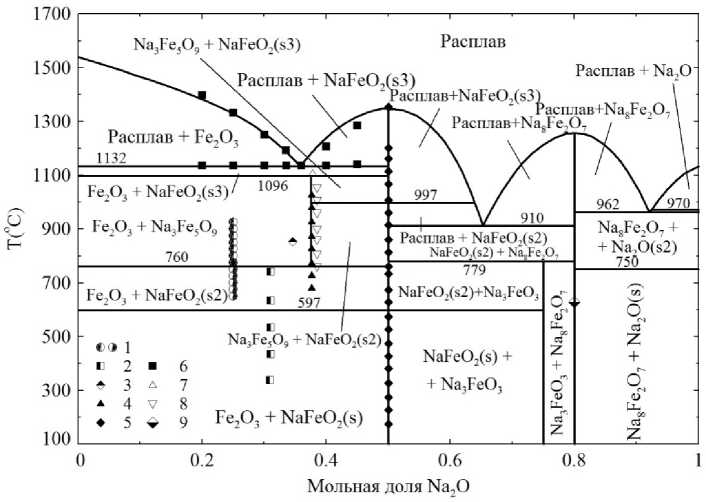
Рис. 2. Фазовая диаграмма системы Fe 2 O 3 –Na 2 O с нанесёнными результатами некоторых экспериментов, описанных в литературе: 1 – [10]; 2 – [11], равновесие Fe 2 O 3 c NaFeO 2 ; 3 – [11], равновесие Fe 2 O 3 c Na 3 Fe 5 O 9 ; 4 – [12]; 5 – [13–18], NaFeO 2 ; 6 – [19]; 7 – [20]; 8 – [12]; 9 – [21]
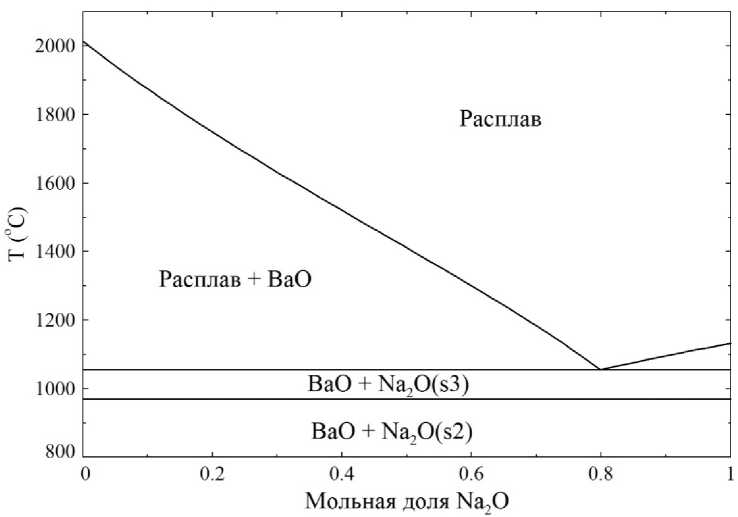
Рис. 3. Фазовая диаграмма системы BaO–Na 2 O
кристаллов гексаферрита бария из расплавов этой системы можно использовать достаточно узкий температурный интервал (1351–1465 °С, согласно диаграмме), который к тому же приходится на область относительно высоких температур.
Результаты, полученные авторами [1] (часть из которых представлена на рис. 4 и 5), позволили оптимизировать параметры, характеризующие взаимодействие трех компонентов в системе BaO–Na 2 O–Fe 2 O 3 (в дополнение к параметрам, характеризующим фазовые равновесия в граничных двойных системах).
Набор полученных параметров позволил осуществить расчет изотермических разрезов фазовой диаграммы этой системы (рис. 6а–в), а также координаты поверхности ликвидуса для этой системы, представленной на рис. 7.
Для удобства анализа на рис. 6в и 7 нанесены линии разреза, соответствующего BaFe 12 O 19 –Na 2 O.
Анализ представленной на рисунках информации позволяет прийти к выводам о том, что использование оксида натрия в качестве растворителя позволяет добиваться заметного снижения температуры процесса (нижняя граница ликвидуса в интересующем нас прежде всего разрезе Na2O–BaFe12O19 смещается до величины 1116 °С) и при этом приводит к заметному расширению интервала температур, при котором гексаферрит бария может находиться в равновесии с оксидным расплавом.
При этом, однако, в область более низких температур смещается и верхняя граница диапазона, в котором может происходить выращивание кристаллов. Кроме того, можно видеть, что увеличение содержания оксида натрия в системе выше некоторого предела (конкретная величина которого зависит от температуры и может быть оценена по поли-термическому разрезу Na 2 O–BaFe 12 O 19 ) приводит к тому, что из расплава перестает выделяться гексаферрит бария и начинают выделяться фазы иной природы (феррит натрия прежде всего). На рис. 8 представлены результаты расчета участка политермического разреза фазовой диаграммы системы BaO– Fe 2 O 3 –Na 2 O на линии BaFe 12 O 19 –Na 2 O в мас. долях. Такая форма представления является более удобной для технолога, определяющего необходимый для выращивания кристаллов BaFe 12 O 19 состав шихты. На рис. 8 нанесены изобары, отражающие равновесное парциальное давление Na 2 O. Видно, что в условиях, при которых может происходить процесс выращивания, парциальное давление оксида натрия (самого летучего из оксидов – компонентов системы) не превышает 10–11 бар. Отсюда можно сделать вывод, что испарение компонентов не должно мешать проведению процесса.
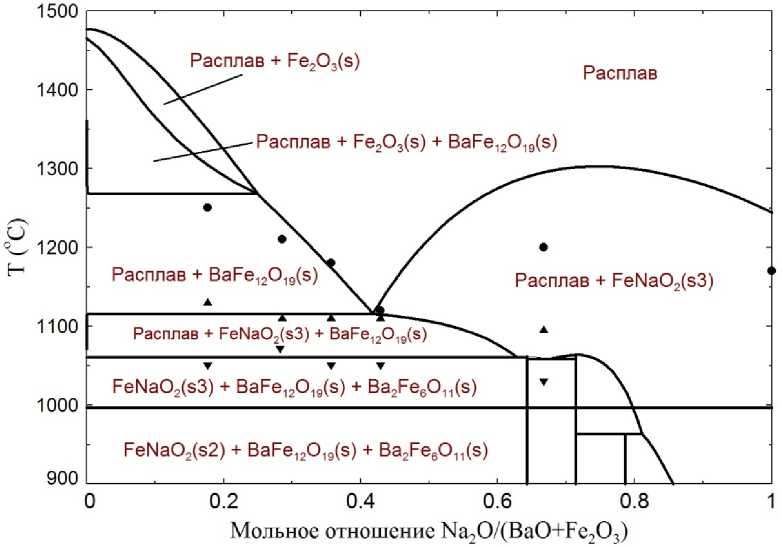
Рис. 4. Политермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O на линии BaFe 12 O 19 –Na 2 O. Экспериментальные данные [1]: • – точки равновесия оксидного расплава с кристаллическими фазами, включая BaFe 12 O 19 ; ▲ – граница пересечения областей фазовых равновесий; ▼ – тройная эвтектика
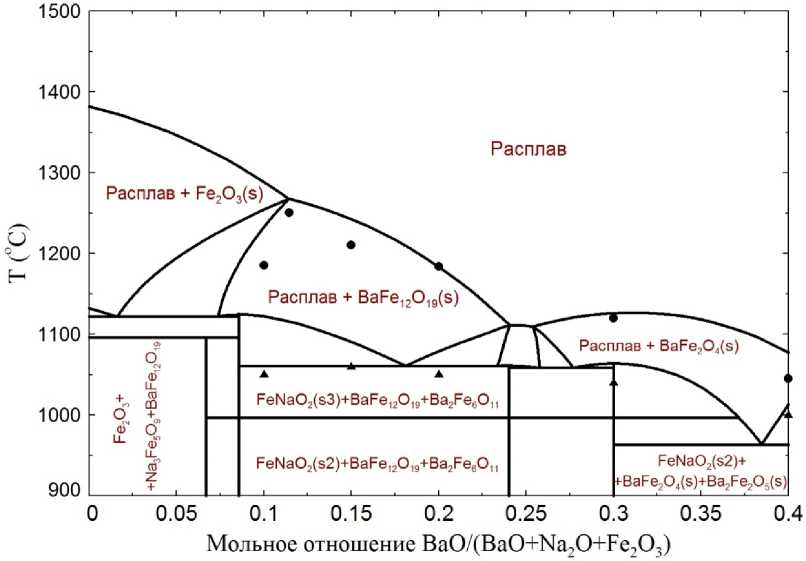
Рис. 5. Политермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O для мольной доли Na 2 O в системе, равной 0,2. Экспериментальные данные [1]: • – точки равновесия оксидного расплава с кристаллическими фазами, включая BaFe 12 O 19 ; ▲ – граница пересечения областей фазовых равновесий; ▼ – тройная эвтектика
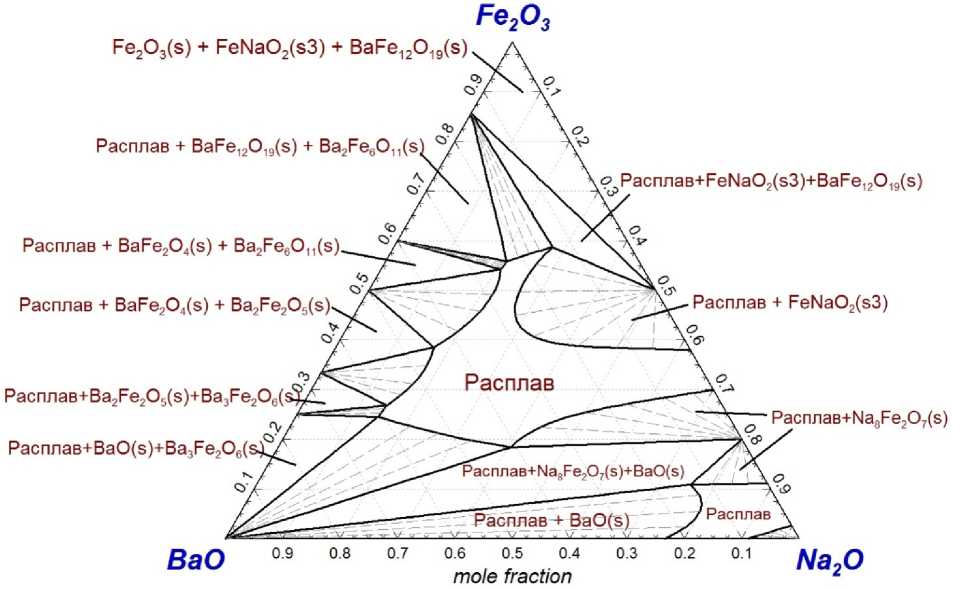
Рис. 6а. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O для Т = 1100 °С
Fe2O3
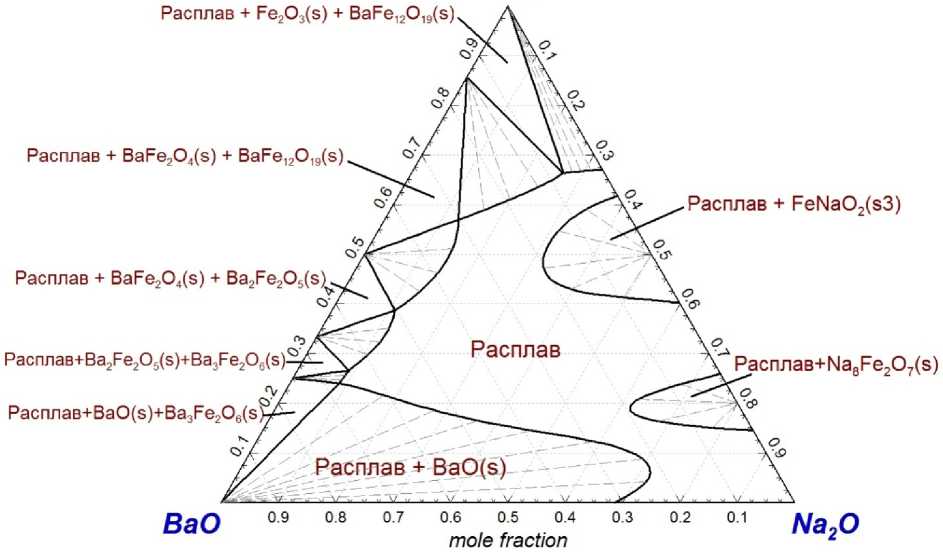
Рис. 6б. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O для Т = 1200 °С
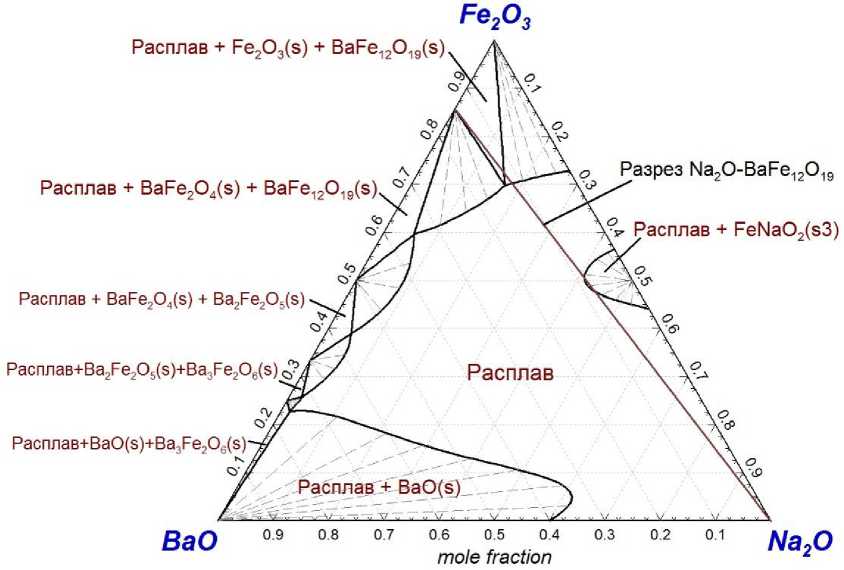
Рис. 6в. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O для Т = 1300 °С
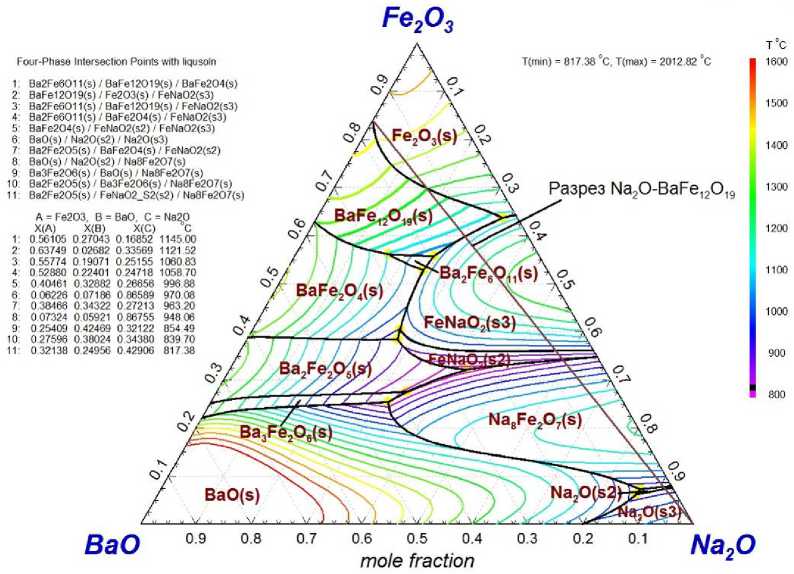
Рис. 7. Поверхность ликвидуса для фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O
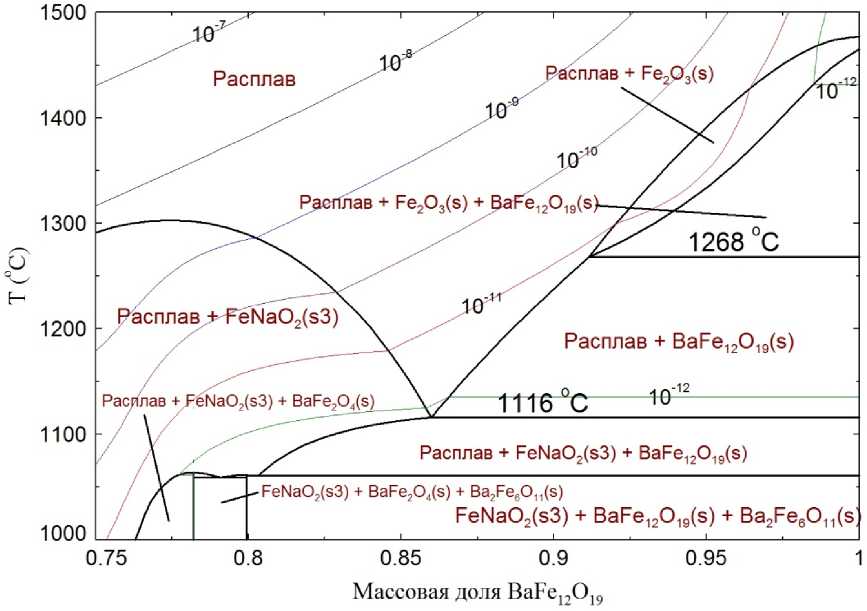
Рис. 8. Политермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –Na 2 O на линии BaFe 12 O 19 –Na 2 O. Нанесены изобары, отражающие выраженное в барах равновесное парциальное давление Na 2 O
Заключение
В результате проведенного исследования проанализирован большой объем литературных данных о фазовых равновесиях, реализующихся в оксидных системах BaO–Fe 2 O 3 , Na 2 O–Fe 2 O 3 и BaO–Na 2 O–Fe 2 O 3 .
Опираясь на экспериментальные данные, подобраны и оптимизированы самосогласованные наборы значений термодинамических параметров, позволяющие моделировать фазовые равновесия, реализующиеся в перечисленных системах. Пополнена пользовательская база данных, позволяющая проводить расчеты с помощью программного пакета FactSage.
С помощью программного пакета FactSage рассчитаны фазовые диаграммы ряда оксид- ных систем. Результаты расчетов для систем BaO–Fe2O3, Na2O–Fe2O3, BaO–Na2O представлены в виде T–x диаграмм. Для системы BaO–Na2O–Fe2O3 результаты представлены в виде изотермических и политермических разрезов, а также в форме поверхности ликвидуса.
Показано, что полученные результаты позволяют рационально подходить к выбору режимов выращивания кристаллов из расплава и, в частности, позволяют определять концентрационные и температурные интервалы, в которых процесс выращивания кристаллов будет наиболее эффективен.
Работа выполнена при финансовой поддержке РФФИ, проект 16-08-01043_а.
Список литературы Термодинамический анализ возможности использования расплавов системы BaO-Na2O-Fe2O3 для выращивания кристаллов гексаферрита бария
- Gambino R.J., Leonhard F. Growth of Barium Ferrite Single Crystals. J. Am. Ceram. Soc., 1961, vol. 44, no. 5, pp. 221-224 DOI: 10.1111/j.1151-2916.1961.tb15364.x
- Bale C.W., Chartrand P., Degterov S.A., Eriksson G., Hack K., Ben Mahfoud R., Melançon J., Pelton A.D., Petersen S. FactSage Thermochemical Software and Databases. Calphad, 2002, vol. 26, no. 2, pp. 189-228 DOI: 10.1016/S0364-5916(02)00035-4
- Bale C.W., Bélisle E., Chartrand P., Decterov S.A., Eriksson G., Hack K., Jung I.-H., Kang Y.-B., Melançon J., Pelton A.D., Robelin C., Petersen S. FactSage Thermochemical Software and Databases -Recent Developments, Calphad, 2009, vol. 33, no. 2, pp. 295-311 DOI: 10.1016/j.calphad.2008.09.009
- Chase M.W. NIST-JANAF Thermochemical Tables (4th ed). Washington, D.C. American Chemical Society, 1998. 1962 p.
- Rakshit S.K., Parida, S.C., Smruti Dash, Ziley Singh, B.K. Sen, V. Venugopal. Heat Capacities of Some Ternary Oxides in the System Ba-Fe-O Using Differential Scanning Calorimetry. Journal of Alloys and Compounds, 2007, vol. 438, pp. 279-284 DOI: 10.1016/j.jallcom.2006.08.026
- Шабанова Г.Н., Быканов С.Н., Гуренко И.В., Ткачева З.И. Термодинамическая оценка образования ферритов бария. Сборник научных трудов ХГПУ «Информационные технологии: наука, техника, технология, образование, здоровье». Харьков: ХГПУ, 1998. Т.6, № 3. С. 35-40.
- Moosavi-Khoonsari E., Jung I.-H. Critical Evaluation and Thermodynamic Optimization of the Na2O-FeO-Fe2O3 System. Metallurgical and Materials Transactions B, 2016, vol. 47, no. 1, pp. 576-594 DOI: 10.1007/s11663-015-0517-5
- Hillert M., Jansson B., Sundman B., Agren J. A Two-Sublattice Model for Molten Solutions with Different Tendency for Ionization. Met. Trans. A, 1985, vol. 16A, no. 2, pp. 261-266 DOI: 10.1007/BF02815307
- Sundman B. Modification of the Two-sublattice Model for Liquids. Calphad, 1991, vol. 15, pp. 109-120 DOI: 10.1016/0364-5916(91)90010-H
- Kale G.M., Srikanth S. Electrochemical Determination of the Gibbs Energy of Formation of Na2Fe2O4 and Na3Fe5O9 Employing Na-β-Al2O3 Solid Electrolyte. J. Am. Ceram. Soc., 2000, vol. 83, no. 1, pp. 175-80 DOI: 10.1111/j.1151-2916.2000.tb01167.x
- Zhang L., Fray D.J., Dekeyser J.C., De Schutter F. Reference Electrode of Simple Galvanic Cells for Developing Sodium Sensors for Use in Molten Aluminum. Metall. Mater. Trans. B, 1996, vol. 27, no. 5, pp. 794-800 DOI: 10.1007/BF02915609
- Yamaguchi S., Kaneko Y., Iguchi Y. Activity Measurements of Na2O in Na2O-Fe2O3 System by EMF Method Using Sodium Beta Alumina as a Solid Electrolyte. Trans. Jpn. Inst Metal, 1987, vol. 28, no. 12, pp. 986-93 DOI: 10.2320/matertrans1960.28.986
- Thery J. Alkali Metal Ferrates and their Hydrolysis Products. Ann. Chim. (Paris), 1962, vol. 7, pp. 207-38.
- Christensen A.U., Conway K.C., Kelley K.K. High-temperature Heat Contents and Entropies of Aluminates and Ferrites of Lithium and Sodium, and of Lithium Titanate. Bur. Mines Rep. Invest, 1960, vol. 5565, pp. 1-8.
- Koehler M.F., Barany R., Kelley K.K. Heats and Free Energies of Formation of Ferrites and Aluminates of Calcium, Magnesium, Sodium, and Lithium. Bur. Mines Rep. Invest, 1961, vol. 5711, pp. 1-14.
- King E.G. Heat Capacities at Low Temperatures and Entropies at 298.16°K. of Aluminates and Ferrites of Lithium and Sodium. J. Am. Chem. Soc. 1955, vol. 77, pp. 3189-90 DOI: 10.1021/ja01617a007
- Wu P.C.-S. Reaction of Fe-Ni-Cr Alloys with Oxygen-containing Sodium, Ph.D. dissertation, Iowa State University, Iowa, 1972, pp. 42-76.
- Shaiu B.-J. Thermodynamic Properties of Compounds of Na2O with the Oxides of Chromium, Nickel, and Iron, Ph.D. dissertation, Iowa State University, Iowa, 1976, pp. 34-55.
- Knick R., Kohlmeyer E.J. Fusion Properties of Mixtures of Na2CO3 and Fe2O3. Z. anorg. u. allgem. Chem., 1940, vol. 244, no 1, pp. 67-84.
- Romers C., Rooymans C.J., De Graaf R.G.D. The Preparation, Crystal Structure and Magnetic Properties of Na3Fe5O9. Acta Crystallogr., 1967, vol. 22, pp. 766-71 DOI: 10.1107/S0365110X67001537
- Stuve J.M., Pankratz L.B., Richardson D.W. Thermodynamic Properties of (Na2O4)•Fe2O3, 6 to 1,200 °K. Bur, Mines Rep. Invest., 1971, vol. 7535, pp. 1-11.


