Термодинамический анализ взаимодействия FeO и FeCr2O4 с газообразными углеродсодержащими восстановителями
Автор: Сенин Анатолий Владимирович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 1 т.13, 2013 года.
Бесплатный доступ
Рассчитаны термодинамические характеристики реакций и равновесные составы газовой фазы при восстановлении оксидов FeO и FeCr 2O 4 углерод- и водородсодержащими газообразными восстановителями СН 4, СН 3, СН 2, СН, С 2Н, С 2Н 2, С 2Н 3, С 2Н 4, С 2Н 6, С 3Н, Н 2, Н, СО, С 3О 2, С 2О. Установлено, что углерод- и водородсодержащие радикалы обладают повышенной восстановительной способностью по сравнению с молекулярными СО и Н 2.
Термодинамическое моделирование, газообразные восстановители, восстановление твердых оксидов, углеводородные радикалы
Короткий адрес: https://sciup.org/147156780
IDR: 147156780 | УДК: 669.014
Текст научной статьи Термодинамический анализ взаимодействия FeO и FeCr2O4 с газообразными углеродсодержащими восстановителями
При рассмотрении вопроса о твердофазном восстановлении оксидов металлов газообразными веществами традиционно считается, что основными восстановителями являются монооксид углерода СО и молекулярный водород Н 2 . В то же время в работе [1] методом термодинамического анализа показано, что по отношению к термодинамически прочным оксидам, таким как Cr 2 O 3 , FeCr 2 O 4 , MgCr 2 O 4 , входящим в состав хромовых руд, при температурах твердофазного восстановления газы СО и Н2 не могут обеспечить наблюдаемых на практике степеней восстановления. Было высказано предположение, что восстановление идет по более сложному механизму с участием газообразных неустойчивых частиц и радикалов, которые, с одной стороны, являются переносчиками атомов углерода к поверхности частиц оксида, с другой – сами являются активными восстановителями. Неотъемлемой частью схемы является положение о цепном, эстафетном, многократно повторяющемся чередовании актов образования-распада неустойчивых частиц, за счет чего реализуется транспорт восстановителя к поверхности частиц твердого оксида. Известно [2], что при реализации механизма транспортных химических реакций даже ничтожные равновесные количества транспортирующего агента переносят огромное количество основного вещества, в нашем случае это атомы углерода и водорода.
В настоящей работе выполнена термодинамическая оценка восстановительной способности некоторых газообразных веществ по отношению к хромиту железа FeCr2O4 в сравнении с восстановлением FeO. Оценена восстановительная способность Н 2 , Н, СН 4 , СН 3 , СН 2 , СН, С 2 Н, С 2 Н 2 , С 2 Н 3 , С 2 Н 4 , С 2 Н 6 , С 3 Н, СО, С 3 О 2 , С 2 О.
В качестве параметра для сравнения восстановительной способности газообразного вещества по отношению к оксидам металлов выбрано равновесное парциальное давление восстановителя в системе, когда оксид металла находится в равновесии со своим металлом. В многокомпонентной системе равновесие обычно описывается набором независимых уравнений химических реакций между всеми веществами, составляющими систему. В соответствии с фундаментальным принципом термодинамики если система находится в равновесии, то равновесной будет и любая из реакций, описывающих взаимодействие между веществами в системе. На основании этого положения была выбрана единая схема записи уравнений реакций восстановления, например, для восстановления углеводородными частицами:
FeO + x V = Fe + n CO + m H2; (1)
FeCr2O 4 + x V = Fe + 2Cr + n CO + m H2, (2)
где V – обобщенный символ вещества-восстановителя; x , n и m – стехиометрические коэффициенты.
Следует помнить, что выбранный метод описания восстановления оксидов одним уравнением реакции не отражает в полной мере все разнообразие химических взаимодействий в системе. Однако цель работы – сравнить химическую активность газообразных восстановителей в идентичных условиях, поэтому однотипная форма записи уравнений реакций, в которой меняется только вещество-восстановитель, на наш взгляд, подходит для поставленной цели.
Термодинамические характеристики реакций восстановления с участием неустойчивых частиц были определены в настоящей работе. Для получения согласованных между собой данных была использована первичная информация о термохимических характеристиках индивидуальных веществ [3]. Энергию Гиббса индивидуальных веществ рассчитывали по формуле
( )
GT =-T Ф T =-T I ST - -T- 1 =
= ( HT + a fH298 )- TST, где Т - температура; ФT - приведенная энергия Гиббса; ST - изменение энтропии; IT - полная энтальпия вещества; HT - «физическая» составляющая энтальпии, изменение энтальпии при увеличении температуры и фазовых переходах; А fH298 - «химическая» составляющая энтальпии, стандартная теплота образования. Затем, в соответствии с уравнением химической реакции восстановления, по разнице энергий Гиббса продуктов реакции и исходных веществ рассчитывали изменение энергии Гиббса для соответствующей реакции.
В качестве примера в табл. 1 приведены данные для реакции образования метана. Получены следующие температурные зависимости для энергии Гиббса и константы равновесия реакции:
А fG°T = (-86890 ± 920) +
+ (107,32 ± 0,71) Т , Дж/моль;
lg K P = (4432 ± 44)/ T + (–5,506 ± 0,054).
Результаты согласуются с известными литературными данными.
Результаты расчетов для реакций образования сложных веществ приведены в табл. 2. Для расчета характеристик реакции образования FeO в различных температурных интервалах применена следующая методика. По исходным данным о свойствах индивидуальных веществ рассчитаны характеристики реакции образования FeO в интервале 1809–3000 К. Затем, с понижением температуры, к данным этой реакции последовательно добавляли
Таблица 1
Термодинамические характеристики веществ и реакции C (гр) + 2H 2 (газ) = CH 4 (газ) (энергетические характеристики приведены в Дж/моль)
|
T , К |
CH 4(газ) |
C (гр) |
H 2(газ) |
А f G T |
lg K P |
1/ T |
|||
|
S ° – I °/ T |
G ° |
S ° – I °/ T |
G ° |
S ° – I °/ T |
G ° |
||||
|
400 |
374,2 |
–149680 |
6,1215 |
–2448,6 |
131,72 |
–52688 |
–41855 |
5,4659 |
0,0025 |
|
600 |
318,47 |
–191082 |
7,9793 |
–4787,58 |
136,28 |
–81768 |
–22758 |
1,9814 |
0,0017 |
|
800 |
295,03 |
–236024 |
10,29 |
–8232 |
141,05 |
–112840 |
–2112 |
0,1379 |
0,0013 |
|
1000 |
284,16 |
–284160 |
12,662 |
–12662 |
145,42 |
–145420 |
19342 |
–1,0104 |
0,0010 |
|
1200 |
279,37 |
–335244 |
14,968 |
–17961,6 |
149,34 |
–179208 |
41134 |
–1,7906 |
0,0008 |
|
1400 |
277,9 |
–389060 |
17,163 |
–24028,2 |
152,89 |
–214046 |
63060 |
–2,3529 |
0,0007 |
|
1600 |
278,36 |
–445376 |
19,234 |
–30774,4 |
156,12 |
–249792 |
84982 |
–2,7745 |
0,0006 |
|
1800 |
280,02 |
–504036 |
21,179 |
–38122,2 |
159,09 |
–286362 |
106810 |
–3,0997 |
0,0006 |
|
2000 |
282,44 |
–564880 |
23,008 |
–46016 |
161,83 |
–323660 |
128456 |
–3,3550 |
0,0005 |
Таблица 2
Термодинамические характеристики реакций образования веществ в интервале температур 298 – 2000 К
Далее методом комбинирования уравнений химических реакций рассчитывали значения констант равновесия реакций восстановления оксидов конкретным газообразным восстановителем. Равновесные составы газовой фазы определяли на основе правила фаз Гиббса из совместного решения уравнений закона действующих масс и нормировки состава газовой фазы на общее давление 1 атм. Как показали расчеты, равновесное давление углеводородов практически не зависит от соотношения количеств СО и Н2 в газообразных продуктах, поэтому на иллюстрациях приведены результаты для одного из значений р(Н2) = 0,6 атм. Результаты расчетов приведены на рис. 1–3 в виде температурной зависимости логарифма равновесного пар-
а)
б)
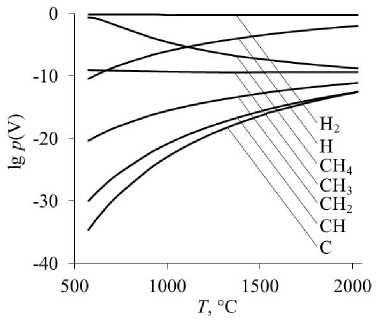
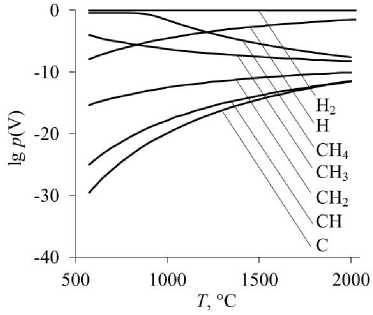
Рис. 1. Равновесные парциальные давления газообразных Н 2 , Н, СН 4 , СН 3 , СН 2 , СН, С при восстановлении оксидов: а – восстановление FeO; б – восстановление FeCr 2 O 4
б)
а)
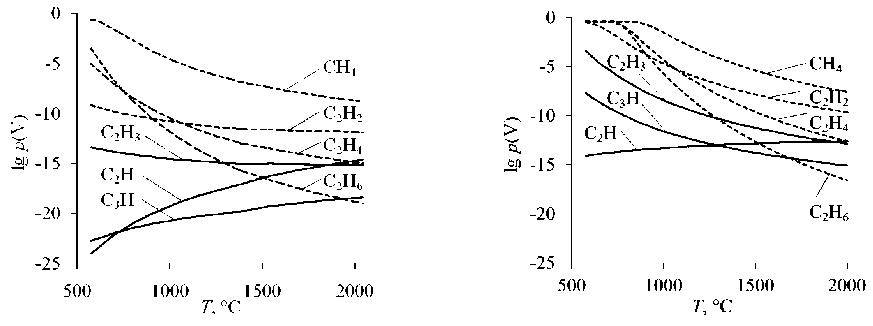
Рис. 2. Равновесные парциальные давления газообразных СН 4 , С 2 Н, С 2 Н 2 , С 2 Н 3 , С 2 Н 4 , С 2 Н 6 , С 3 Н при восстановлении оксидов: а – восстановление FeO; б – восстановление FeCr 2 O 4
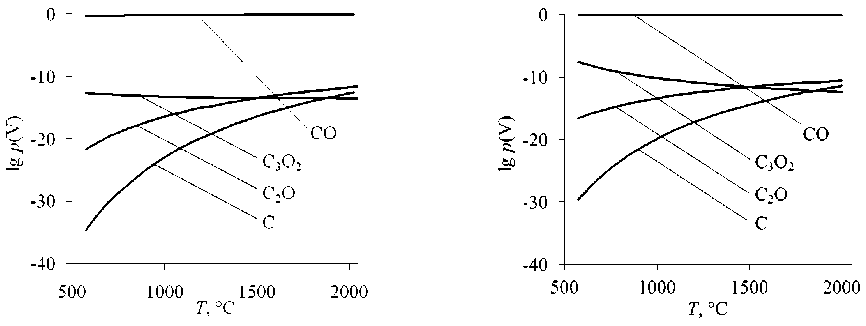
б)
а)
Рис. 3. Равновесные парциальные давления газообразных СО, С 3 О 2 , С 2 О, С при восстановлении оксидов: а – восстановление FeO; б – восстановление FeCr 2 O 4
циального давления (атм) восстановителя в системе, когда оксид металла находится в равновесии со своим металлом в соответствии со схемами (1) и (2) уравнений реакций восстановления.
Самыми слабыми восстановителями в изученных условиях являются молекулярный водород Н2 и монооксид углерода СО.
По мере уменьшения количества атомов водорода в молекуле углеводорода восстановительная способность газообразных частиц увеличивается (см. рис. 1). Самым сильным восстановителем является атомарный углерод, достаточно его следовых концентраций в газовой фазе на уровне 10–20–10–15 атм, чтобы началось восстановление. Следует отметить, что именно атомарная форма углерода обеспечивает его высокую восстановительную способность по сравнению с атомами углерода, входящими в кристаллическую решетку твердого графита. Атомарный водород также обладает более высокой восстановительной способностью, чем молекулярный.
Среди углеводородов, содержащих несколько атомов углерода, восстановительная способность возрастает от непредельных углеводородов к предельным: С2Н2 → С2Н4 → С2Н6 (см. рис. 2). Частицы-радикалы С 2 Н, С 2 Н 3 , С 3 Н проявляют повышенную восстановительную способность.
Производные от оксида углерода радикалы С 3 О 2 , С 2 О также обладают повышенной восстановительной способностью – на уровне углеводородных радикалов.
Равновесные концентрации восстановителей коррелируют с термодинамической прочностью оксидов – восстановление железа из FeO требует меньших концентраций по сравнению с восстановлением железа и хрома из термодинамически более прочного соединения FeCr 2 O 4 .
Таким образом, в настоящей работе с термодинамической точки зрения показана высокая восстановительная способность углеродсодержащих молекул и радикалов по отношению к термодинамически прочным оксидам. Остается открытым вопрос о роли и механизме участия частиц-радикалов в процессах восстановления твердых оксидов. В настоящее время считается доказанным, что все реакции в газовой фазе идут через образование промежуточных неустойчивых частиц и радикалов [4]. Взаимодействие газовой фазы с твердой поверхностью реализуется по аналогичному механизму. Например, газовая цементация стальных деталей идет через последовательное образование радикалов метана с образованием на последней стадии атомарного углерода, который и диффундирует с поверхности твердой фазы в ее объем [5]. Существует большое количество экспериментальных данных об интенсифицирующей роли водорода [6], углеводородов и низкотемпературной углеводородной плазмы в процессах восстановления (более подробно обсуждено ранее в работах [1, 7]), причем эффект наблюдается только в присутствии твердого углерода, когда создаются условия для его газификации водородсодержащими газами, восстановление чистым водородом таких результатов не дает.
Выводы
Рассчитаны термодинамические характеристики реакций образования углерод- и водородсодержащих газообразных восстановителей СН 4 , СН 3 , СН 2 , СН, С 2 Н, С 2 Н 2 , С 2 Н 3 , С 2 Н 4 , С 2 Н 6 , С 3 Н, Н 2 , Н, СО, С 3 О 2 , С 2 О.
Рассчитаны зависимости равновесного парциального давления восстановителя от температуры при равновесии оксида металла со своим металлом (оксиды FeO и FeCr2O4).
Установлено, что углерод- и водородсодержащие радикалы обладают повышенной восстановительной способностью по сравнению с молекулярными СО и Н 2 – в газовой фазе достаточно иметь следовые концентрации частиц-радикалов на уровне 10–20–10–10 атм для начала восстановления металлов из оксидов.
Список литературы Термодинамический анализ взаимодействия FeO и FeCr2O4 с газообразными углеродсодержащими восстановителями
- Теоретические основы процессов производства углеродистого феррохрома из уральских руд/B.П. Чернобровин, И.Ю. Пашкеев, Г.Г. Михайлов и др. -Челябинск: Изд-во ЮУрГУ, 2004. -346 с.
- Шефер, Г. Химические транспортные реакции/Г. Шефер. -М.: Мир, 1964. -192 с.
- Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных ACTPA.OWN)/Г.К. Моисеев, Н.А. Ватолин, Л.А. Маршук, Н.И. Ильиных. -Екатеринбург: УрО РАН, 1997. -230 с.
- Химия горения/под ред. У. Гардинера, мл. -М.: Мир, 1988. -464 с.
- Гебхардт, Е. Газы и углерод в металлах/Е. Гебхардт, Е. Фромм. -М.: Металлургия, 1980. -712 с.
- Дигонский, С.В. Роль водорода в восстановлении оксидов металлов твердым углеродом/C.В. Дигонский, В.В. Тен//Альтернативная энергетика и экология. -2009. -№ 11 (79). -С. 45-55.
- Сенин, А.В. Твердофазное восстановление хромовой руды метаном/А.В. Сенин//Электрометаллургия. -2013. -№ 1. -С. 31-37.


