Термодинамический анализ взаимодействия хрома с кислородом в жидком железе
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.19, 2019 года.
Бесплатный доступ
Изучение возможности взаимодействия хрома с кислородом при производстве хромсодержащих сталей является одной из практически значимых задач для сталеплавильного производства. В настоящей работе проведено термодинамическое моделирование фазовых равновесий в системе Fe-Cr-O в условиях существования расплава на основе железа (в интервале температур 1600-1800 °С). Термодинамический анализ был выполнен с использованием методики построения поверхности растворимости компонентов в металле, которая представляет собой диаграмму, связывающую изменения в составах жидкого металла с изменениями в составах образующихся продуктов взаимодействия. Для моделирования использовались данные по константам равновесия протекающих в расплаве реакций, а также значения параметров взаимодействия первого порядка (по Вагнеру) компонентов в жидком железе. В ходе работы было установлено, что в интервале температур 1600-1800 °С в качестве продуктов взаимодействия могут образоваться: жидкие оксидные неметаллические включения переменного состава (FeO, CrO, Cr2O3); твердые частицы феррохромита FeCr2O4; чистый твердый оксид хрома Cr2O3; твердые частицы соединения Cr3O4. Также были определены границы термодинамической стабильности данных оксидных фаз, образующихся в расплаве системы Fe-Cr-O. По результатам расчета проведена оценка раскислительной способности хрома в кислородсодержащем расплаве на основе железа. Определено, что максимум раскислительной способности хрома при 1600 °С приходится на область равновесия жидкого металла с твердым оксидом хрома Cr2O3, при этом минимальная концентрация кислорода составляет 0,0204 мас. % для 5,31 мас. % хрома. Полученные в ходе настоящего расчета результаты сопоставлены с имеющимися литературными данными.
Система fe-cr-o, термодинамическое моделирование, фазовые равновесия
Короткий адрес: https://sciup.org/147233925
IDR: 147233925 | УДК: 669.017.3 | DOI: 10.14529/met190301
Текст научной статьи Термодинамический анализ взаимодействия хрома с кислородом в жидком железе
Изучение возможности взаимодействия хрома с кислородом при производстве хромсодержащих сталей является одной из практически значимых задач для сталеплавильного производства. Расход хрома на взаимодействие с кислородом влечет за собой как образование оксидных неметаллических хромсодержащих включений, так и понижение концентрации хрома в твердом растворе системы Fe–Cr и, соответственно, понижение качества получаемого металла.
Целью настоящей работы являлось проведение термодинамического анализа процессов взаимодействия в системе Fe–Cr–O в интервале температур 1600–1800 °С.
Термодинамический анализ в данной работе был выполнен с использованием методики построения поверхности растворимости компонентов в металле (ПРКМ) [1, 2], которая позволяет связать изменения в составе металлического расплава с изменениями в составе образующихся продуктов взаимодействия и определить области термодинамической стабильности оксидных фаз, находящихся в равновесии с металлическим кислородсодержащим расплавом. Также данная методика позволяет рассчитывать кривые раскислитель-ной способности элементов в выбранном интервале температур в условиях существования жидкого железа.
Для определения оксидных фаз, которые могут образоваться при взаимодействии в системе Fe–Cr–O, необходимо рассмотреть как простые двойные Fe–O и Cr–O системы, так и оксидную систему FeO–CrO–Cr 2 O 3 .
При анализе сталеплавильных процессов для кислородсодержащего жидкого железа принимается во внимание в основном возможность образования монооксида железа (вюсти-та) FeO [1, 3], температура плавления которого составляет 1378 °С [4]. В системе Cr–O возможно образование оксидов Cr2O3 и CrO, а также соединения Cr3O4 [5]. Температура плавления оксида Cr2O3 составляет 2300 °С [6]. Существование оксида CrO в виде отдельной конденсированной фазы принято только гипотетически в условиях равновесия с металлическим хромом; присутствие иона Cr2+ в литературе рассматривается только либо в составе соединений (например, силикатов), либо в составе оксидных хромсодержащих расплавов
[5, 7–9]. Литературные данные по температуре плавления соединения Cr3O4 различаются между собой. Так, согласно работе [5] температура плавления Cr 3 O 4 составляет 1705 °С. В справочнике [7] указано, что соединение Cr 3 O 4 плавится инконгруэнтно при температуре порядка 2100 °С. А в диссертации [10] равновесие жидкого железа с Cr 3 O 4 рассматривается вплоть до температуры 1900 °С.
В оксидной системе FeO–CrO–Cr 2 O 3 помимо наличия соединения Cr 3 O 4 также имеется соединение FeCr 2 O 4 с температурой плавления порядка 2100 °С [11].
Таким образом, в интервале температур 1600–1800 °С в качестве продуктов взаимо-
Таблица 1
Температурные зависимости констант равновесия химических реакций*, протекающих в расплаве системы Fe–Cr–O
|
lg K |
Значение lg K при 1600 °С (1873 К) |
Источник |
|
(FeO) = [Fe] + [O] |
||
|
–6320/ T + 4,734 \ |
+1,360 \ |
[1] |
|
(CrO) = [Cr] + [O] |
||
|
–8200/ T + 4,510 |
+0,132 |
[12] |
|
–12516/ T + 6,495 |
–0,187 |
[настоящая работа] |
|
(Cr 2 O 3 ) = 2[Cr] + 3[O] |
||
|
–33460/ T + 14,850 |
–3,014 |
[12] |
|
–55600/ T + 26,010 |
–3,675 |
[13] |
|
–36332/ T + 15,675 |
–3,723 |
[настоящая работа] |
|
|FeCr 2 O 4 | = [Fe] + 2[Cr] + 4[O] |
||
|
–51870/ T + 24,480 |
–3,214 |
[12] |
|
–51806/ T + 21,832 |
–5,827 |
[14] |
|
–53420/ T + 22,920 |
–5,601 |
[15] |
|
–45796/ T + 18,830 |
–5,621 |
[16] |
|
–50755/ T + 21,660 |
–5,438 |
[17] |
|
–50873/ T + 22,744 |
–4,417 |
[настоящая работа] |
|
|Cr 2 O 3 | = 2[Cr] + 3[O] |
||
|
–40010/ T + 17,370 |
–3,992 |
[12] |
|
–43140/ T + 18,634 |
–4,399 |
[14] |
|
–44040/ T + 19,420 |
–4,093 |
[15] |
|
–45531/ T + 20,250 |
–4,059 |
[16] |
|
–36200/ T + 16,100 |
–3,227 |
[18] |
|
–41800/ T + 17,800 |
–4,517 |
[настоящая работа] |
|
|Cr 3 O 4 | = 3[Cr] + 4[O] |
||
|
–53350/ T + 23,510 |
–4,974 |
[12] |
|
–48850/ T + 21,430 |
–4,651 |
[16] |
|
–53510/ T + 23,960 |
–4,609 |
[17] |
|
–53521/ T + 23,960 |
–4,615 |
[19] |
|
–56170/ T + 24,300 |
–5,689 |
[настоящая работа] |
* В уравнениях реакций в квадратных скобках приведены компоненты металлического расплава, в круглых – оксидного расплава, в прямых скобках – твердые вещества.
действия могут образоваться: жидкие оксидные неметаллические включения переменного состава (FeO, CrO, Cr 2 O 3 ); частицы ферро-хромита FeCr2O4; чистый твердый оксид хрома Cr 2 O 3 ; частицы соединения Cr 3 O 4 .
Непосредственно расчет ПРКМ основан на законе действующих масс, связывающем константы равновесия высокотемпературных химических реакций с активностями компонентов металлического и оксидного расплавов, а также конденсированных фаз.
Для расчета координат ПРКМ необходимы сведения о температурных зависимостях констант равновесия реакций, протекающих в металлическом расплаве исследуемой системы. В табл. 1 приведены данные по константам равновесия из разных литературных источников в сравнении как между собой, так и с используемыми в ходе настоящей работы значениями.
Расчет активностей оксидного расплава для системы FeO–Cr 2 O 3 проводили с использованием приближения теории субрегулярных ионных растворов [1], энергетические параметры которой оказались равными [20]:
Q 1112 = 0 Дж/моль;
Q 1122 = +12115 Дж/моль;
Q 1222 = –60565 Дж/моль.
Моделирование оксидного расплава систем FeO–CrO, CrO–Cr 2 O 3 , FeO–CrO–Cr 2 O 3 проводили с использованием теории совершенных ионных растворов [1].
Активности металлического расплава рассчитывались с использованием параметров взаимодействия первого порядка по Вагнеру (табл. 2).
Активности чистых твердых веществ (в данном случае оксида Cr 2 O 3 , а также соединений FeCr 2 O 4 и Cr 3 O 4 ) принимались равными единице.
Результаты расчета ПРКМ системы Fe–Cr–O представлены на рис. 1. В области I приведены составы жидкого металла, находящегося в равновесии с оксидным расплавом переменного состава (FeO, CrO, Cr 2 O 3 ); в области II – c твердыми частицами соединения FeCr 2 O 4 ; в области III – с твердыми частицами оксида хрома Cr 2 O 3 ; в области IV – с твердыми частицами соединения Cr 3 O 4 . Также на рис. 1 приведены границы стабильности фаз: линия a – b определяет трехфазное равновесие «жидкий металл – оксидный расплав – FeCr2O4»; линия c – d – «жидкий металл – FeCr 2 O 4 – Cr 2 O 3 »; линия e – f – «жидкий металл – Cr 2 O 3 – Cr 3 O 4 ». Максимум раскислительной способности хрома приходится на область III, соответст-
Таблица 2
Параметры взаимодействия первого порядка в жидком железе e i j (1600 °С)
|
j i |
O |
Cr |
|
O |
–0,2 [21] |
–0,055 [15] |
|
Cr |
–0,179 [настоящая работа] |
–0,0003 [22] |
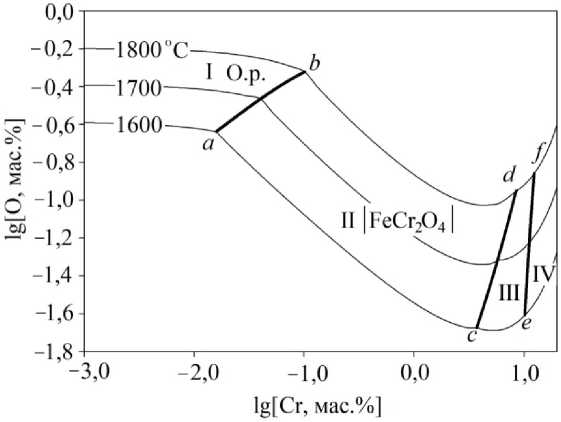
Рис. 1. Поверхность растворимости компонентов в металле системы Fe–Cr–O для интервала температур 1600–1800 °С
вующую равновесию жидкого металла с твердым оксидом хрома Cr2O3. При этом минимальная концентрация кислорода составляет 0,0204 мас. % для 5,31 мас. % хрома при 1600 °С.
Полученные в ходе настоящего расчета результаты по раскислительной способности хрома в системе Fe–Cr–O при 1600 °С были сравнены с имеющимися в литературе данными (рис. 2 и табл. 3).
Согласно рис. 2 угол наклона полученной в ходе настоящего расчета изотермы растворимости кислорода в системе Fe–Cr–O при 1600 °С (для области с концентрациями хрома менее чем 3 мас. %) согласуется с результатами работ [16, 26], однако расчетная изотерма проходит при более низких концентрациях кислорода по сравнению с литературными значениями. В области же с концентрациями хрома более чем 10 мас. %, угол наклона расчетной изотермы имеет хорошую сходимость с данными, опубликованными в работах [14, 18, 26].
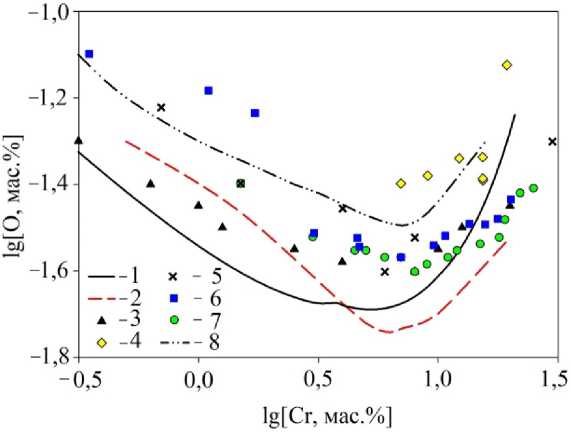
Рис. 2. Раскислительная способность хрома при 1600 °С в системе Fe–Cr–O: 1 – настоящая работа; 2 – данные И.С. Куликова [14];
3 – результаты расчета A. Ghosh и G.V.R. Murthy [16]; 4 – экспериментальные данные T. Itoh et al. [18]; 5 – экспериментальные данные D.C. Hilty et al. [23]; 6 – экспериментальные данные R.J. Frue-han [24]; 7 – экспериментальные данные D. Janke и W.A. Fischer [25];
8 – расчет I.-H. Jung et al. [26]
Таблица 3
Границы стабильности фаз и максимум раскислительной способности хрома при 1600 °С в системе Fe–Cr–O
|
Границы стабильности фаз по концентрации [Cr], мас. % |
Максимум раскислительной способности хрома |
Источник |
|||
|
FeCr 2 O 4 |
Cr 2 O 3 |
Cr 3 O 4 |
[Cr], мас. % |
[O] min , мас. % |
|
|
< 1,78 |
1,78–11,00 |
> 11,00 |
~ 11,20 |
~ 0,0200 |
[10] |
|
< 0,95 |
> 0,95 |
– |
7,10 |
0,0185 |
[14] |
|
< 3,00 |
3,00–8,00 |
> 8,00 |
~ 8,00 |
0,0250 |
[16] |
|
< 2,00 |
2,00–8,00 |
> 8,00 |
5,00 |
~ 0,0250 |
[17] |
|
– |
– |
– |
7,00 |
0,0400 |
[18] |
|
< 3,00 |
3,00–8,00 |
> 8,00 |
6,00 |
0,0250 |
[23] |
|
– |
– |
– |
7,00 |
0,0270 |
[24] |
|
< 1,50 |
1,50–8,00 |
> 8,00 |
8,00 |
0,0250 |
[25] |
|
< 4,47 |
> 4,47 |
– |
7,08 |
0,0320 |
[26] |
|
< 3,73 |
3,73–10,19 |
> 10,19 |
5,31 |
0,0204 |
[настоящая работа] |
Положение максимума раскислительной способности хрома практически совпадает с данными работы J. Chipman [17] по концентрации хрома и с расчетами Г.Г. Михайлова [10] по концентрации кислорода. Результаты расчета минимальной концентрации кислорода при 1600 °С превышают данные И.С. Куликова [14], но несколько ниже значений, приведенных в работах [18, 26].
Таким образом, полученные в ходе настоящей работы результаты показывают хорошую сходимость с литературными данными.
На основании проведенного исследования можно заключить, что хром не является сильным раскислителем для жидкого кислородсодержащего железа и должен рассматриваться в первую очередь как легирующий компонент. Потери хрома все же возможны при выплавке хромсодержащих сталей, в частности, при использовании недостаточного количества раскисляющих лигатур.
Выводы
Проведен термодинамический анализ взаимодействия хрома с кислородом в жидком железе. Для этого был выполнен расчет координат поверхности растворимости компонентов в металле в системе Fe–Cr–O для интервала температур 1600–1800 °С. В результате чего были определены границы термодинамической стабильности оксидных фаз, образующихся в процессе взаимодействия компонентов исследуемой системы. Так, для температуры 1600 °С жидкие неметаллические включения будут образовываться в качестве продуктов раскисления при концентрациях хрома в железе менее чем 0,016 мас. %; частицы феррохромита – при концентрациях хрома в железе от 0,016 до 3,73 мас. %; частицы оксида хрома Cr 2 O 3 – от 3,73 до 10,19 мас. % хрома; а образование в качестве продукта раскисления Cr 3 O 4 возможно лишь при концентрациях хрома в железе более чем 10,19 мас. %. В ходе моделирования также были построены изотермы раскислительной способности хрома в исследуемой системе. Минимальная концентрация кислорода, которую можно достичь в системе, составляет величину 0,0204 мас. % при 1600 °С. Таким образом, хром не является сильным раскислителем для жидкого кислородсодержащего железа и должен рассматриваться в первую очередь как легирующий компонент.
Список литературы Термодинамический анализ взаимодействия хрома с кислородом в жидком железе
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М.: Издат. Дом МИСиС, 2009. - 520 с.
- Самойлова, О.В. Фазовые равновесия в жидком металле системы Cu-Al-Cr-O / О.В. Самойлова, Л.А. Макровец, Г.Г. Михайлов // Известия вузов. Цветная металлургия. - 2017. - № 5. - С. 19-27. DOI: 10.17073/0021-3438-2017-5-19-27
- Thermodynamic reevaluation of the Fe-O system / T. Hidayat, D. Shishin, E. Jak, S.A. Decterov // Calphad. - 2015. - Vol. 48. - P. 131-144. DOI: 10.1016/j.calphad.2014.12.005
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, К.Б. Олкокк. - М.: Металлургия, 1982. - 392 с.
- Degterov, S. Critical evaluation and optimization of the thermodynamic properties and phase diagrams of the CrO-Cr2O3, CrO-Cr2O3-A12O3, and CrO-Cr2O3-CaO systems / S. Degterov, A.D. Pelton // Journal of Phase Equilibria. - 1996. - Vol. 17, no. 6. - P. 476-487. DOI: 10.1007/BF02665994


