Термодинамическое моделирование диаграммы состояния системы FeO-BaO-Al2O3
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.21, 2021 года.
Бесплатный доступ
Щелочноземельные металлы (ЩЗМ) в последнее время становятся все более востребованными при производстве сталей и сплавов и являются частью большинства композиций для рафинирования и модифицирования. В связи с этим возрастает необходимость построения диаграмм состояния оксидных (шлаковых) систем, включающих в качестве компонентов оксиды ЩЗМ, в частности BaO. Эти сведения необходимы как для анализа состава образующихся неметаллических включений, так и для понимания влияния концентрации оксидов ЩЗМ на температуру плавления шлака. Как известно, термодинамическое моделирование является ключевым инструментом для выбора оптимального направления проводимых исследований в области металлургических технологий, поэтому расчет фазовых диаграмм оксидных систем как части многокомпонентного шлакового расплава является важной задачей для исследователей. Особенно это актуально для систем, содержащих BaO в качестве компонента, так как имеющиеся в литературе данные ограничиваются практически только диаграммами состояния двойных систем. В настоящей работе была построена поверхность ликвидус фазовой диаграммы системы FeO-BaO-Al2O3. Для термодинамического моделирования использовали теорию субрегулярных ионных растворов, энергетические параметры которой были подобраны в ходе настоящего расчета. Также нами были оценены температуры, энтальпии и энтропии образования алюминатов бария Ba3Al2O6, BaAl2O4, BaAl12O19 из компонентов оксидного расплава. Эти значения для Ba3Al2O6 оказались равны 1604 °С, 159 410 Дж/моль, 16,215 Дж/(моль∙К); для BaAl2O4 - 1814 °С, 101 424 Дж/моль, 7,332 Дж/(моль∙К); для BaAl12O19 - 1911 °С, 613 406 Дж/моль, 201,201 Дж/(моль∙К) соответственно. Полученные сведения были сравнены с имеющимися немногочисленными литературными данными.
Термодинамическое моделирование, фазовые равновесия, теория субрегулярных ионных растворов, система feo-bao-al2o3, оксид бария
Короткий адрес: https://sciup.org/147235285
IDR: 147235285 | УДК: 669.18 | DOI: 10.14529/met210302
Текст научной статьи Термодинамическое моделирование диаграммы состояния системы FeO-BaO-Al2O3
В связи с все более широким применением щелочноземельных металлов (в частности бария) для рафинирования и модифицирования сталей и сплавов [1–5] возрастает актуальность исследований оксидных (шлаковых) систем, включающих в качестве компонента оксид бария BaO.
Влияние концентрации оксида бария на технологические параметры металлургических шлаков и флюсов можно найти в работах [6–9]. Однако для анализа технологических аспектов металлургического производства также важно и знание диаграмм состояния оксидных (шлаковых) систем. В атласе шлаков [10] представлена некоторая информация о диаграммах состояния оксидных систем с BaO, но данных для большинства практически значимых систем не приводится. Нет сведений и по диаграмме FeO–BaO–Al 2 O 3 , в то время как она является ключевой для дальнейшей оценки влияния оксида бария на фазовый состав и температуру плавления барийсодержащих многокомпонентных оксидных систем.
Следует отметить, что для оценки фазовых равновесий как в металлических, так и в оксидных системах на настоящий момент широко используются методики термодинамического моделирования [11]. Применимость методик расчета из монографии Г.Г. Михайлова и др. [11] для некоторых систем с барием и оксидом бария рассматривалась нами ранее в работе [5].
Целью же настоящей работы является термодинамическое моделирование диаграммы состояния системы FeO–BaO–Al2O3. Для выполнения указанной цели было необходимо в первую очередь провести моделирование диаграмм состояния двойных оксидных систем FeO–BaO, FeO–Al 2 O 3 и BaO–Al 2 O 3 , а уже затем на основании полученных данных построить поверхность ликвидус для системы FeO–BaO–Al 2 O 3 .
Термодинамическое моделирование двойных и тройной оксидных систем проводили с использованием теории субрегулярных ионных растворов [11]. Значения параметров мо-
Физическая химия и физика металлургических систем
дели определяли в процессе решения систем нелинейных уравнений, для чего применялся метод Ньютона. Используя сведения о координатах ряда опорных точек (точек фазовых переходов, эвтектических или перитектических превращений и т. п.) на выбранной фазовой диаграмме, составлялись выражения, связывающие данные о равновесных составах при данной температуре с параметрами модели. С использованием этих данных подбирались энергетические параметры теории, а уже затем моделировалась вся линия или поверхность ликвидус исследуемой системы.
Системы FeO–BaO и FeO–Al 2 O 3 были рассчитаны по указанному алгоритму нами ранее [12, 13]. Согласно полученным в ходе расчета данным система FeO–BaO представляет собой диаграмму с простой эвтектикой с координатами 31,58 мол. % BaO и 1066 °С [12]. Диаграмма состояния системы FeO–Al 2 O 3 характеризуется двумя эвтектическими равновесиями (координаты точек эвтектики: 5 мас. % и 1335 °С; 65 мас. % и 1765 °С) и наличием соединения FeAl 2 O 4 , которое плавится конгруэнтно при температуре 1770 °С [13].
Для расчета систем Al 2 O 3 –BaO и FeO– BaO–Al 2 O 3 в настоящей работе согласно указанному алгоритму использовались данные по температурам, энтальпиям и энтропиям плавления чистых оксидов и их соединений
(табл. 1). Термодинамические данные о плавлении герцинита были оценены нами ранее в работе [13], а сведения по алюминатам бария были получены в ходе настоящего исследования.
Энергетические параметры теории субрегулярных ионных растворов для расчета исследуемых систем приведены в табл. 2. Следует отметить, что в системе Al2O3–BaO для использования выражений для расчета активностей компонентов оксидного расплава оксиду алюминия был присвоен индекс «1», а оксиду бария – индекс «2». В системе FeO–BaO–Al 2 O 3 оксиду железа был присвоен индекс «1», оксиду бария – «2», оксиду алюминия – «3». При изменении порядка и индексирования компонентов систем энергетические параметры необходимо менять местами, так как они описывают взаимодействие ионов в расплаве относительно первого компонента.
Результаты моделирования диаграммы состояния системы Al2O3–BaO приведены на рис. 1 и в табл. 3 в сравнении с литературными данными [17, 18]. Как видно из сравнения, мы при моделировании опирались прежде всего на экспериментальные данные, полученные G. Purt [17]. Данные из работы Н.А. Торопова и Ф.Я. Галахова [18] характеризуются значительно более высокими температурами большинства нонвариантных равновесий.
Таблица 1
Температуры, энтальпии и энтропии плавления чистых оксидов и их соединений
|
Вещество |
Температура плавления, °С |
Энтальпия плавления, Дж/моль |
Энтропия плавления, Дж/(моль∙К) |
|
FeO |
1378 [14] |
33 470 [15] |
20,273 |
|
BaO |
1925 [14] |
57 768 [16] |
26,282 |
|
Al2O3 |
2051 [14] |
107 530 [14] |
46,269 |
|
FeAl 2 O 4 |
1770 [13] |
217 584 [13] |
87,454 [13] |
|
Ba 3 Al 2 O 6 |
1604 |
159 410 |
16,215 |
|
BaAl 2 O 4 |
1814 |
101 424 |
7,332 |
|
BaAl 12 O 19 |
1911 |
613 406 |
201,201 |
Таблица 2
Энергетические параметры теории субрегулярных ионных растворов для расчета диаграммы состояния системы FeO–BaO–Al 2 O 3
|
Система |
Энергетические параметры Q ijkl , Дж/моль |
||
|
FeO–BaO [12] |
–22 505 |
–35 041 |
–27 933 |
|
FeO–Al 2 O 3 [13] |
+212 |
–21 502 |
–11 091 |
|
BaO–Al 2 O 3* |
–88 680 |
–42 147 |
–135 547 |
|
FeO–BaO–Al 2 O 3 |
–117 158 |
–163 302 |
–199 832 |
* Примечание. Для расчета диаграммы состояния системы Al2O3–BaO первый и последний параметры необходимо поменять местами
Таблица 3
Координаты точек нонвариантных равновесий в системе Al 2 O 3 –BaO
|
Равновесие |
Координаты |
Источник |
||
|
мас. % BaO |
x Ba2 + |
t , °C |
||
|
Ж ↔ Al 2 O 3 + BaAl 12 O 19 |
16,00 |
0,060 |
1875 |
[17] |
|
17,00 |
0,063 |
1890 |
[18] |
|
|
19,97 |
0,077 |
1910 |
[Настоящая работа] |
|
|
Ж ↔ BaAl 12 O 19 + BaAl 2 O 4 |
38,00 |
0,169 |
1620 |
[17] |
|
45,00 |
0,214 |
1790 |
[18] |
|
|
47,33 |
0,230 |
1600 |
[Настоящая работа] |
|
|
Ж ↔ BaAl 2 O 4 + Ba 3 Al 2 O 6 |
76,50 |
0,520 |
1485 |
[17] |
|
77,50 |
0,534 |
1710 |
[18] |
|
|
75,77 |
0,510 |
1569 |
[Настоящая работа] |
|
|
Ж ↔ Ba 3 Al 2 O 6 + BaO |
90,00 |
0,749 |
1425 |
[17] |
|
85,00 |
0,653 |
1660 |
[18] |
|
|
88,80 |
0,725 |
1485 |
[Настоящая работа] |
|
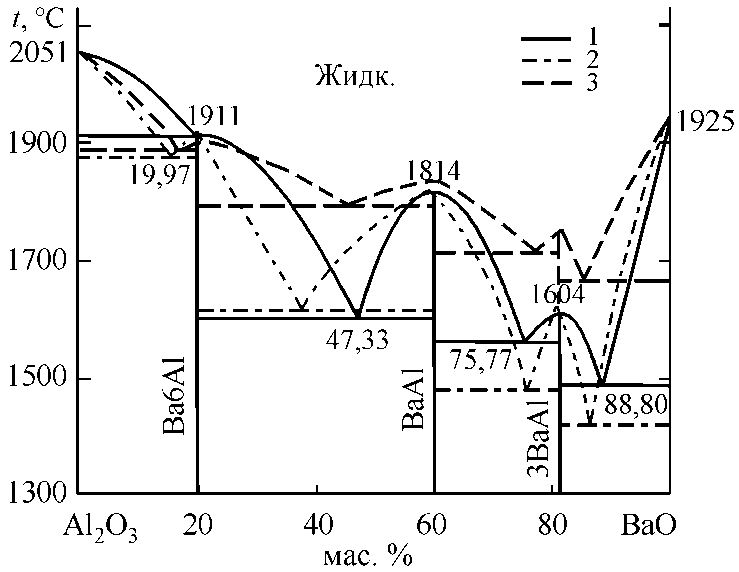
Рис. 1. Диаграмма состояния системы Al 2 O 3 –BaO: 1 – результаты проведенного нами моделирования; 2 – экспериментальные данные G. Purt [17]; 3 – экспериментальные данные Н.А. Торопова и Ф.Я. Галахова [18]. Ba6Al – BaAl 12 O 19 ; BaAl – BaAl 2 O 4 ; 3BaAl – Ba 3 Al 2 O 6
В ц е л о м ра с сч и тан н а я н а м и л и н и я л и кв идус ди аг ра мм ы с о сто я ния с и стемы Al 2 O 3 –BaO за н и ма ет п р о м е жут очное положен и е между данными [17] и [18].
П олуче н ные те м пе ра туры пл авле ни я а люм ин а т о в б ар и я с р а в н и м ы с л итера т ур н ыми данными [17–1 9]. Т ак , д л я г е кса а л юм и ната бария было получено значение t расч = 1911 °C, ч то сопостав и м о с 1 9 15 [1 7 ], 1 90 0 [ 1 8] и
1860 °C [19]. Для моноалюмината бария t расч = 1814 °C, в то же время это значение 1815 [17], 1830 [18] и 2000 °C [19]. А для Ba 3 Al 2 O 6 согласно моделированию t расч = 1604 °C, что сопоставимо с 1620 °C по данным G. Purt [17], но значительно ниже, чем 1750 °C по данным Н.А. Торопова и Ф.Я. Галахова [18].
Расчет поверхности ликвидус в системе FeO–BaO–Al 2 O 3 опирался на оценочные дан-
Физическая химия и физика металлургических систем
А12О3
FeO 20 40 60 80 BaO
мае. %
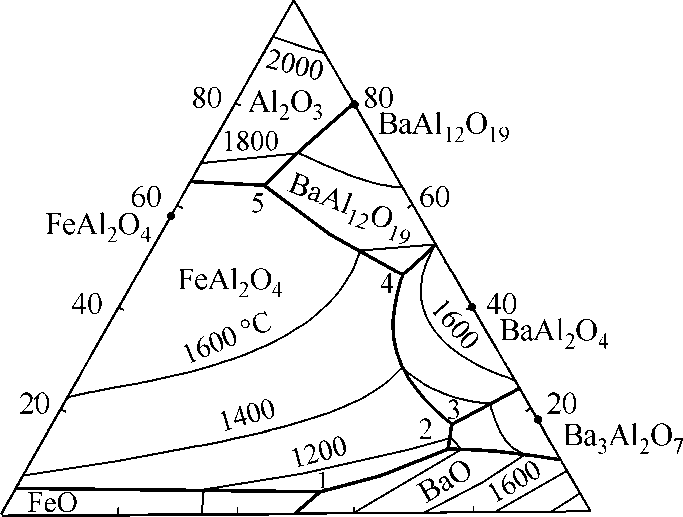
Рис. 2. Результаты расчета поверхности ликвидус диаграммы состояния системы FeO–BaO–Al 2 O 3 . Координаты точек 1–5 приведены в табл. 4
ные ра б от ы [5], на р асчет дво йных окс ид ны х с ис тем в ра б ота х [12 , 1 3 ] и на ре з уль та ты, п о луче нные в ход е нас тоя щег о и сследован ия .
Пове рхно сть лик ви дус д иа г р а ммы с остояния системы FeO–BaO–A l 2O3 приведена на ри с. 2, в та бл. 4 п р е д ставл е ны координаты точе к но нва риа нтн ых р а внове с ий. На д и а г ра мм у на не с ены из отермич е ские сече н ия от 1200 до 2000 °С с шаг ом в д ве сти гр адусо в.
Сог ла с но рис . 2 д ля бол ь шин с тва с ос тавов системы FeO–BaO–Al2O3 в равновесии с окси д ны м рас плавом б уде т на ход и т ь с я ге рцинит FeAl2O4. Алю ми наты б ар ия б удут вы х о д ить на по верхн ос ть ли к вид у с п ри д ос та точно больших концентрациях о к с ида ба р ия (б олее 40 м а с. % ). Р а внове с ие о кс ид ного ра с плава с на иб ол ее тугопл а вк им веще с твом в с ис т е м е (кору н дом ) на чин а ет р е ализ о вы ва ть с я пр и е го конце нтр аци и бо лее че м 60 ма с . %.
Выводы
Проведено термодинамическое моделирование диаграмм состояния систем Al2O3–BaO и FeO–BaO–Al 2 O 3 . Определены энергетические параметры теории субрегулярных ионных растворов для расчета активностей компонентов оксидного расплава исследуемых систем. Получены термодинамические данные (температуры, энтальпии и энтропии) образования алюминатов бария из компонентов оксидного расплава. Результаты настоящего исследования позволяют перейти к решению проблем рафинирования и модифицирования сталей барийсодержащими лигатурами, а также оценить влияние образующегося в ходе технологического процесса оксида бария на параметры шлакового расплава. В частности, можно заключить, что для большинства составов систе-
Таблица 4
Координаты точек нонвариантных равновесий в системе FeO–BaO–Al 2 O 3
Список литературы Термодинамическое моделирование диаграммы состояния системы FeO-BaO-Al2O3
- Breitzmann, M. Refining of steel melts using alkaline earth metals / M. Breitzmann, H.-J. Engell, D. Janke // Steel Research. – 1988. – Vol. 59, no. 7. – P. 289–294. DOI: 10.1002/srin.198801505
- Перспективы применения барийсодержащих лигатур для раскисления и модифицирования транспортного металла / К.В. Григорович, К.Ю. Демин, А.М. Арсенкин, А.К. Гарбер // Металлы. – 2011. – № 5. – С. 146–156.
- Критерии оценки качества раскислителей и модификаторов для стали / И.В. Рябчиков, В.Г. Мизин, Р.Г. Усманов и др. // Сталь. – 2015. – № 2. – С. 24–27.
- Экспериментальное исследование рафинирования и модифицирования стали сплавами Si–Ca, Si–Sr и Si–Ba / И.В. Бакин, Н.А. Шабурова, И.В. Рябчиков и др. // Сталь. – 2019. – № 8. – С. 14–18.
- Михайлов, Г.Г. Барий как раскислитель и модификатор жидкой стали / Г.Г. Михайлов, Л.А. Макровец, Д.А. Выдрин // Вестник ЮУрГУ. Серия «Металлургия». – 2013. – Т. 13, № 1. – С. 45–50.
- Gao, E. Effect of alkaline earth metal oxides on the viscosity and structure of the CaO–Al2O3 based mold flux for casting high-Al steels / E. Gao, W. Wang, L. Zhang // Journal of Non-Crystalline Solids. – 2017. – Vol. 473. – P. 79–86. DOI: 10.1016/j.jnoncrysol.2017.07.029
- Viscosities of CaO–SiO2–Al2O3–(R2O or RO) melts / S. Sukenaga, N. Saito, K. Kawakami, K. Nakashima // ISIJ International. – 2006. – Vol. 46, no. 3. – P. 352–358. DOI: 10.2355/isijinternational.46.352
- Wang, Z. Effect of substituting CaO with BaO on the viscosity and structure of CaO–BaO–SiO2–MgO–Al2O3 slags / Z. Wang, I. Sohn // Journal of the American Ceramic Society. – 2018. – Vol. 101. – P. 4285–4296. DOI: 10.1111/jace.15559
- Effect of substituting CaO with BaO and CaO/Al2O3 ratio on the viscosity of CaO–BaO–Al2O3–CaF2–Li2O mold flux system / Z. Li, X. You, M. Li et al. // Metals. – 2019. – Vol. 9. – P. 142. DOI: 10.3390/met9020142
- Slag Atlas. 2nd Edition. Edited by Verein Deutscher Eisenhüttenleute (VDEh). – Düsseldorf: Verlag Stahleisen GmbH, 1995. – 616 p.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. – М.: Издат. Дом МИСиС, 2009. – 520 с.
- Самойлова, О.В. Фазовая диаграмма системы FeO–SrO–BaO / О.В. Самойлова, Л.А. Макровец, И.В. Бакин // Вестник ЮУрГУ. Серия «Металлургия». – 2020. – Т. 20, № 3. – С. 5–11. DOI: 10.14529/met200301
- Samoilova, O.V. Thermodynamic modeling of phase equilibria in the FeO–MgO–Al2O3 system / O.V. Samoilova, L.A. Makrovets // Materials Science Forum. – 2020. – Vol. 989. – P. 3–9. DOI: 10.4028/www.scientific.net/MSF.989.3
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, С.Б. Олкокк. – М.: Металлургия, 1982. – 392 с.
- Darken, L.S. The system iron–oxygen. II. Equilibrium and thermodynamics of liquid oxide and other phases / L.S. Darken, R.W. Gurry // Journal of American Chemical Society. – 1946. – Vol. 68. – P. 798–816.
- Физико-химические свойства окислов. Справочник / под ред. Г.В. Самсонова. – М.: Металлургия, 1969. – 456 с.
- Purt, G. Binary system BaO–Al2O3 / G. Purt // Radex Rundschau. – 1960. – Vol. 4. – P. 198–202.
- Торопов, Н.А. Диаграмма состояния системы BaO–Al2O3 / Н.А. Торопов, Ф.Я. Галахов // Доклады АН СССР. – 1962. – Т. 82, № 1. – С. 69–70.
- Critical Melting Points and Reference Data for Vacuum Heat Treating / Ed. by V. Osterman, H. Antes Jr. – Solar Atmospheres Inc., 2010. – 42 p.


