Термодинамическое моделирование фазовой диаграммы системы Cu2O-BaO-Fe2O3
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 2 т.18, 2018 года.
Бесплатный доступ
Выполнено термодинамическое моделирование диаграмм состояния двойных систем Cu2O-BaO, Cu2O-Fe2O3, BaO-Fe2O3, а также тройной системы Cu2O-BaO-Fe2O3. В ходе работы определены термодинамические модели и их параметры, необходимые для термодинамического описания активностей компонентов оксидного расплава в данных системах. Для расчета использовались приближения теории совершенных ионных растворов (для системы Cu2O-Fe2O3) и теории субрегулярных ионных растворов (для систем Cu2O-BaO, BaO-Fe2O3, Cu2O-BaO-Fe2O3). По результатам проведенного моделирования определены координаты точек нонвариантных превращений на фазовых диаграммах исследуемых двойных и тройной систем. Полученные результаты по термодинамическому моделированию координат линий ликвидуса фазовых диаграмм двойных систем Cu2O-BaO, Cu2O-Fe2O3, BaO-Fe2O3 были сопоставлены с разрозненными малочисленными литературными данными для исследуемых систем. В ходе работы впервые были определены области существования ферритов бария в тройной оксидной системе Cu2O-BaO-Fe2O3, а также построены изотермы на полной проекции поверхности ликвидуса диаграммы состояния системы Cu2O-BaO-Fe2O3. Используемая в работе методика моделирования позволила оценить энтальпии, температуры и энтропии плавления соединений оксида бария BaO с оксидом меди (I) (BaCu2O2); с оксидом железа (III) (Ba3Fe2O6, Ba2Fe2O5, BaFe2O4, BaFe12O19). Результаты моделирования, полученные в ходе выполнения настоящей работы, могут быть использованы для разработки технологических условий синтеза из оксидного расплава монокристаллов гексаферрита бария, в кристаллической решетке которого часть катионов железа замещена ионами меди.
Система cu2o-bao-fe2o3, термодинамическое моделирование, фазовые равновесия
Короткий адрес: https://sciup.org/147157135
IDR: 147157135 | УДК: 669.35 | DOI: 10.14529/met180201
Текст научной статьи Термодинамическое моделирование фазовой диаграммы системы Cu2O-BaO-Fe2O3
Гексаферрит бария представляет интерес как материал с ферромагнитными свойствами с возможностью использования в СВЧ устройствах [1–4]. Известно, что ионы железа в кристаллической решетке BaFe 12 O 19 могут быть частично заменены ионами других металлов, что может значительно повлиять на свойства гексаферрита [5–10]. В частности, возможно частичное замещение ионов железа ионами меди [10], что значительно повышает интерес к системе Cu 2 O–BaO–Fe 2 O 3 . Следует отметить, что в литературе отсутствуют сведения по фазовой диаграмме данной системы.
Целью настоящей работы является термодинамическое моделирование поверхности ликвидуса диаграммы состояния системы Cu 2 O–BaO–Fe 2 O 3 .
Подробно методика моделирования диаграмм состояния оксидных систем приведена в работах [11–15]. Для расчета координат поверхности ликвидуса фазовой диаграммы тройной системы необходимо провести расчет координат линий ликвидуса диаграмм состояния двойных систем, входящих в состав исследуемой системы. Следовательно, в рамках настоящей работы в первую очередь необходимо провести термодинамическое моделирование линий ликвидуса диаграмм состояния систем Cu 2 O–BaO, Cu 2 O–Fe 2 O 3 , BaO–Fe 2 O 3 , а затем, опираясь на полученные данные, рассчитать координаты поверхности ликвидуса фазовой диаграммы тройной системы Cu 2 O–BaO–Fe 2 O 3 .
Методика применяемого в данной работе расчета опирается на координаты (состав и температура) наиболее надежно определенных характерных точек на диаграммах: точек эвтектических, перитектических, фазовых переходов (например, плавления веществ в исследуемой системе) и т. п. Таким образом, для моделирования диаграмм состояния необходимы сведения о температурах и энтальпиях плавления веществ исследуемой системы. В табл. 1 приведены данные для веществ, входящих в систему Cu2O–BaO–Fe2O3.
Для моделирования линии ликвидуса диаграммы состояния системы Cu2O–Fe2O3 использовалось приближение теории совершенных ионных растворов [11]. Расчет координат линий ликвидуса систем Cu2O–BaO, BaO–Fe 2 O 3 , а также координат поверхности ликвидуса системы Cu 2 O–BaO–Fe 2 O 3 проводился с использованием приближения теории субрегулярных ионных растворов [11]. При проведении моделирования оксиду меди Cu 2 O был присвоен индекс «1», оксиду бария BaO – индекс «2», а оксиду железа Fe 2 O 3 – индекс «3». Все расчеты производились для парциального давления кислорода, равного 10 Па (10–4 атм) в каждой из исследуемых систем.
Значения энергетических параметров модели субрегулярных ионных растворов для двойных оксидных систем определялись в процессе решения систем нелинейных уравнений, для чего использовался метод Ньютона. Для составления уравнений использова- лись данные о составах ряда опорных точек, выбранных на линии ликвидуса фазовых диаграмм. Для каждого набора данных составлялось выражение, связывающее данные о равновесных составах при данной температуре с параметрами модели.
Для моделирования тройной оксидной системы необходимы также сведения о перекрестных энергетических параметрах взаимодействия теории субрегулярных ионных растворов, формула для расчета которых приведена в работе [13].
Энергетические параметры теории субрегулярных ионных растворов, использованные в данной работе при проведении термодинамического моделирования, приведены в табл. 2.
Сведений о виде диаграммы состояния системы Cu 2 O–BaO в литературе не имеется, однако есть данные о наличии соединения BaCu 2 O 2 , а также о том, что характер плавления этого соединения – конгруэнтный, а его температура плавления равняется 1015 °С [20]. Также согласно экспериментальным данным авторов работы [20] в системе имеются две точки эвтектики: при температуре 940 °С оксидный расплав находится в равновесии с Cu 2 O и BaCu 2 O 2 ; при температуре 890 °С оксидный расплав находится в равновесии с BaO и BaCu 2 O 2 . Результаты проведенного в ходе выполнения данной работы термодинамического моделирования линии ликвидуса
Таблица 1
Данные о температурах и энтальпиях плавления веществ, входящих в систему Cu 2 O–BaO–Fe 2 O 3
|
Вещество |
Т 0 ОГ Tm , С |
A m H 0 , Дж/моль T m |
|
Cu 2 O |
1242 [16] |
64 300 [16] |
|
BaO |
1925 [17] |
57 768 [18] |
|
Fe 2 O 3 |
1539 [19] |
87 000 [19] |
|
BaCu 2 O 2 |
1015 [20] |
97 310 [настоящая работа] |
|
CuFeO 2 |
1197 [17] |
64 350 [17] |
|
Ba 3 Fe 2 O 6 |
1318 [настоящая работа] |
240 300 [настоящая работа] |
|
Ba 2 Fe 2 O 5 |
1358 [настоящая работа] |
119 300 [настоящая работа] |
|
BaFe 2 O 4 |
1358 [настоящая работа] |
207 175 [настоящая работа] |
|
BaFe12O19 |
1457 [настоящая работа] |
424 265 [настоящая работа] |
Таблица 2
Энергетические параметры ( Q ijkl ) теории субрегулярных ионных растворов, Дж/моль
Литературных экспериментальных данных о диаграмме состояния системы Cu2O– Fe2O3 в литературе также не приводится. Имеются сведения о наличии соединения CuFeO2 [17]. Несмотря на то, что приводятся данные о температуре плавления CuFeO2 (1197 °С), сведений о характере плавления соединения (конгруэнтный или инконгруэнт-ный) не имеется. Результаты термодинамического моделирования линии ликвидуса фа- зовой диаграммы системы Cu2O–Fe2O3 приведены на рис. 2. Согласно проведенному расчету наиболее термодинамически вероятен конгруэнтный характер плавления соединения CuFeO2.
Сведения о диаграмме состояния системы BaO–Fe 2 O 3 достаточно противоречивы [21–23]. Согласно экспериментальным данным Y. Goto и T. Takada [21] в системе присутствуют три соединения: Ba 2 Fe 2 O 5 , BaFe 2 O 4 , BaFe 12 O 19 , которые имеют конгруэнтный характер плавления. По экспериментальным данным H. Sato [22]
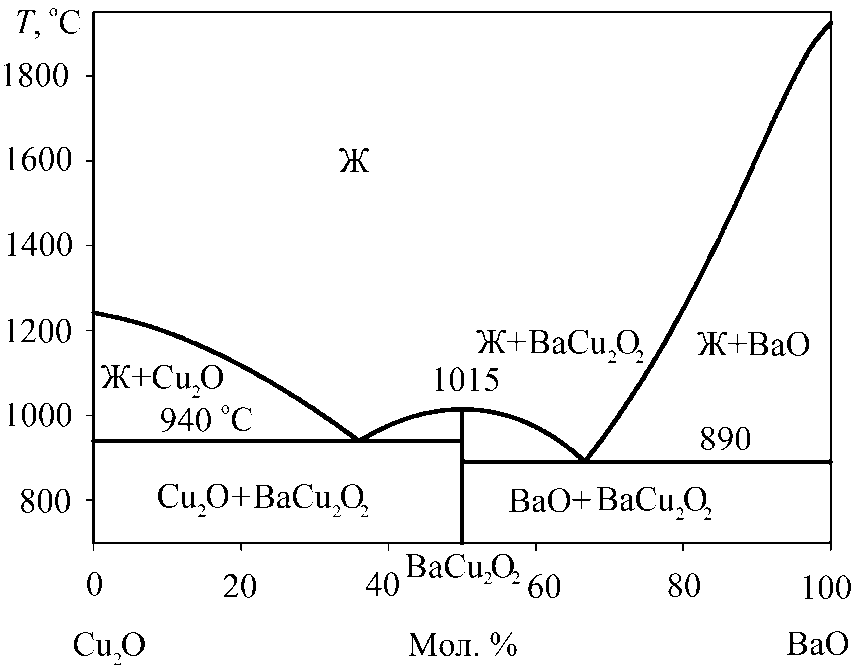
Рис. 1. Результаты расчета фазовой диаграммы системы Cu 2 O–BaO
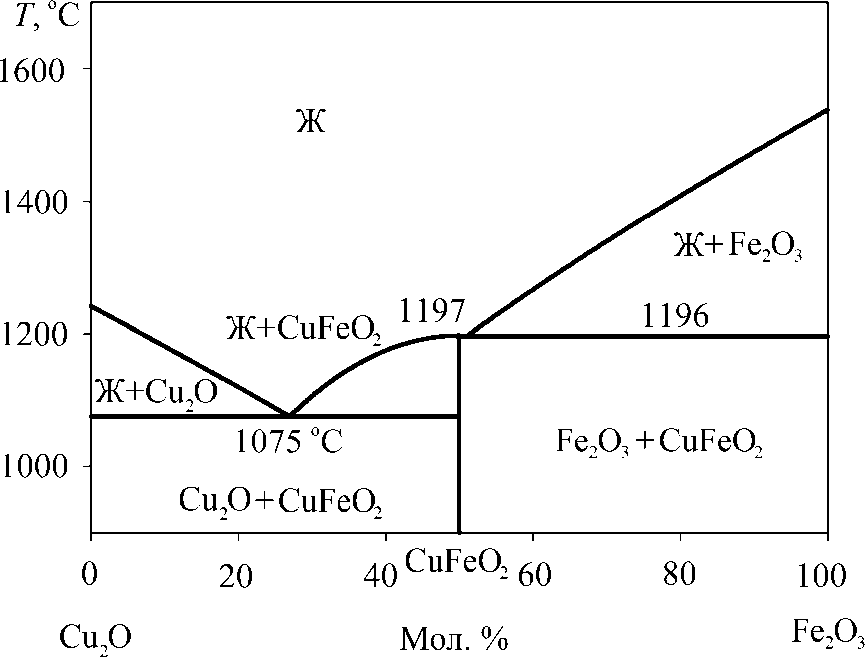
Рис. 2. Результаты расчета фазовой диаграммы системы Cu 2 O–Fe 2 O 3
в системе BaO–Fe2O3 имеются четыре соединения. Помимо ферритов бария, указанных в работе [21], в работе [22] приводится еще и соединение Ba3Fe2O6. Причем согласно [22] только Ba2Fe2O5 и BaFe2O4 имеют конгруэнтный характер плавления, соединения Ba3Fe2O6 и BaFe12O19 плавятся инконгруэнтно (по перитектическим реакциям). Д.А. Винник и др. в работе [23] приводят расчетную диаграмму состояния системы BaO–Fe2O3. Помимо четырех вышеуказанных ферритов бария, согласно [23] в системе имеется соединение Ba2Fe6O11, которое претерпевает твердофазный распад при температуре 1145 °С. Данные о положении линии ликвидуса исследуемой диаграммы состояния согласно литературным источникам [21–23] приведены на рис. 3 и в табл. 3.
Результаты проведенного в ходе выполнения данной работы термодинамического моделирования линии ликвидуса фазовой диаграммы системы BaO–Fe 2 O 3 также приведены на рис. 3 и в табл. 3.
Как следует из табл. 3 и рис. 3, в целом расчет, проведенный в ходе выполнения настоящей работы, достаточно хорошо совпадает с литературными данными. Наибольшее расхождение наблюдается для температуры плавления феррита бария BaFe 2 O 4 как между литературными источниками, так и между нашим расчетом и литературными данными.
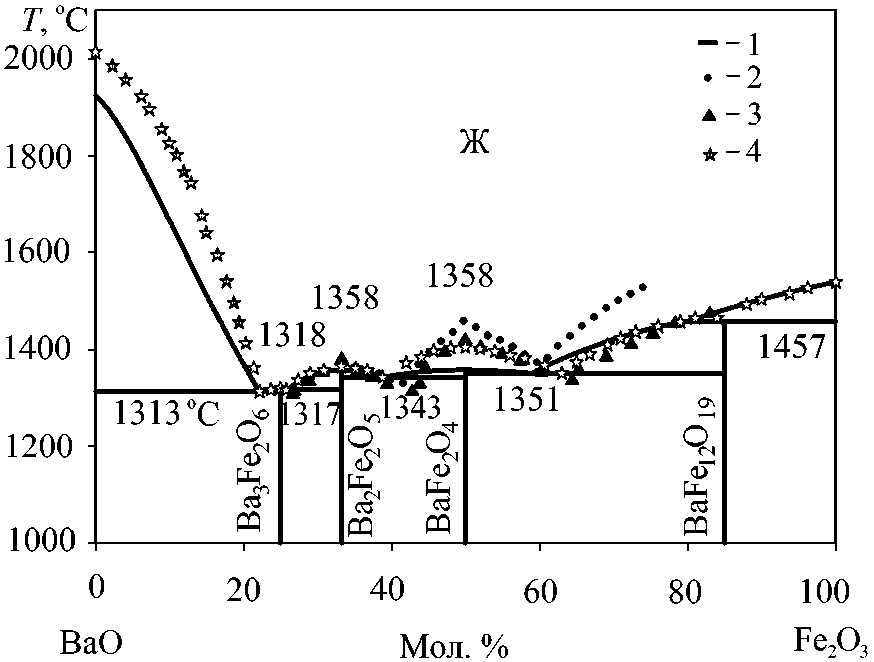
Рис. 3. Фазовая диаграмма системы BaO–Fe 2 O 3 : 1 – настоящая работа; 2 – экспериментальные данные [21]; 3 – экспериментальные данные [22];
4 – расчетные данные [23]
Таблица 3
Координаты характерных точек на диаграмме состояния системы BaO–Fe2O3
|
Вид фазового превращения |
Состав, мол. % |
Температура, °С |
||||||
|
[21] |
[22] |
[23] |
Настоящая работа |
[21] |
[22] |
[23] |
Настоящая работа |
|
|
Ж↔BaO+Ba 3 Fe 2 O 6 |
– |
– |
22,2 |
22,2 |
– |
– |
1313 |
1313 |
|
Ж↔Ba 3 Fe 2 O 6 |
– |
– |
25,0 |
25,0 |
– |
– |
1320 |
1318 |
|
Ж ↔ Ba 3 Fe 2 O 6 + Ba 2 Fe 2 O 5 |
– |
26,7 |
25,8 |
25,9 |
– |
1307 |
1317 |
1317 |
|
Ж↔Ba 2 Fe 2 O 5 |
33,3 |
33,3 |
33,3 |
33,3 |
1370 |
1380 |
1365 |
1358 |
|
Ж↔Ba 2 Fe 2 O 5 +BaFe 2 O 4 |
42,0 |
42,8 |
38,8 |
38,8 |
1330 |
1313 |
1343 |
1343 |
|
Ж↔BaFe 2 O 4 |
50,0 |
50,0 |
50,0 |
50,0 |
1460 |
1420 |
1405 |
1358 |
|
Ж↔BaFe 2 O 4 +BaFe 12 O 19 |
60,2 |
64,4 |
63,0 |
58,9 |
1370 |
1336 |
1351 |
1351 |
|
Ж+Fe 2 O 3 ↔BaFe 12 O 19 |
– |
83,0 |
84,0 |
79,9 |
– |
1474 |
1465 |
1457 |
Однак о в е ли чи н а рас хо жд е н и я н а хо д и тс я в п ред е л а х д оп у с ти мой п о гре ш н о с ти . Т ак, относительная погрешность δ д ля оп ре д е л е н н ой терм оди намическ им м о де л и ровани ем в на стоя ще й ра боте те мпе ра ту ры п ла в ле н и я BaFe2O4 п о отн ош ен ию к э к с п е ри ме н та л ьн ым данным [21] составляет 6,99 %; по отнош е н и ю к э к с п е ри ме н та л ьным д а н н ым [ 22 ] равняется 4,37 %; а п о от н о ш ени ю к рас че тным да н н ым [23] и м е е т в е ли ч и н у в 3, 35 %.
В ходе моделировани я ди а грамм с о с тоя н и я д в ой н ых сис те м бы ли оц е н е ны э н та л ь п и и , те мп е рат у ры и э нтроп и и п лавл е н и я со ед и н е н и й , об р а зующ и хся в э ти х с и с те ма х. Да н н ые п о те мпе ра ту ра м и э н та льп и ям п л ав л е н и я с ое д и не н и й п ри в ед е н ы в та бл. 1. Э н троп и и п лавл е н и я с ое ди н е н и й с лед у ю щ и е, Дж /( мо ль· К) : 26,12 (д ля сое д и н е н и я BaCu 2 O 2 );
20,76 (для соединения CuFeO 2 ); 90,12 (для соединения Ba 3 Fe 2 O 6 ); 25,91 (для соединения Ba 2 Fe 2 O 5 ); 97,25 (для соединения BaFe 2 O 4 ); 199,25 (для соединения BaFe 12 O 19 ).
В литературе отсутствуют сведения по фазовой диаграмме системы Cu 2 O–BaO– Fe2O3. Результаты выполненного в ходе настоящей работы расчета координат поверхности ликвидуса данной тройной оксидной системы приведены на рис. 4. На диаграмму нанесены изотермы с шагом в 100 °С в интервале температур от 900 до 1900 °С. Координаты точек нонвариантных превращений, реализующихся в системе, приведены в табл. 4. Следует отметить, что в тройной системе, согласно результатам моделирования, реализуется ряд равновесий, которых нет на двойных диаграммах состояния исследуемых систем.
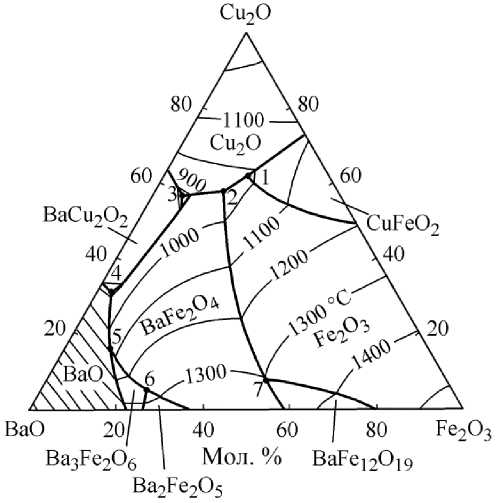
Рис. 4. Результаты моделирования полной проекции поверхности ликвидуса системы Cu 2 O–BaO–Fe 2 O 3 . Точки 1–7 – см. табл. 4
Таблица 4
Координаты точек нонвариантных превращений на диаграмме состояния системы Cu2O–BaO–Fe2O3
|
№ точки |
Состав, мол. % |
Температура, °С |
||
|
Cu 2 O |
BaO |
Fe 2 O 3 |
||
|
1 |
61,7 |
18,9 |
19,4 |
974 |
|
2 |
58,1 |
26,7 |
15,2 |
929 |
|
3 |
56,9 |
35,9 |
7,2 |
888 |
|
4 |
31,0 |
65,5 |
3,5 |
860 |
|
5 |
13,8 |
73,6 |
12,6 |
1108 |
|
6 |
4,1 |
70,9 |
25,0 |
1268 |
|
7 |
7,8 |
40,5 |
51,7 |
1306 |
Так, в частности, имеется равновесие оксидного расплава с моноферритом бария и с оксидом железа Fe 2 O 3 (линия «2–7»), которого нет в двойной системе BaO–Fe 2 O 3 .
Выводы
Проведено термодинамическое описание фазовых равновесий в системе Cu 2 O–BaO– Fe 2 O 3 . Определены термодинамические модели и их параметры, необходимые для описания фазовых диаграмм двойных систем Cu 2 O–BaO, Cu 2 O–Fe 2 O 3 , BaO–Fe 2 O 3 , а также поверхности ликвидуса тройной системы Cu 2 O–BaO–Fe 2 O 3 . В ходе моделирования оценены энтальпии, энтропии и температуры плавления соединений BaCu 2 O 2 , CuFeO 2 , Ba 3 Fe 2 O 6 , Ba 2 Fe 2 O 5 , BaFe 2 O 4 , BaFe 12 O 19 . Впервые определены координаты точек нонвариантных превращений в системе Cu 2 O–BaO–Fe 2 O 3 . Определены условия образования монокристаллов гексаферрита бария из оксидного расплава исследуемой тройной системы. При добавлении третьего компонента (оксида меди Cu 2 O) в систему BaO–Fe 2 O 3 температуры точек нонвариантных превращений с участием гексаферрита бария снижаются практически на 100 градусов до 1306 °С.
Работа осуществлена при финансовой поддержке РФФИ, грант № 16-08-00133 а.
Список литературы Термодинамическое моделирование фазовой диаграммы системы Cu2O-BaO-Fe2O3
- Gambino, R.J. Growth of Barium Ferrite Single Crystals/R.J. Gambino, F. Leonhard//J. Am. Ceram. Soc. -1961. -Vol. 44, no. 5. -P. 221-224 DOI: 10.1111/j.1151-2916.1961.tb15364.x
- Barium Hexaferrite Nanoparticles: Synthesis and Magnetic Properties/K.S. Martirosyan, E. Galstyan, S.M. Hossain et al.//Mater. Sci. Eng. B. -2011. -Vol. 176, no. 1. -P. 8-13 DOI: 10.1016/j.mseb.2010.08.005
- Pullar, R.C. Hexagonal Ferrites: A Review of the Synthesis, Properties and Applications of Hexaferrite Ceramics/Pullar R.C.//Prog. Mater. Sci. -2012. -Vol. 57, no. 7. -P. 1191-1334 DOI: 10.1016/j.pmatsci.2012.04.001
- Development of Z-type Hexaferrites for High Frequency EMI Shielding Applications/S.B.S. Magham, M. Sharma, S.R. Shannigrahi et al.//J. Magn. Magn. Mater. -2017. -Vol. 441. -P. 303-309 DOI: 10.1016/j.jmmm.2017.05.066
- Growth, Structural and Magnetic Characterization of Co-and Ni-substituted Barium Hexaferrite Single Crystals/D.A. Vinnik, D.A. Zherebtsov, L.S. Mashkovtseva et al.//J. Alloys Compd. -2015. -Vol. 628. -P. 480-484 DOI: 10.1016/j.jallcom.2014.12.124
- Jamalian, M. Magnetic and Microwave Properties of Barium Hexaferrite Ceramics Doped with Gd and Nd/M. Jamalian, A. Ghasemi, Asl M.J. Pourhosseini//J. Electron. Mater. -2015. -Vol. 44, no. 8. -P. 2856-2861 DOI: 10.1007/s11664-015-3720-x
- Cheng, Y. Enhanced Microwave Absorbing Properties of La3+ Substituting Barium Hexaferrite/Y. Cheng, X. Ren//J. Supercond. Nov. Magn. -2016. -Vol. 29, no. 3. -P. 803-808 DOI: 10.1007/s10948-015-3355-4
- Structural, Magnetic and Microwave Absorption Properties of Ce-doped Barium Hexaferrite/Z. Mosleh, P. Kameli, A. Poorbaferani et al.//J. Magn. Magn. Mater. -2016. -Vol. 397. -P. 101-107 DOI: 10.1016/j.jmmm.2015.08.078
- Kumar, S. Complex Permittivity, Permeability, Magnetic and Microwave Absorbing Properties of Bi3+ Substituted U-type Hexaferrite/S. Kumar, R. Chatterjee//J. Magn. Magn. Mater. -2018. -Vol. 448. -P. 88-93 DOI: 10.1016/j.jmmm.2017.06.123
- Cu-substituted Barium Hexaferrite Crystal Growth and Characterization/D.A. Vinnik, A.Yu. Tarasova, D.A. Zherebtsov et al.//Ceram. Int. -2015. -Vol. 41, no. 7. -P. 9172-9176 DOI: 10.1016/j.ceramint.2015.03.051
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Михайлов, Г.Г. Фазовые равновесия в многокомпонентных системах с жидкими цветными металлами/Г.Г. Михайлов, Е.А. Трофимов, А.Ю. Сидоренко. -М.: Издат. Дом МИСиС, 2014. -158 с.
- Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu2O-Al2O3-ZrO2/О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец и др.//Вестник ЮУрГУ. Серия «Металлургия», 2015. -Т. 15, № 4. -С. 15-21 DOI: 10.14529/met150402
- Самойлова, О.В. Термодинамическое описание фазовых равновесий в системе Cu2O-CeO2-Ce2O3-La2O3/О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец//Вестник ЮУрГУ. Серия «Металлургия». -2017. -Т. 17, № 1. -С. 16-23 DOI: 10.14529/met170102
- Самойлова, О.В. Фазовые равновесия в жидком металле системы Cu-Al-Cr-O/О.В. Самойлова, Л.А. Макровец, Г.Г. Михайлов//Известия вузов. Цветная металлургия. -2017. -№ 5. -С. 19-27 DOI: 10.17073/0021-3438-2017-5-19-27
- Химическая энциклопедия: в 5 т./под ред. И.Л. Кнунянца. -М.: Сов. энцикл., 1990. -Т. 2. -671 с.
- Kubaschewski, O. Metallurgical Thermochemistry/O. Kubaschewski, C.B. Alcock. -Pergamon Press Ltd Publ., Oxford, 1979. -392 p.
- Физико-химические свойства окислов. Справочник/под ред. Г.В. Самсонова. -М.: Металлургия, 1969. -456 с.
- FactSage Thermochemical Software and Databases/C.W. Bale, P. Chartrand, S.A. Degterov et al.//Calphad. -2002. -Vol. 26, no. 2. -P. 189-228 DOI: 10.1016/S0364-5916(02)00035-4
- Lindemer, T.B. The BaO-Cu-CuO System. Solid-Liquid Equilibria and Thermodynamics of BaCuO2 and BaCu2O2/T.B. Lindemer, E.D. Specht//Physica C. -1995. -Vol. 255, no. 1-2. -P. 81-94 DOI: 10.1016/0921-4534(95)00460-2
- Goto, Y. Phase Diagram of the System BaO-Fe2O3/Y. Goto, T. Takada//J. Am. Ceram. Soc. -1960. -Vol. 43, no. 3. -P. 150-153 DOI: 10.1111/j.1151-2916.1960.tb14330.x
- Sato, H. Liquidus Surface and Isothermal Section Diagram at 973 K in BaO-Fe2O3-(0-50 mol%) B2O3 Pseudo-ternary System/H. Sato//Mater. Trans., JIM. -1997. -Vol. 38, no. 10. -P. 858-864. https://doi.org/10.2320/Matertrans1989.38.858
- Термодинамический анализ возможности использования расплавов системы BaO-Na2O-Fe2O3 для выращивания кристаллов гексаферрита бария/Д.А. Винник, Е.А. Трофимов, Д.П. Галкина и др.//Вестник ЮУрГУ. Серия «Металлургия». -2017. -Т. 17, № 3. -С. 34-45 DOI: 10.14529/met170305


