Термодинамическое моделирование фазовых диаграмм оксидных систем FeO-MgO, FeO-Cr2O3, MgO-Cr2O3 и FeO-MgO-Cr2O3
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 1 т.19, 2019 года.
Бесплатный доступ
Проведено термодинамическое моделирование координат линий ликвидуса диаграмм состояния двойных оксидных систем FeO-MgO, FeO-Cr2O3, MgO-Cr2O3 и координат поверхности ликвидуса диаграммы состояния тройной оксидной системы FeO-MgO-Cr2O3. В ходе работы определены энергетические параметры теории субрегулярных ионных растворов, используемой при проведении расчета. По результатам проведенного моделирования определены координаты точек нонвариантных превращений на фазовых диаграммах исследуемых систем. Полученные результаты по термодинамическому моделированию координат линий ликвидуса фазовых диаграмм двойных оксидных систем FeO-MgO, FeO-Cr2O3, MgO-Cr2O3 были сопоставлены с разрозненными малочисленными литературными данными для исследуемых систем. По результатам расчета определены энтальпии и энтропии образования соединений FeCr2O4 и MgCr2O4 из компонентов оксидного расплава систем FeO-Cr2O3 и MgO-Cr2O3 соответственно. Согласно результатам моделирования энтальпия образования феррохромита из компонентов оксидного расплава составляет 157 376 Дж/моль, а энтропия равняется 44,71 Дж/(моль∙К). Энтальпия и энтропия образования магнезиохромита из компонентов оксидного расплава оказались равными 389 100 Дж/моль и 123,19 Дж/(моль•К) соответственно. Впервые получены результаты по расчету координат полной проекции поверхности ликвидуса системы FeO-MgO-Cr2O3. Диаграмма состояния системы FeO-MgO-Cr2O3 характеризуется обширными областями равновесия оксидного расплава с твердыми растворами оксидов и с твердыми растворами шпинелей. Результаты, полученные в ходе выполнения настоящей работы, представляют интерес для анализа взаимодействия металлического и шлакового расплавов с футеровкой печи при производстве стали.
Система feo-mgo-cr2o3, термодинамическое моделирование, фазовые равновесия
Короткий адрес: https://sciup.org/147232523
IDR: 147232523 | УДК: 669.18 | DOI: 10.14529/met190102
Текст научной статьи Термодинамическое моделирование фазовых диаграмм оксидных систем FeO-MgO, FeO-Cr2O3, MgO-Cr2O3 и FeO-MgO-Cr2O3
Изучение фазовых равновесий в системе FeO–MgO–Cr2O3 является одной из актуальных задач при анализе сталеплавильных процессов из-за возможного взаимодействия металлического и шлакового расплавов с футеровкой сталеплавильных печей (состоящей в основном из периклаза или периклазохроми-та). Результатами такого взаимодействия могут стать загрязнение металла неблагоприятными неметаллическими включениями тугоплавких оксидных соединений, а также изменение технологических (физических) свойств шлака.
Целью настоящей работы является термодинамическое моделирование диаграмм состояния оксидных систем FeO–MgO, FeO–Cr 2 O 3 , MgO–Cr 2 O 3 и FeO–MgO–Cr 2 O 3 .
Используемая в данной работе методика моделирования диаграмм состояния оксидных систем подробно описана в работах [1–4]. В общем случае расчет опирается на наибо- лее надёжные экспериментальные данные (из представленных в литературе) о координатах (составе и температуре) характерных точек фазовых диаграмм: точек эвтектических, перитектических, фазовых переходов (например, плавления) и т. п. С использованием этих данных подбираются параметры термодинамической модели, а затем, используя определённые значения параметров, рассчитывается полностью вся линия или поверхность ликвидуса исследуемой системы.
Значения параметров термодинамической модели для описания оксидных систем определяются в процессе решения систем нелинейных уравнений, для чего применяется метод Ньютона. Для составления уравнений используются (как уже говорилось ранее) данные о составах ряда характерных точек, выбранных на линии ликвидуса фазовых диаграмм. Для каждого набора данных составляется выражение, связывающее координаты характерной точки с параметрами используемой для расчета термодинамической модели.
В табл. 1 приведены необходимые для проведения моделирования данные по температурам и энтальпиям плавления веществ, составляющих систему FeO–MgO–Cr 2 O 3 .
Для расчета координат линий ликвидуса систем FeO–MgO, FeO–Cr2O3, MgO–Cr2O3 и поверхности ликвидуса системы FeO–MgO– Cr2O3 в ходе работы использовалось приближение теории субрегулярных ионных растворов [1]. Для расчета координат линий солидуса, ограничивающих область существования твердого раствора в системах FeO–MgO и MgO–Cr2O3, использовалось приближение теории регулярных ионных растворов [1]. Модельные параметры используемых теорий приведены в табл. 2.
Результаты термодинамического моделирования фазовой диаграммы системы FeO–MgO в сравнении с литературными данными [8, 9] приведены на рис. 1. При подборе энергетического параметра теории регулярных ионных растворов и моделировании линии солидуса в системе FeO–MgO учитывались литературные данные [10, 11] по активностям оксида железа
Таблица 1
Данные о температурах и энтальпиях плавления веществ, составляющих систему FeO–MgO–Cr 2 O 3
|
Вещество |
o Tm , С |
Δ mH o o , Дж/моль T m |
|
FeO |
1378 [5] |
33 470 [6] |
|
MgO |
2825 [5] |
77 400 [5] |
|
Cr 2 O 3 |
2300 [7] |
104 670 [7] |
Таблица 2
Модельные параметры теории субрегулярных ионных растворов (оксидный расплав) и теории регулярных ионных растворов (твердый раствор)
|
Система |
Оксидный расплав Q ijkl , Дж/моль |
Твердый раствор Q 12 , Дж/моль |
||
|
FeO–MgO |
–5000 |
–25 000 |
–15 000 |
+3000 |
|
FeO–Cr 2 O 3 |
0 |
+12 115 |
–60 565 |
– |
|
MgO–Cr 2 O 3 |
–2000 |
–66 580 |
–26 420 |
+12 030 |
|
FeO–MgO–Cr 2 O 3 |
–35 150 |
–74 900 |
–125 470 |
– |
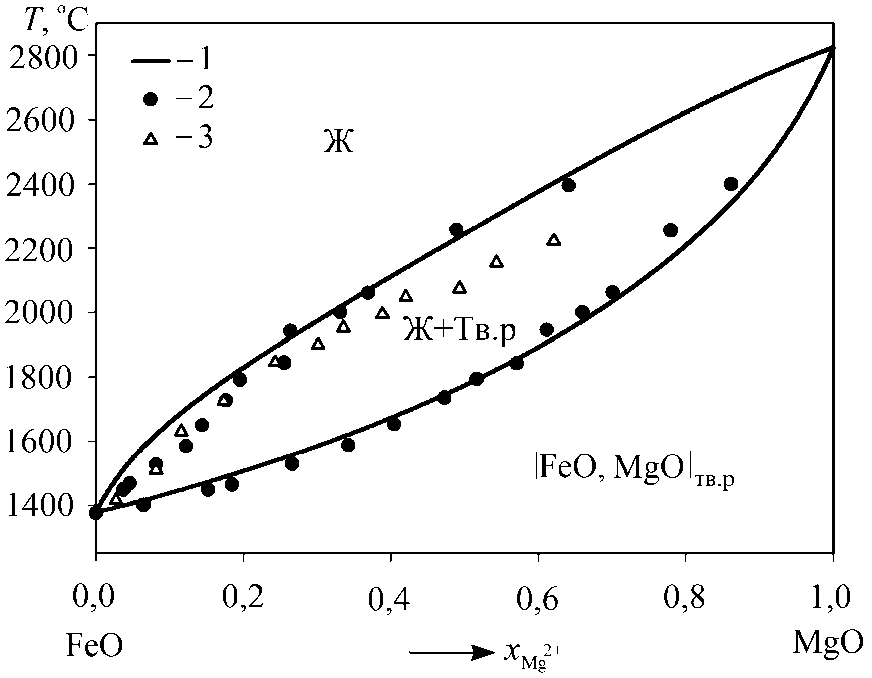
Рис. 1. Фазовая диаграмма системы FeO–MgO: 1 – результаты моделирования; 2 – экспериментальные данные H. Schenck и
W. Pfaff [8]; 3 – экспериментальные данные R. Scheel [9]
и оксида магния в твердом растворе. Согласно этим данным активности оксида железа и оксида магния в твердом растворе |FeO, MgO| тв.р характеризуются положительными отклонениями от закона Рауля.
Результаты выполненного в ходе настоящей работы расчета активностей компонентов твердого раствора |FeO, MgO| тв.р по теории регулярных ионных растворов для температур 1400 и 1600 °С приведены на рис. 2. Согласно расчету для выбранных температур активности оксида железа и оксида магния в магне-зиовюстите имеют небольшие положительные отклонения от закона Рауля.
Согласно литературным данным [12, 13] в системе FeO–Cr 2 O 3 имеется соединение FeCr 2 O 4 (феррохромит). По данным A. Hoffmann [12], данное соединение плавится инконгруэнтно при температуре порядка 1640 °С, что опровергается в более поздней работе Б.Ф. Белова и др. [13], согласно которой феррохромит имеет конгруэнтный характер плавления при температуре 2100 ± 30 °С.
Результаты проведенного в ходе настоящей работы расчета диаграммы состояния системы FeO–Cr 2 O 3 приведены на рис. 3. Координаты точек нонвариантных равновесий в системе FeO–Cr 2 O 3 приведены в табл. 3.
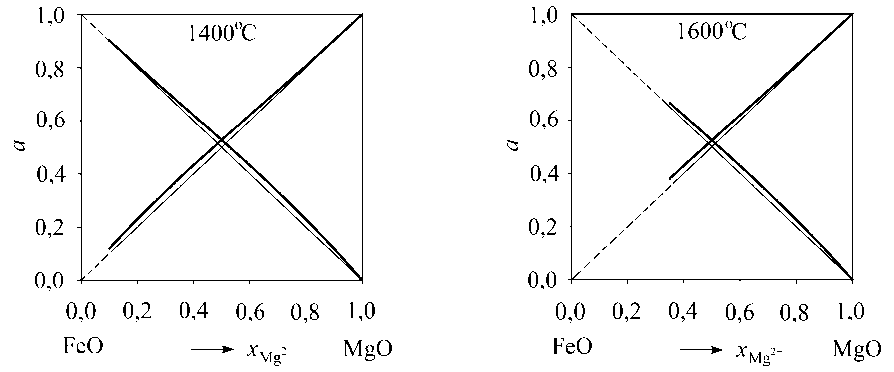
а)
б)
Рис. 2. Результаты расчета активностей компонентов твердого раствора |FeO, MgO| тв.р для температур (°С): а) 1400; б) 1600
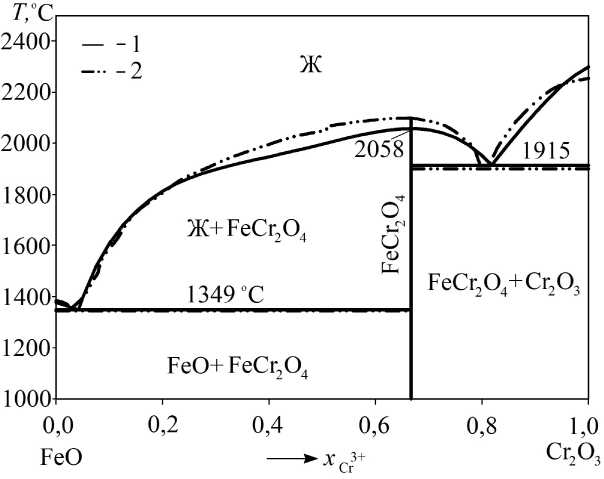
Рис. 3. Фазовая диаграмма системы FeO–Cr 2 O 3 : 1 – результаты моделирования; 2 – экспериментальные данные Б.Ф. Белова и др. [13]
Таблица 3
Координаты точек нонвариантных равновесий в системах FeO–Cr 2 O 3 и MgO–Cr 2 O 3
|
Равновесие |
x Cr 3 + |
T , °С |
|
«Ж–FeO–FeCr 2 O 4 » |
0,0237 [13] |
1345 ± 10 [13] |
|
0,0420 [наш расчет] |
1349 [наш расчет] |
|
|
«Ж–FeCr 2 O 4 –Cr 2 O 3 » |
0,8033 [13] |
1900 ± 20 [13] |
|
0,8180 [наш расчет] |
1915 [наш расчет] |
|
|
«Ж–|MgO| тв.р –MgCr 2 O 4 » |
0,4962 [14] |
2350 [14] |
|
0,4906 [15] |
2340 [15] |
|
|
0,4848 [наш расчет] |
2340 [наш расчет] |
|
|
«Ж–MgCr 2 O 4 –Cr 2 O 3 » |
0,9151 [15] |
2234 [15] |
|
0,9289 [наш расчет] |
2220 [наш расчет] |
Температура плавления феррохромита согласно проведенному моделированию составила 2058 °С (см. рис. 3), что удовлетворительно согласуется с данными работы [13]. Согласно результатам моделирования энтальпия образования феррохромита из компонентов оксидного расплава составляет 157 376 Дж/моль, а энтропия равняется 44,71 Дж/(моль·К).
Согласно экспериментальным данным [14] в системе MgO–Cr2O3 помимо соединения MgCr2O4 (магнезиохромит) имеется также твердый раствор на основе оксида магния (рис. 4). Растворимость оксида хрома в твердом оксиде магния по данным [14] при высоких температурах достаточно велика и составляет 47 мас. % Cr2O3 (xCr3+ = 0,3199) при температуре 2350 °С (см. рис. 4). С другой стороны, по результатам моделирования группы авторов [15] растворимость оксида хрома в твердом оксиде магния не превышает 12,85 мол. % (xCr3+ = 0,2277) при температуре 2340 °С (см. рис. 4). Согласно проведенному нами моделированию (см. рис. 4) растворимость оксида хрома в твердом оксиде магния составляет xCr3+ = 0,2143 при 2340 °С.
Координаты точек нонвариантных равновесий в системе MgO–Cr2O3 приведены в табл. 3. Литературные данные [14, 15] по температуре плавления соединения MgCr 2 O 4 совпадают и составляют 2397 °С, что было учтено нами при проведении моделирования. Также
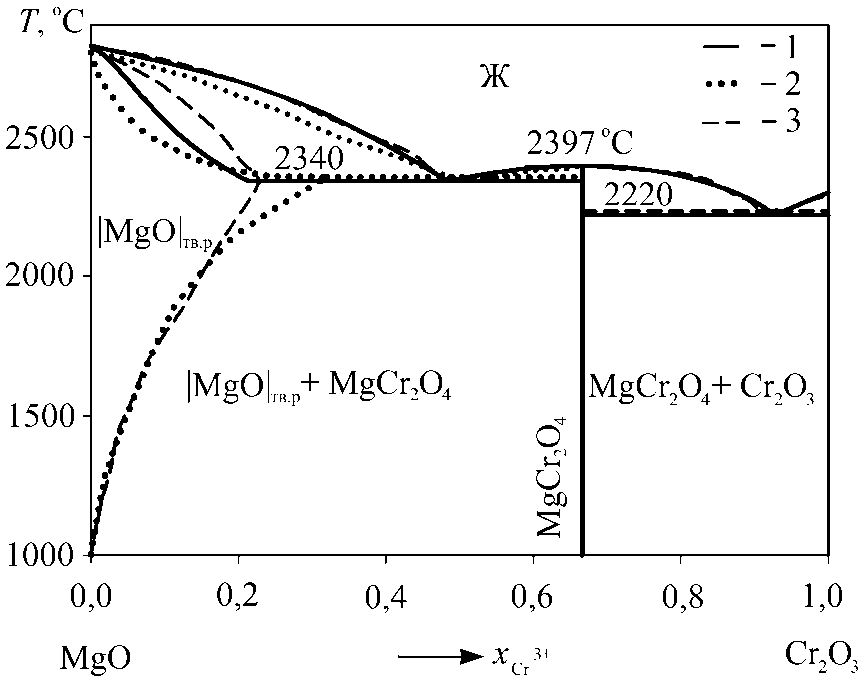
Рис. 4. Фазовая диаграмма системы MgO–Cr 2 O 3 : 1 – результаты моделирования; 2 – экспериментальные данные A.M. Alper и др. [14];
3 – расчетные данные I.-H. Jung и др. [15]
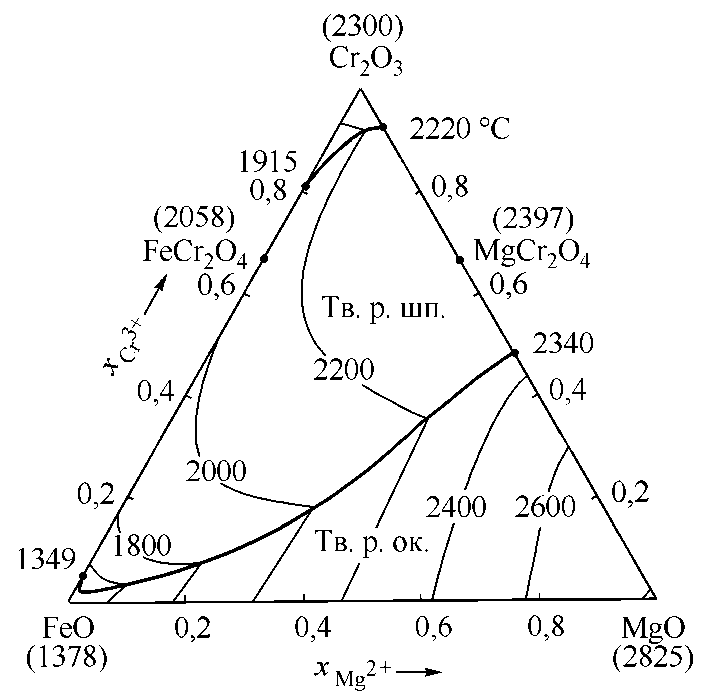
Рис. 5. Фазовая диаграмма системы FeO–MgO–Cr 2 O 3 : полная проекция поверхности ликвидуса
методика используемого в данной работе моделирования позволила оценить энтальпию и энтропию образования магнезиохромита из компонентов оксидного расплава, эти величины оказались равными 389100 Дж/моль и 123,19 Дж/(моль·К) соответственно.
Фазовая диаграмма системы FeO–MgO– Cr 2 O 3 в литературе изучена частично. Так, известно о наличии непрерывного ряда твердых растворов в псевдобинарной системе FeCr 2 O 4 –MgCr 2 O 4 [16, 17]. Результаты расчета, выполненного в ходе настоящего исследования, координат полной проекции поверхности ликвидуса диаграммы состояния системы FeO–MgO–Cr 2 O 3 приведены на рис. 5.
На диаграмму (см. рис. 5) нанесены изотермы с шагом в 200 °С в интервале температур от 1600 до 2800 °С. Диаграмма состояния системы FeO–MgO–Cr2O3 характеризуется обширными областями равновесия оксидного расплава с твердыми растворами оксидов (Тв. р. ок.) и с твердыми растворами шпинелей (Тв. р. шп.).
При моделировании фазовых равновесий с участием твердых растворов оксидов в системе FeO–MgO–Cr2O3 принимались во внимание неограниченная растворимость оксида железа в оксиде магния и ограни- ченная растворимость оксида хрома в оксиде магния.
Выводы
Проведено термодинамическое моделирование диаграмм состояния оксидных систем FeO–MgO, FeO–Cr 2 O 3 , MgO–Cr 2 O 3 и FeO–MgO–Cr 2 O 3 . Определены термодинамические модели и их параметры, необходимые для описания фазовых диаграмм исследуемых систем. Полученные результаты по расчету координат линий ликвидуса двойных оксидных систем FeO–MgO, FeO–Cr 2 O 3 , MgO–Cr 2 O 3 согласуются с литературными данными, что подтверждает применимость алгоритмов моделирования для исследуемых систем. По результатам расчета определены энтальпии и энтропии образования соединений FeCr 2 O 4 и MgCr 2 O 4 из компонентов оксидного расплава систем FeO–Cr 2 O 3 и MgO–Cr 2 O 3 соответственно. Впервые получены результаты по расчету координат полной проекции поверхности ликвидуса тройной оксидной системы FeO–MgO–Cr 2 O 3 . Диаграмма состояния системы FeO–MgO–Cr 2 O 3 характеризуется обширными областями равновесия оксидного расплава с твердыми растворами оксидов и с твердыми растворами шпинелей.
Список литературы Термодинамическое моделирование фазовых диаграмм оксидных систем FeO-MgO, FeO-Cr2O3, MgO-Cr2O3 и FeO-MgO-Cr2O3
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М.: Издат. Дом МИСиС, 2009. - 520 с.
- Михайлов, Г.Г. Фазовые равновесия в многокомпонентных системах с жидкими цветными металлами / Г.Г. Михайлов, Е.А. Трофимов, А.Ю. Сидоренко. - М.: Издат. Дом МИСиС, 2014. - 158 с.
- Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu2O-Al2O3-ZrO2 / О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец и др. // Вестник ЮУрГУ. Серия «Металлургия». - 2015. - Т. 15, № 4. - С. 15-21. DOI: 10.14529/met150402
- Самойлова, О.В. Термодинамическое моделирование фазовой диаграммы системы Cu2O-Na2O-K2O / О.В. Самойлова, Л.А. Макровец, Е.А. Трофимов // Вестник Московского университета. Серия 2: Химия. - 2018. - Т. 59, № 3. - С. 196-204.
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, К.Б. Олкокк. - М.: Металлургия, 1982. - 392 с.
- Darken, L.S. The system iron-oxygen. II. Equilibrium and thermodynamics of liquid oxide and other phases / L.S. Darken, R.W. Gurry // Journal of the American Chemical Society. - 1946. - Vol. 68. - P. 798-816.
- Физико-химические свойства окислов. Справочник / под ред. Г.В. Самсонова. - М.: Металлургия, 1969. - 456 с.
- Schenck, H. Das System Eisen(II)-oxyd-Magnesiumoxyd und seine Verteilungsgleichgewichte mit flüssigem Eisen bei 1520 bis 1750 °С / H. Schenck, W. Pfaff // Archiv für das Eisenhüttenwesen. - 1961. - Vol. 32, no. 11. - P. 741-751.
- DOI: 10.1002/srin.196103268
- Scheel, R. Gleichgewichte im System CaO-MgO-FeOn bei Gegenwart von metallischem Eisen / R. Scheel // Sprechsaal für Keramik, Glas, Baustoffe. - 1975. - Vol. 108. - P. 685-686.
- Prediction of the thermodynamic properties and phase diagrams of silicate systems - evaluation of the FeO-MgO-SiO2 system / P. Wu, G. Eriksson, A.D. Pelton, M. Blander // ISIJ International. - 1993. - Vol. 33, no. 1. - P. 26-35.
- DOI: 10.2355/isijinternational.33.26
- Hasegawa, M. Activity of iron oxide in magnesiowüstite in equilibrium with solid metallic iron / M. Hasegawa, T. Tsukamoto, M. Iwase // Materials Transactions. - 2006. - Vol. 47, no. 3. - P. 854-860.
- Hoffmann, A. Gleichgewichtsuntersuchungen im System Eisen(II)-oxyd-Chrom(III)-oxyd / A. Hoffmann // Archiv für das Eisenhüttenwesen. - 1965. - Vol. 36, no. 3. - P. 155-162.
- DOI: 10.1002/srin.196504069
- Диаграмма фазовых равновесий системы FeO-Cr2O3 / Б.Ф. Белов, И.А. Новохатский, Л.Н. Русаков и др. // Журнал физической химии. - 1968. - Т. XLII, № 7. - С. 1635-1637.
- Phase equilibria in the system MgO-MgCr2O4 / A.M. Alper, R.N. McNally, R.C. Doman, F.G. Keihn // Journal of The American Ceramic Society. - 1964. - Vol. 47, no. 1. - P. 30-33.
- Jung, I.-H. Thermodynamic modeling of the MgO-Al2O3-CrO-Cr2O3 system / I.-H. Jung, S. Decterov, A.D. Pelton // Journal of the American Ceramic Society. - 2005. - Vol. 88, no. 7. - P. 1921-1928.
- DOI: 10.1111/j.1551-2916.2005.00336.x
- Phase equilibria and activities of the constituents in FeO•Cr2O3-MgO•Cr2O3 spinel solid solution saturated with Cr2O3 / M. Hino, K. Higuchi, T. Nagasaka, S. Ban-Ya // ISIJ International. - 1994. - Vol. 34, no. 9. - P. 739-745.
- DOI: 10.2355/isijinternational.34.739
- Jacob, K.T. Thermodynamics and phase equilibria involving the spinel solid solution FexMg1-xCr2O4 / K.T. Jacob, G.N.K. Iyengar // Metallurgical and Materials Transactions B. - 1999. - Vol. 30B, no. 5. - P. 865-871.
- DOI: 10.1007/s11663-999-0091-9


