Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 1. Диаграммы состояния оксидных систем с La 2O 3
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 т.14, 2014 года.
Бесплатный доступ
На основании литературных данных и теории субрегулярных растворов уточнены диаграммы состояний ряда оксидных систем, в состав которых La 2O 3 входит в качестве независимого компонента. Рассмотрены оксидные двойные и тройные диаграммы, сопряженные с областью существования металлических расплавов: FeO-La 2O 3, Al 2O 3-La 2O 3, CaO-La 2O 3, MgO-La 2O 3, Cr 2O 3-La 2O 3, FeO-Cr 2O 3-La 2O 3, FeO-Al 2O 3-La 2O 3, FeO-CaO-La 2O 3, FeO-MgO-La 2O 3. Установлены энергетические параметры теории субрегулярных растворов применительно к оксидным расплавам вышеприведенных систем, установлены теплоты и энтропии плавления для алюминатов и хромита лантана, рассчитаны константы равновесия для процессов образования соединений из компонентов оксидного расплава. Определены координаты линий и поверхности ликвидус для диаграмм состояний FeO-La 2O 3, FeO-Cr 2O 3-La 2O 3, FeO-Al 2O 3-La 2O 3, FeO-CaO-La 2O 3, FeO-MgO-La 2O 3. Для этих диаграмм сведения получены впервые.На основании полученных данных построена поверхность растворимости (ПРКМ) лантана в жидком кислородсодержащем железе. Из вида ПРКМ следует, что раскислительная способность лантана несколько выше, нежели алюминия. Полученные термодинамические данные могут быть использованы для получения сведений о строении ПРКМ для условий комплексного раскисления стали высокоактивными элементами в сочетании с лантаном.
Диаграммы состояния, фазовые равновесия, оксид лантана, термодинамика
Короткий адрес: https://sciup.org/147156885
IDR: 147156885 | УДК: 669.017
Текст научной статьи Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 1. Диаграммы состояния оксидных систем с La 2O 3
Рафинирующие и модифицирующие свойства редкоземельных элементов, к группе которых, помимо лантаноидов, относятся также иттрий и цирконий, постоянно изучаются в исследовательских металлургических лабораториях и научно-исследовательских центрах. Редкоземельные элементы обладают высоким сродством к кислороду, сере, фосфору, некоторым цветным металлам, обладают способностью измельчать структуру литого металла, снижать показатели анизотропии. Имеются сведения о том, что применение для обработки металла комплексных сплавов, содержащих кальций, барий и РЗМ, позволяет повысить коррозионную стойкость трубной стали [1–3]. Все более широкое применение модифицирования РЗМ находят при производстве транспортного металла [4]. Для технических целей обычно используют комплексные сплавы РЗМ, так как их получают из монацитовых концентратов, которые содержат порядка 60 % РЗМ (15 % La2O3, 30–35 % CeO2, 3–4 % Pr, 9–10 % Nd, до 30 % Р). Это так называемый цериевый мишметалл, содержащий 50–55 % Ce, 25–30 % La, 10–15 % Nd, 4–6 % Pr. Достаточно широко используют и другие комплексные сплавы, содержащие кроме РЗМ железо, кремний, кальций, барий. Например, сплавы для модифицирования стали и чугуна, объединенные под маркой JNSteel [5]. Несмотря на сходство химических свойств лантаноидов, разница в них для разных лантаноидов все-таки существует. Например, плотность церия – 8,24 г/см3, лантана – 6,14 г/см3, празеодима – 6,77 г/см3, европия – 5,24 г/см3 [5]. Она проявляется также и в валентности стойких химических оксидных соединений, в раскислительной способности отдельных элементов, температуре плавления самих элементов. Эта разница совершенно незначительна, но это может повлиять на выбор оптимальных составов модифицирующих и рафинирующих сплавов, содержащих комплекс редкоземельных элементов. Поэтому необходимо рассмотреть рафинирующую способность каждого из редкоземельных элементов в отдельности.
Модифицирующие возможности РЗМ связаны с тем, что растворимость их в жидком железе в зависимости от температуры неограниченна, а растворимость при кристаллизации расплава – падает вплоть до десятых долей процента. РЗМ концентрируются в низкотемпературных эвтектиках, формирующихся по границам зерен, участвуют в формировании вторичных и третичных мелкодисперсных оксидов, сульфидов, нитридов и даже интерметаллидов. Для того, чтобы разобраться в этих вопросах, необходимо начать с выполнения термодинамического анализа взаимодействия отдельных, конкретных металлов, относящихся к РЗМ, с неметаллическими примесями в металле. К сожалению, проведение такого анализа затруднено отсутствием достаточной физикохимической информации. Так, в значительной степени затруднен термодинамический анализ оксидных диаграмм состояния, сопряженных с областью существования жидкого металла. По диаграмме состояния FeO–La2O3 известны только температуры и теплоты плавления FeO и La2O3. Сравни- вая свойства La2O3 с другими лантаноидами, пришли к выводу о том, что диаграмма состояний FeO–La2O3 должна иметь вид диаграммы с простой эвтектикой. Вид этой диаграммы состояний был установлен с использованием теории совершенных ионных растворов и представлен на рис. 1.
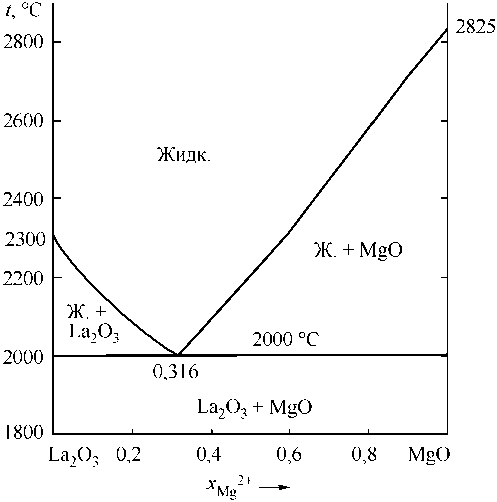
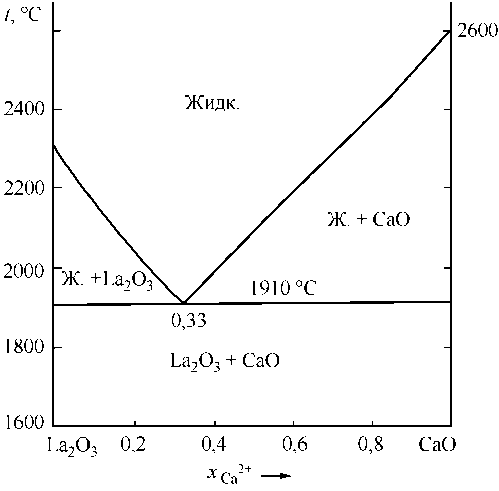
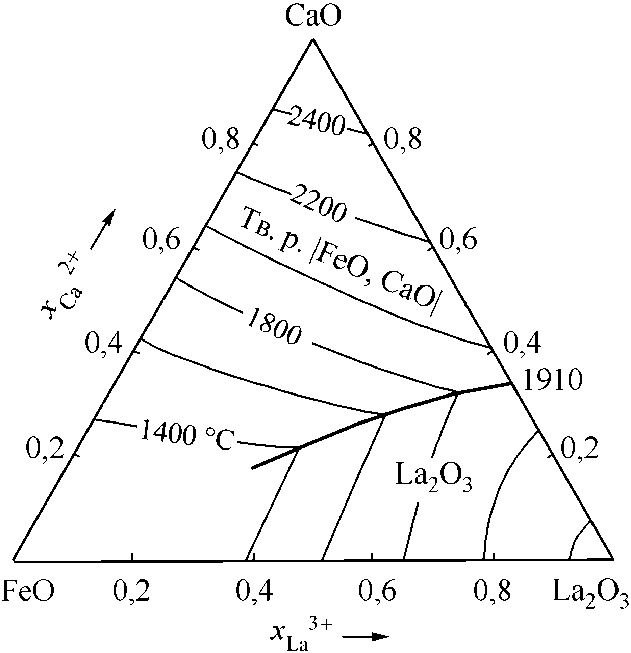
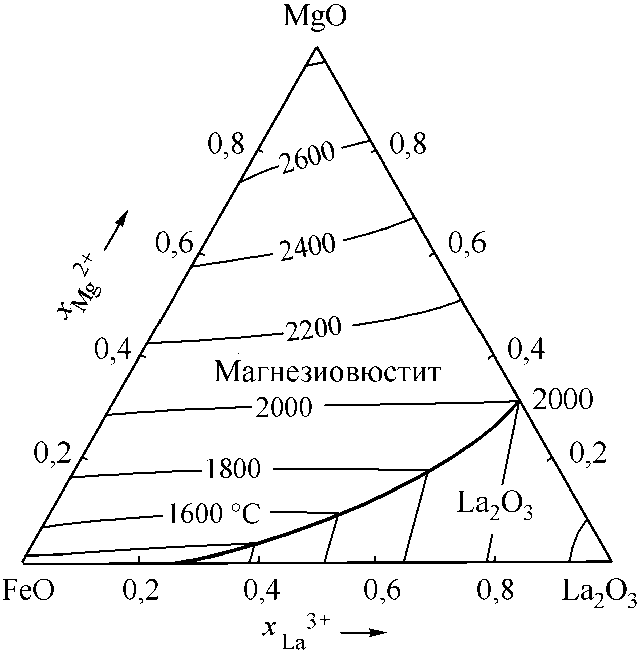
Для дальнейших рассуждений понадобятся сведения о системе MgO–La2O3. По этой диаграмме в дополнение к свойствам MgO и La2O3 известны координаты эвтектики (48 мол. % MgO и (2000 ± 15) °С [6]; 50 мол. % MgO и (1955 ± 15) °С [7]). В расчетах использованы координаты точки эвтектики – 50 мол. % MgO и 1970 °С. На рис. 2, а приведены координаты линии ликвидус системы MgO–La2O3, определенные с помощью теории субрегулярных ионных растворов. Для расчетов использовались зависимости констант равновесия для реакций плавления оксидов, реакций взаимодействия элементов в жидком металле с кислородом с образованием жидкой и твердой фазы (табл. 1). В табл. 2 приведены параметры теории субрегулярных ионных растворов для двух- и трехкомпонентных оксидных расплавов. На рис. 2, б расчетным путем установлены координаты диа-
Рис. 1. Расчетная диаграмма состояния системы FeO–La 2 O 3
а)
Рис. 2. Расчетные диаграммы состояния систем: а) La 2 O 3 –MgO; б) La 2 O 3 –CaO
б)
Таблица 1
Зависимости констант равновесия от температуры для оксидов
|
Оксид |
lg K пл |
lg K ж |
lg K тв |
|
FeO |
–1749/ Т + 1,062 |
–6320/ Т + 2,734 |
–8069/ Т + 5,8 |
|
La 2 O 3 |
–4372/ T +1,617 |
–58 115/ Т + 12,57 |
–62 050/ Т + 14,10 |
|
MgO |
–3016/ Т + 1,37 |
–22 457/ Т + 6,54 |
–26 500/ T + 7,85 |
|
CaO |
–2623/ Т + 0,913 |
–31 480/ Т +12,55 |
–34 103/ Т + 13,46 |
|
Al 2 O 3 |
–5683/ Т + 2,447 |
–58 320/ Т + 18,02 |
–64 000/ Т + 20,48 |
|
Cr 2 O 3 |
–6557/ Т + 2,519 |
–33460/ Т +14,85 |
–40 014/ Т + 17,37 |
Таблица 2
Подобранные значения параметров теории субрегулярных ионных растворов
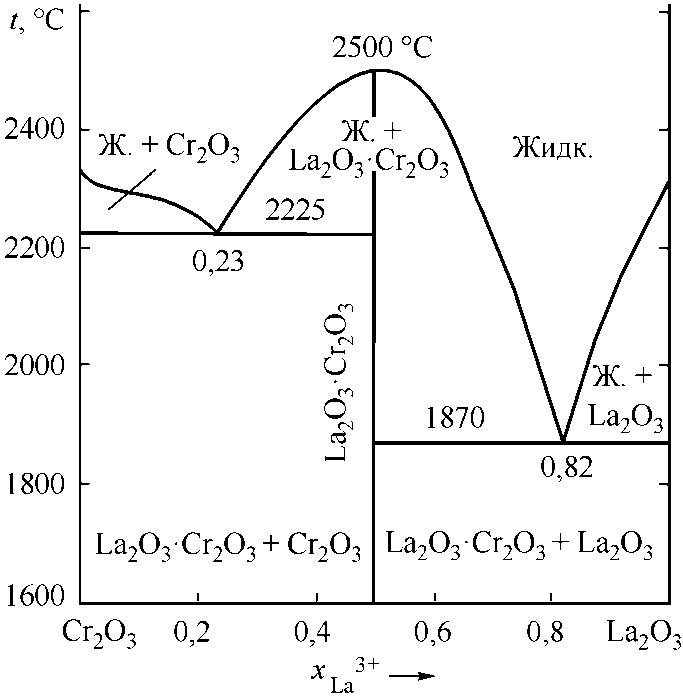
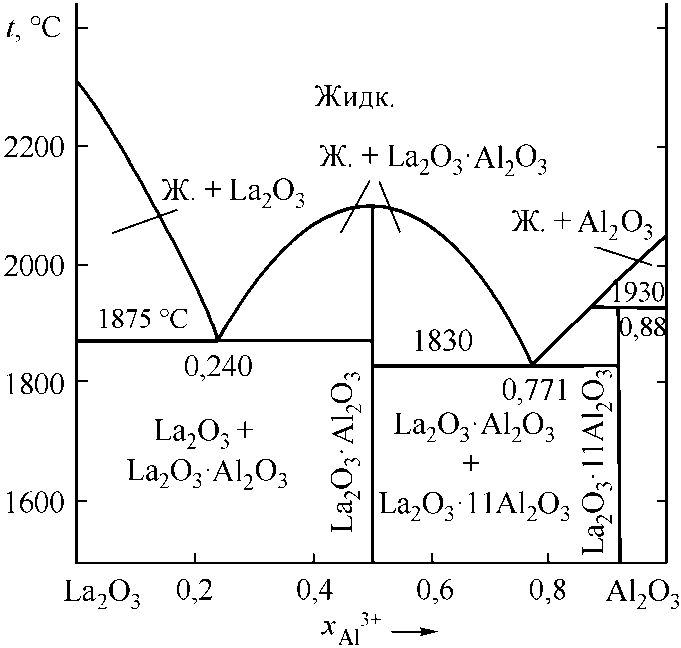
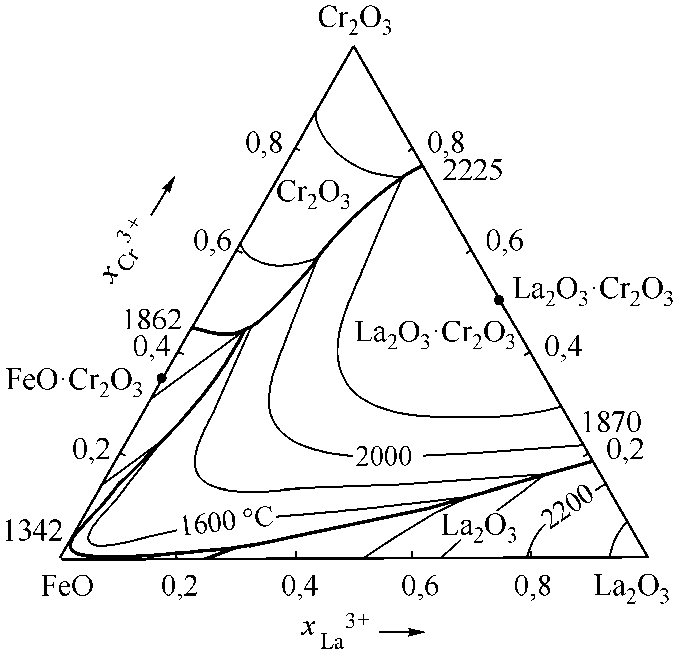
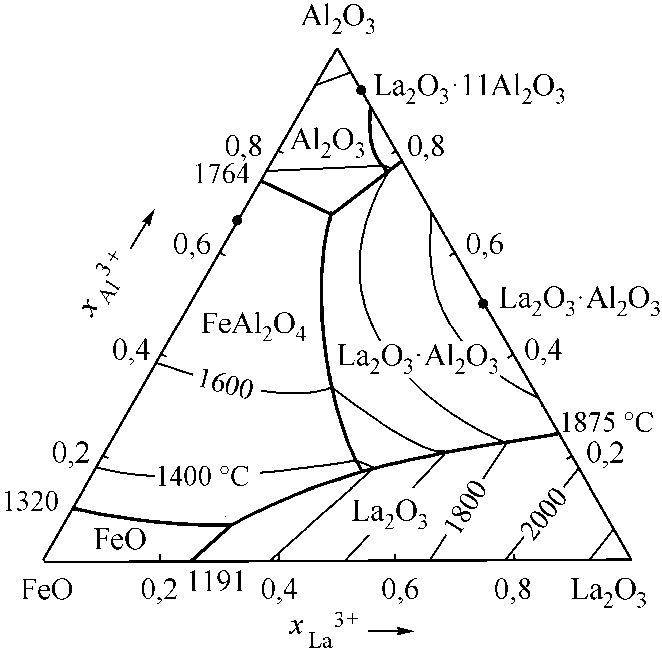
Несколько сложнее рассчитывались диаграммы состояний Cr2O3–La2O3 (рис. 3, а) и Al2O3–La2O3 (рис. 3, б). На диаграмме состояний Cr2O3–La2O3 отмечается наличие одного конгруэнтно плавящегося соединения [6, 9]. В системе Al2O3–La2O3 необходимо учитывать соединение Al2O3·La2O3 с конгруэнтной точкой плавления и соединение Al2O3·11La2O3 с инконгруэнтным плавлением [6, 10]. В табл. 3 и 4 приведены литературные и заложенные в расчеты опорные точки этих диаграмм.
В табл. 5 приведены константы равновесия для образования и плавления соединений. Константы плавления алюминатов и хромита лантана были подобраны в данной работе. Также в этой таблице приведены данные по герциниту и хромиту железа.
Если учитывать взаимодействие с кислородом одного из раскисляющих компонентов и лантана, необходимо знать координаты в данном случае
а)
Рис. 3. Расчетные диаграммы состояния систем: а) Cr 2 O 3 –La 2 O 3 ; б) La 2 O 3 –Al 2 O 3
б)
Инвариантные точки системы Cr 2 O 3 –La 2 O 3
Таблица 3
|
Фаза |
Процесс |
Состав, x La3 + |
Температура, °С |
||
|
Расчет |
[9] |
Расчет |
[9] |
||
|
Cr2O3 + La2O3·Cr2O3 + жидкость |
Эвтектика |
0,230 |
0,262 |
2225 |
2225 |
|
La 2 O 3 ·Cr 2 O 3 + жидкость |
Конгр. плавление |
0,5 |
0,5 |
2500 |
2500 |
|
La2O3·Cr2O3 + La2O3 + жидкость |
Эвтектика |
0,82 |
0,882 |
1870 |
1870 |
Таблица 4
Инвариантные точки системы La 2 O 3 –Al 2 O 3
|
Фаза |
Процесс |
Состав, x A 3 + |
Температура, °С |
||
|
Расчет |
[6] |
Расчет |
[6] |
||
|
La2O3 + La2O3·Al2O3 + жидкость |
Эвтектика |
0,240 |
0,262 |
1875 |
1875 |
|
La2O3·Al2O3 + жидкость |
Конгр. плавление |
0,5 |
0,5 |
2100 |
2100 |
|
La2O3·Al2O3 + La2O3·11Al2O3 + жидкость |
Эвтектика |
0,78 |
0,762 |
1830 |
1830 |
|
La2O3·11Al2O3 + жидкость |
Инконгр. плавление |
0,917 |
0,917 |
1930 |
1930 |
|
La2O3·11Al2O3 + Al2O3 + жидкость |
Эвтектика |
0,881 |
0,882 |
1930 |
1930 |
Таблица 5
Зависимости констант равновесия от температуры для соединений
а)
б)
Рис. 4. Расчетные диаграммы состояния систем: а) FeO–La 2 O 3 –Cr 2 O 3 ; б) FeO–La 2 O 3 –Al 2 O 3 ; в) FeO–La 2 O 3 –CaO; г) FeO–La 2 O 3 –MgO (см. также с. 9)
в)
г)
Рис. 4. Окончание
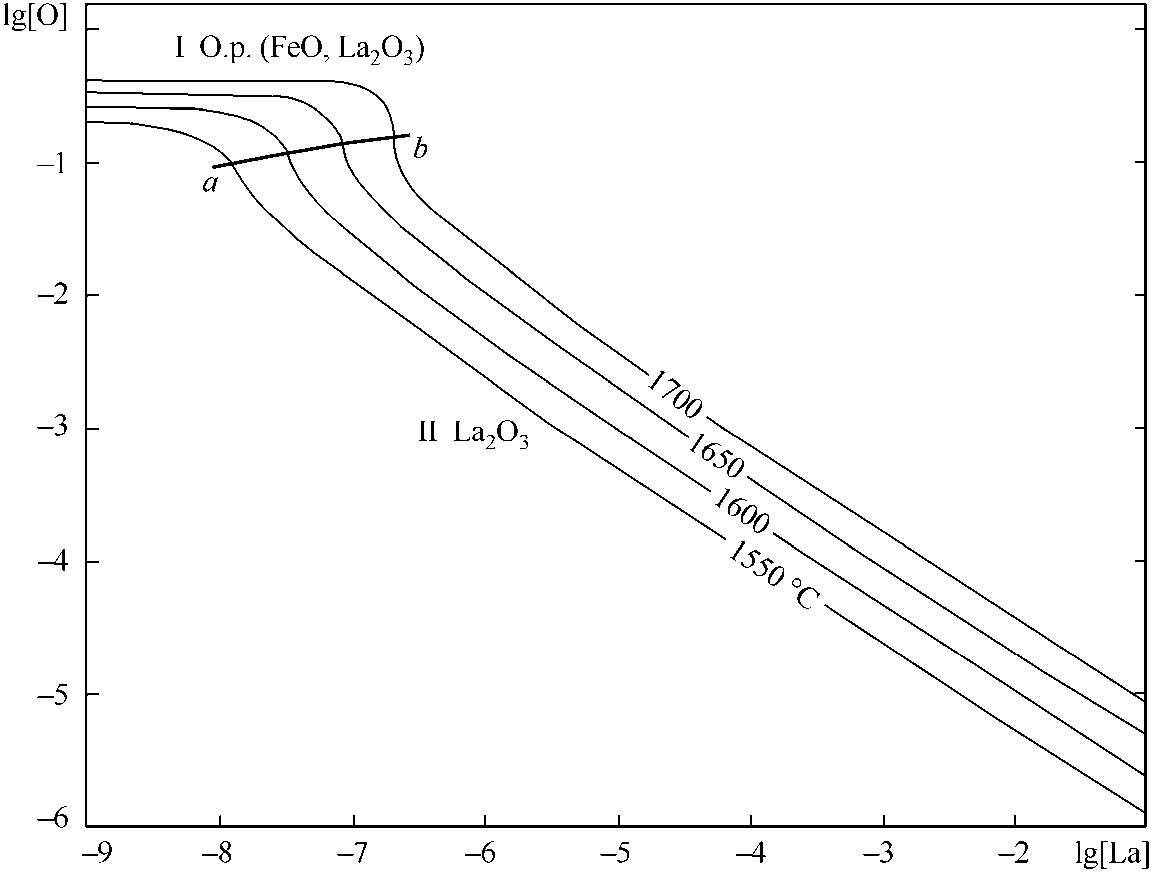
Рис. 5. ПРКМ системы Fe–La–O
в жидком металле систем Fe–La–O, Fe–Cr–La–O, Fe–Al– La–O, Fe–Ca– La–O, Fe–Mg– La–O. Пример такого построения приведен на рис. 5. В области I заданы составы металла, равновесного с расплавом оксидов, в области II – с твердым La2O3. Известно, что максимальные модифицирующие и рафинирующие возможности РЗМ без снижения ударной вязкости реализуются при остаточном их содержании 0,05–0,07 мас. %, это означает, что такие концентрации лантана в металле могут снизить концентрацию кислорода в жидком металле до следов. Аналогичные расчеты можно провести для других РЗМ – церия, неодима, празеодима, иттрия, и установить области содержания РЗМ комплексного действия или альтернативного. В свою очередь, это позволит подойти осознанно к набору компонентов в сплавах РЗМ.
Выводы
С целью создания базы термодинамических данных изучены оксидные системы La2O3– Me O x ( Me – Fe, Cr, Al, Mg, Ca). Построены соответствующие диаграммы состояний. Подобраны энергетические параметры теории субрегулярных ионных растворов. Также были подобраны константы для плавления и рассчитаны константы образования алюминатов и хромита лантана.
Термодинамические сведения о диаграммах состояния двойных систем использованы при моделировании тройных оксидных систем, что позволило впервые получить информацию о строении диаграмм плавкости FeO–Cr2O3–La2O3, FeO–Al2O3–La2O3, FeO–CaO–La2O3, FeO–MgO–La2O3. Полученные данные о диаграммах состояния сопряженных с жидким металлом оксидных систем позволяют моделировать вид поверхности растворимости компонентов в сложных по составу жидких сплавах на основе железа и состав сплавов для комплексного рафинирования и модифицирования неметаллических включений.
Работа поддержана грантом РФФИ № 13-08-12167.
Список литературы Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 1. Диаграммы состояния оксидных систем с La 2O 3
- Происхождение неметаллических включений и пути снижения загрязненности ими металла/В.А. Голубцов, А.А. Воронин, Т.В. Тетюева и др.//Металлург. -2005. -№ 4. -С. 73-77.
- Рациональная технология модифицирования стали/В.А. Голубцов, Л.Л. Тихонов, В.И. Тазетдинов и др.//Национальная металлургия. -2003. -№ 3. -С. 96-02.
- Таира, Г. Разработка труб для эксплуатации в сероводородной среде/Г. Таира, К. Кобояши//Стали для газопроводных труб и фитингов: сб. ст. -М.: Металлургия, 1985. -С. 226-240.
- Мовенко, Д.А. Совершенствование режимов обработки трубной стали церием/Д.А. Мовенко, Г.И. Котельников, А.Е. Семин//Электрометаллургия. -2012. -№ 8. -С. 7-12.
- Рябчиков, И.В. Модификаторы и технологии внепечной обработки железоуглеродистых сплавов. -М.: ЭКОМЕТ, 2008. -400 с.
- Диаграммы состояния силикатных систем: справ. Вып. первый: Двойные системы/Н.А. Торопов, В.П. Барзаковский, В.В. Лапин, Н.Н. Курцева. -Л.: Наука, Ленингр. отд-ние, 1969. -822 с.
- Лопато, Л.М. Фазовые отношения в системах окись магния -окислы РЗЭ цериевой группы/Л.М. Лопато, Л.И. Лугин, А.В. Шевченко//Журнал неорганической химии. -1971, Т. 16, № 1 -С. 254-257.
- Саркисов, Ю.С. Диаграммы состояния двухкомпонентных систем: метод. указания/Ю.С. Саркисов, И. А. Курзина -Томск: Изд-во Томск. архитектур.-строит. ун-та, 2001-38 с.
- Шевчик, А.П. Резистивные материалы и изделия на основе хромита лантана: автореф. дис. … д-ра техн. наук/А.П. Шевчик. -СПб., 2011 -40 с.
- Арсеньев, П.А. Новые материалы в полупроводниковой электронике/П.А. Арсеньев, А.И Попов, В.А. Филиков -М.: Высш. шк., 1988 -80 с.


