Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y 2O 3
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 4 т.14, 2014 года.
Бесплатный доступ
Изучены оксидные системы, содержащие в качестве независимого компонента Y 2O 3. Установлены квазибинарные и тройные оксидные системы, сопряженные с областью существования жидких расплавов стали, содержащей иттрий и раскисленной высокоактивными элементами - кальцием, магнием, алюминием. Сведений о диаграмме состояний FeO-Y 2O 3, определяющей состав оксидных равновесных фаз с жидким железом, в научной литературе не имеется. По аналогии с диаграммой с La 2O 3 оксидная система FeO-Y 2O 3 может быть описана в приближении теории совершенных ионных расплавов. Используя данные о температурах и теплотах плавления FeO и Y 2O 3, установлена температура эвтектического превращения, состав двойной эвтектики и координаты линий ликвидус. Для двойных диаграмм состояний Y 2O 3-MgO, Y 2O 3-СaO, Y 2O 3-Al 2O 3 определены термодинамические параметры образования алюминатов иттрия (2Y 2O 3•Al 2O 3, Y 2O 3•Al 2O 3, 3Y 2O 3•5Al 2O 3) и соединений Y 2O 3 с оксидом кальция (CaO•2Y 2O 3, CaO•Y 2O 3, 3CaO•Y 2O 3). На основании данных о свойствах кристаллических составляющих рассмотренных двойных и тройных систем и сведений об энергетических параметрах теории субрегулярных растворов построены тройные диаграммы состояний систем FeO-Y 2O 3-CaO, FeO-Y 2O 3-MgO, FeO-Y 2O 3-Al 2O 3. Информация о координатах поверхности ликвидус для этих систем получена впервые. На основании выполненных расчетов построена поверхность растворимости кислорода и иттрия в жидком железе.
Термодинамика, фазовые равновесия, диаграммы состояния, оксид иттрия
Короткий адрес: https://sciup.org/147156897
IDR: 147156897 | УДК: 669.017
Текст научной статьи Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y 2O 3
Значительная часть исследований рафинирующей и модифицируещей способности РЗМ сводится к изучению свойств некоторого обобщенного металла, в котором в основном находятся церий, неодим, празеодим, лантан и некоторое количество иттрия [1]. Можно отметить лишь несколько работ, в которых освещается раскисли-тельная способность иттрия [2, 3]. Сплав (силико-иттрий) используется для некоторых специальных целей и выпускается в крайне незначительных количествах. В современной металлургии иттрий нашел применение при выплавке жаропрочных сплавов на хромовой основе для газовых турбин как антикоррозионная добавка или жаростойкое покрытие [4, 5]. Иттрий высокоактивный металл, обладающий высоким сродством к кислороду и сере [5]. Для того чтобы определить концентрационные пределы рафинирующего и модифицирующего действия иттрия, необходимо установить строение поверхности растворимости компонентов в жидком железе, содержащем иттрий, в которое может быть введены и другие высокоактивные элементы, такие как алюминий, кальций, магний. Для получения достоверных термодинамических данных о раскислительной способности вышеуказанных композиций высокоактивных металлов необходимо иметь сведения о строении оксидных диаграмм состояний, сопряженных с областью существования жидких металлических расплавов. Поэтому в настоящей работе было необходимо
установить вид двойных диаграмм состояний FeO–Y 2 O 3 , Y 2 O 3 –CaO, Y 2 O 3 –MgO и Y 2 O 3 –Al 2 O 3 , а также тройных диаграмм состояний FeO–Y2O3–CaO, FeO–Y 2 O 3 –MgO, FeO–Y 2 O 3 –Al 2 O 3 . Данные по системе FeO–Y 2 O 3 и всем тройным оксидным системам в литературе отсутствуют. Для систем Y 2 O 3 –CaO, Y 2 O 3 –MgO и Y 2 O 3 –Al 2 O 3 имеются сведения об образовании химических соединений, а также температурах и составах двойных эвтектик. С использованием теории субрегулярных ионных оксидных расплавов была реализована возможность построения диаграмм состояний Y2O3–CaO, Y2O3–MgO и Y2O3–Al2O3 по методике, изложенной в монографии [6]. В связи с полным отсутствием данных по диаграмме FeO–Y 2 O 3 допустили, что оксидные расплавы в системе FeO–Y 2 O 3 есть совершенные ионные растворы. Результаты таких расчетов приведены на рис. 1. На рис. 2 представлены результаты термодинамических расчетов координат линий ликвидус для систем Y 2 O 3 –MgO, Y 2 O 3 –CaO, Y2O3–Al2O3. В табл. 1 представлены данные по процессам плавления оксидов, а также реакциям раскисления железа с образованием оксидов соответствующих компонентов. В табл. 2 указаны зависимости констант равновесия реакций образования соединений из соответствующих простых оксидов для диаграмм состояний от температуры Y 2 O 3 –CaO и Y 2 O 3 –Al 2 O 3 . Также в табл. 2 приведены подобранные в данной работе теплоты плавления соединений иттрия с оксидами кальция и
Рис. 1. Расчетная диаграмма состояния системы FeO–Y 2 O 3
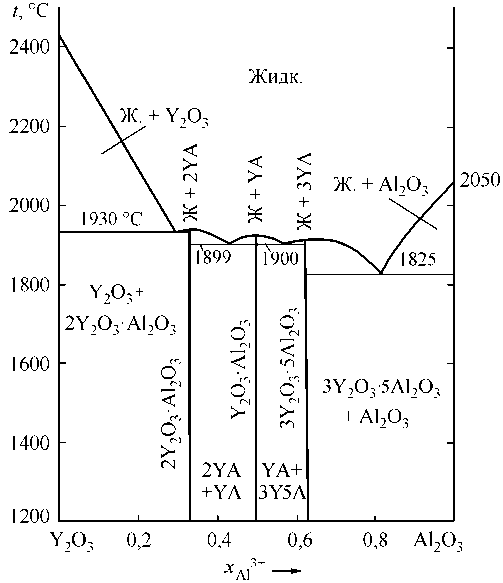
в)
Рис. 2. Расчетные диаграммы состояния систем: а) MgO–Y 2 O 3 ; б) CaO–Y 2 O 3 ; в) Al 2 O 3 –Y 2 O 3
Таблица 1
Зависимости констант равновесия от температуры для оксидов
|
Оксид |
lg K пл |
lg K ж |
lg K тв |
|
FeO |
–1749/ Т + 1,062 |
–6320/ Т + 2,734 |
–8069/ Т + 5,8 |
|
Y 2 O 3 |
–4372/ T +1,617 |
–67 028/ Т + 20,19 |
–71 400/ Т + 21,81 |
|
MgO |
–3016/ Т + 1,37 |
–22 457/ Т + 6,54 |
–26 500/ T + 7,85 |
|
CaO |
–2623/ Т + 0,913 |
–31 480/ Т +12,55 |
–34 103/ Т + 13,46 |
|
Al 2 O 3 |
–5683/ Т + 2,447 |
–58 320/ Т + 18,02 |
–64 000/ Т + 20,48 |
Таблица 2
Теплоты плавления и зависимости констант равновесия от температуры для соединений
|
Соединение |
Δ H пл , кал/моль |
lg K пл |
lg K тв |
|
|
Расчет |
[7] |
|||
|
CaO·2Y 2 O 3 (C2Y) |
58 400 |
58 800 |
–12 769/ Т + 2,25 |
–178 305/ Т + 55,181 |
|
CaO·Y 2 O 3 (CY) |
37 800 |
33 500 |
–8261/ Т + 1,326 |
–106 769/ Т + 34,066 |
|
3CaO·Y 2 O 3 (3CY) |
54 500 |
54 800 |
–11 916/ Т + 0,975 |
–173 384/ Т + 58,815 |
|
2Y 2 O 3 ·Al 2 O 3 (2YA) |
35 840 |
–7833/ Т + 1,482 |
–200 210/ Т + 59,882 |
|
|
Y 2 O 3 ·Al 2 O 3 (YA) |
23 850 |
–5212/ Т + 0,847 |
–130 560/ Т + 39,057 |
|
|
3Y 2 O 3 ·5Al 2 O 3 (3Y5A) |
310 250 |
–67 815/ Т + 25,115 |
–560 500/ Т + 175,785 |
|
Таблица 3
Значения параметров теории субрегулярных ионных растворов Q ijkl
|
Система |
Параметры теории Qijkl , кал/моль |
||
|
FeO–Y 2 O 3 |
0 |
0 |
0 |
|
Y 2 O 3 –Al 2 O 3 |
–4186 |
–1835 |
–7105 |
|
Y 2 O 3 –CaO |
–26 845 |
–42 106 |
–21 622 |
|
Y 2 O 3 –MgO |
5304 |
953 |
2479 |
|
FeO–Y 2 O 3 –Al 2 O 3 |
–50 000 |
20 000 |
–50 000 |
|
FeO–Y 2 O 3 –CaO |
–33 438 |
–54 795 |
–56 469 |
|
FeO–Y 2 O 3 –MgO |
0 |
0 |
0 |
Таблица 4
Инвариантные точки системы Y 2 O 3 –CaO
|
Фаза |
Процесс |
Состав, x Ca 2 + |
Т , °С |
||
|
Расчет |
[7] |
Расчет |
[7] |
||
|
Y2O3 + CaO·2Y2O3 + жидкость |
Эвтектика |
0,117 |
0,111 |
2140 |
2140 |
|
CaO·2Y2O3 + жидкость |
Плавление |
0,200 |
0,200 |
2254 |
2280 |
|
CaO·2Y2O3 + CaO·Y2O3 + жидкость |
Перитектика |
0,360 |
0,440 |
1950 |
– |
|
CaO·Y2O3 + жидкость |
Инконгр. плавление |
0,333 |
0,333 |
||
|
CaO·Y2O3+3CaO·Y2O3 + жидкость |
Эвтектика |
0,434 |
0,400 |
1860 |
1860 |
|
3CaO·Y2O3 + жидкость |
Плавление |
0,600 |
0,600 |
2230 |
2230 |
|
3CaO·Y2O3 +CaO+ жидкость |
Эвтектика |
0,740 |
0,670 |
1960 |
1960 |
Таблица 5
Инвариантные точки системы Y 2 O 3 –Al 2 O 3
|
Фаза |
Процесс |
Состав, x Al 3 + |
Т , °С |
||
|
Расчет |
[8] |
Расчет |
[8] |
||
|
Y 2 O 3 + 2Y 2 O 3 ·Al 2 O 3 + жидкость |
Эвтектика |
0,294 |
0,295 |
1930 |
1930 |
|
2Y 2 O 3 ·Al 2 O 3 + жидкость |
Плавление |
0,333 |
0,333 |
1937 |
1990 |
|
2Y 2 O 3 ·Al 2 O 3 + Y 2 O 3 ·Al 2 O 3 + жидкость |
Эвтектика |
0,431 |
0,440 |
1899 |
1900 |
|
Y 2 O 3 ·Al 2 O 3 + жидкость |
Плавление |
0,5 |
0,5 |
1918 |
1925 |
|
Y2O3·Al2O3 + 3Y2O3·5Al2O3 + жидкость |
Эвтектика |
0,565 |
0,560 |
1900 |
1900 |
|
3Y2O3·5Al2O3 + жидкость |
Плавление |
0,625 |
0,625 |
1905 |
1950 |
|
3Y2O3·5Al2O3 + Al2O3 + жидкость |
Эвтектика |
0,817 |
0,810 |
1825 |
1825 |
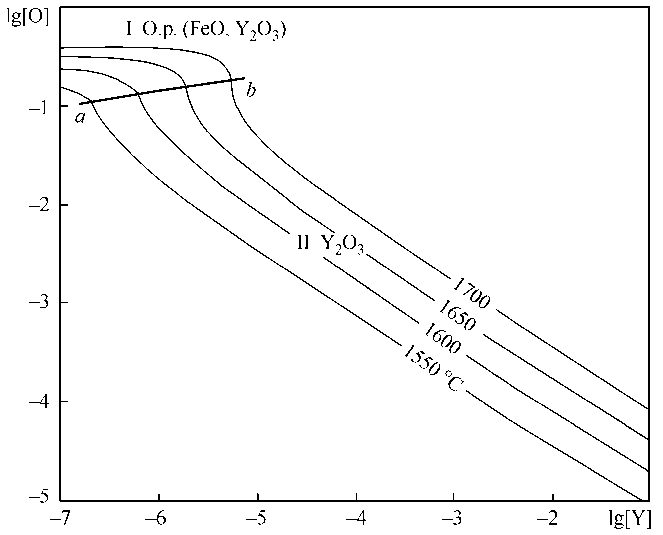
Рис. 4. ПРКМ системы Fe–Y–O
Выводы
-
1. Диаграмма состояний FeO–Y 2 O 3 относится к простейшим диаграммам с простой эвтектикой.
-
2. Определены термодинамические характеристики оксидных расплавов и соединений в двойных диаграммах состояний Y2O3–CaO, Y2O3–MgO и Y2O3–Al2O3 и сформирована база термодинамических данных для учета влияния кальция, магния и алюминия на раскислительную способность иттрия.
-
3. Выполнено термодинамическое моделирование диаграмм состояний FeO–Y2O3–CaO, FeO– Y 2 O 3 –MgO, FeO–Y 2 O 3 –Al 2 O 3 . Установлено отсутствие тройных оксидных соединений. Определены энергетические параметры теории субрегулярных растворов для трехкомпонентных оксидных расплавов. Сформулирована база данных для построения сложных 4-компонентных поверхностей растворимости компонентов в жидком металле.
-
4. Построена политермическая поверхность растворимости иттрия в жидком железе. Раскисли-тельная способность иттрия в жидком железе несколько ниже, нежели раскислительная способность лантана.
-
2. Сенин, А.В. Термодинамика процессов взаимодействия иттрия с кислородом и серой в жидком железе / А.В. Сенин, Г.Г. Михайлов // Изв. вузов. Черная металлургия. – 1987. – № 9. – С. 59–63.
-
3. Тарасюк, Л.И. Термодинамика раскисления железа иттрием / Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков // Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». – 2011. – № 2 (23). – С. 33–38.
-
4. Симс, Ч. Жаропрочные сплавы / Ч. Симс, В. Хагель. – М.: Металлургия, 1976. – 567 с.
-
5. Фабер, Г.Х. Влияние хрома на сопротивление коррозии и сопротивление сплавов и покрытий / Г.Х. Фабер //Жаропрочные сплавы для газовых турбин: материалы междунар. конф. – М.: Металлургия, 1981. – С. 125–141.
-
6. Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов – М.: Издат. Дом МИСИС. – 2009. – 519 с.
-
7. Удалов, Ю.П. Диаграмма плавкости системы CaO–Y2O3–А12О3 / Ю.П. Удалов, З.С. Аппен, В.В. Паршина // Журн. неорган. химии. – 1979. – Т. 24, № 10. – С. 2786–2792.
-
8. Lakiza, S.M. Phase diagram of the Al2O3– HfO2–Y2O3 system / S.M. Lakiza, Ya.S. Tishchenko, L.M. Lopato // Journal of the European Ceramic Society. – 2011. – No. 31 (7). – P. 1285–1291.
Работа поддержана грантом РФФИ № 13-08-12167.
Список литературы Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y 2O 3
- Ферросплавы с редкоземельными и щелочноземельными металлами/И.В. Рябчиков, В.Г. Мизин, Н.П. Лякишев и др. -М.: Металлургия. 1983. -272 с.
- Сенин, А.В. Термодинамика процессов взаимодействия иттрия с кислородом и серой в жидком железе/А.В. Сенин, Г.Г. Михайлов//Изв. вузов. Черная металлургия. -1987. -№ 9. -С. 59-63.
- Тарасюк, Л.И. Термодинамика раскисления железа иттрием/Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков//Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». -2011. -№ 2 (23). -С. 33-38.
- Симс, Ч. Жаропрочные сплавы/Ч. Симс, В. Хагель. -М.: Металлургия, 1976. -567 с.
- Фабер, Г.Х. Влияние хрома на сопротивление коррозии и сопротивление сплавов и покрытий/Г.Х. Фабер//Жаропрочные сплавы для газовых турбин: материалы междунар. конф. -М.: Металлургия, 1981. -С. 125-141.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов -М.: Издат. Дом МИСИС. -2009. -519 с.
- Удалов, Ю.П. Диаграмма плавкости системы CaO-Y2O3-А12О3/Ю.П. Удалов, З.С. Аппен, В.В. Паршина//Журн. неорган. химии. -1979. -Т. 24, № 10. -С. 2786-2792.
- Lakiza, S.M. Phase diagram of the Al2O3-HfO2-Y2O3 system/S.M. Lakiza, Ya.S. Tishchenko, L.M. Lopato//Journal of the European Ceramic Society. -2011. -No. 31 (7). -P. 1285-1291.


