Термодинамическое моделирование фазовых равновесий в оксидных системах, содержащих B 2o 3
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Смирнов Леонид Андреевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 4 т.14, 2014 года.
Бесплатный доступ
Микролегирование стали бором позволяет при надлежащей технологии выплавки получить путем термообработки высокие механические свойства стали при значительной экономии легирующих компонентов. При этом получения высокой прокаливаемости стали и измельчения первичного литого зерна удается достигнуть при наличии в металлической матрице в виде твердого раствора 0,002-0,008 мас. % бора, не связанного в химические оксидные, сульфидные и нитридные соединения. Бор после введения в сталь необходимо предохранять от взаимодействия с кислородом, серой и азотом. Для понимания сложных процессов, происходящих при введении бора в сталь, нужно последовательно изучить взаимодействие бора с кислородом, серой, азотом в присутствии в металле алюминия, титана, кальция, магния, кремния. В настоящей работе проведена подготовка к моделированию термодинамического взаимодействия компонентов (Al, Si, Ca, Mg, Mn) с кислородом в жидкой стали. С использованием основных положений теории субрегулярных ионных растворов удалось провести моделирование диаграмм состояний оксидных бинарных систем FeO-B 2O 3, B 2O 3-CaO, B 2O 3-MgO, B 2O 3-Al 2O 3, B 2O 3-MnO и B 2O 3-SiO 2 для температур выше 1000 °С, установить вид тройных оксидных систем FeO-B 2O 3-MgO, FeO-B 2O 3-Al 2O 3, FeO-B 2O 3-MnO и FeO-B 2O 3-SiO 2, не приведенных в справочной и оригинальной литературе, и для FeO-B 2O 3-CaO (в литературе приводится только изотермическое сечение при 1600 °С). Показана возможность построения поверхностей растворимости компонентов в борсодержащем металле, раскисленном алюминием. Из вида построенной диаграммы следует, что алюминий является эффективным элементом для защиты бора от окисления после введения бора в сталь. Аналогичная информация может быть получена для описания защитных действий других элементов.
Оксид бора, диаграммы состояний, термодинамика, фазовые равновесия
Короткий адрес: https://sciup.org/147156890
IDR: 147156890 | УДК: 669.017.3
Текст научной статьи Термодинамическое моделирование фазовых равновесий в оксидных системах, содержащих B 2o 3
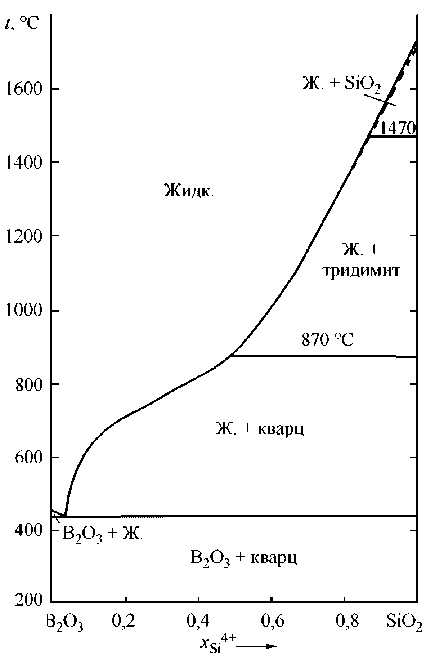
Микролегирование стали бором является перспективным направлением в металлургии конструкционных марок сталей, позволяющим снизить расходы на легирование дорогостоящими металлами и повысить механические и технологические свойства стали. Микролегирование бором изменяет характер кристаллизации, строение приграничных зон зерна в литом слитке, снижает анизотропию. Особую роль в повышении механических свойств борсодержащей стали играет режим рафинирования стали. Легирование бором достигает максимального влияния на прокаливаемость и ударную вязкость при наличии так называемого эффективного бора, растворенного в металлической решетке с содержанием в металлической матрице от 0,002 до 0,008 мас. %. Повышает эффективность легирования бором рациональное введение РЗМ, вольфрама и молибдена. Непосредственно в жидком металле бор может взаимодействовать не только с кислородом, но и с технологическим шлаком. Конечно же, снизить количество эффективного бора в металле может его взаимодействие с азотом и, в меньшей степени, с серой. Его раскислительная способность чуть ниже раскислительной способности кремния и близка к раскислительной способности марганца и ванадия. Но при этом следует учитывать, что бор может взаимодействовать с кислородом, входя в состав комплексных оксидных фаз, жидкоподвижных шлаковых включений. Для того чтобы получить информацию о влиянии рафинирующих добавок в сталь на сохранение эффективного бора, необходимо построить поверхности растворимости для многокомпонентных систем – кислорода, азота и серы в стали. Но в начале надо установить влияние каждого из указанных выше факторов. В настоящей работе планируется подготовить данные к последующим определениям раскислительной способности бора, установить особенности процессов раскисления борсодержащей стали алюминием, кремнием, кальцием, магнием и титаном. Для выполнения системного анализа необходимо установить оксидные фазы, сопряженные с областью существования жидкого металла. Данные по оксидной системе FeO–B2O3 приведены в работах [1–2], по системе B2O3–SiO2 [3–5], по системе B2O3–Al2O3 [1, 6], по системам B2O3–MnO, B2O3–CaO и B2O3–MgO в справочнике [1]. С использованием теории субрегулярных ионных оксидных расплавов удалось установить основные параметры фаз переменного состава и реализовать возможность построения диаграмм состояний оксидных систем FeO–B2O3, B2O3–CaO, B2O3–MgO, B2O3–Al2O3, B2O3–MnO и B2O3–SiO2 для температур выше 1000 °С. Расчетами установлены координаты линий ликвидус для условий равновесия с оксидами кальция, магния, марганца, алюминия, кремния и бора, а также для областей расслаивания жидких оксидных фаз. Результаты таких расчетов приведены на рис. 1. Видно, что все соединения с оксидами бора расположены много ниже температур сталеварения, поэтому термодинамические данные
а)
в)
Рис. 1. Расчетные диаграммы состояний систем с B 2 O 3 : а) FeO–B 2 O 3 ; б) B 2 O 3 –Al 2 O 3 ; в) MnO–B 2 O 3 ; г) B 2 O 3 –SiO 2 ; д) B 2 O 3 –MgO; е) B 2 O 3 –CaO (см. также с. 13)
г)
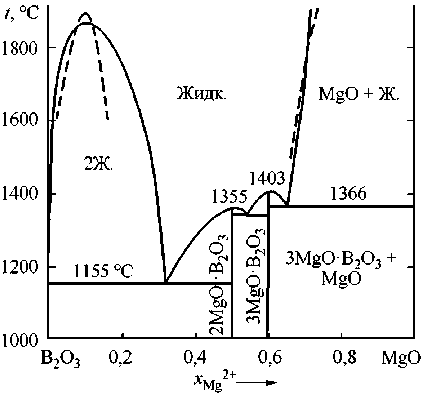
д)
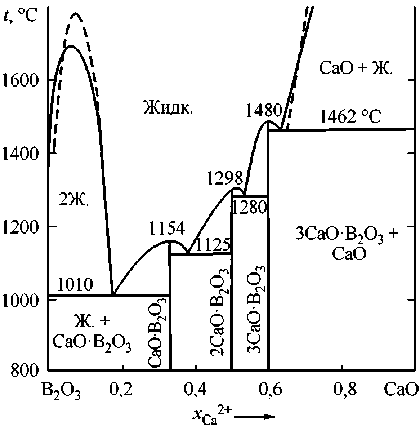
е)
Рис. 1. Окончание
Таблица 1
Зависимости констант равновесия от температуры для оксидов
|
Оксид |
lg K пл |
lg K ж |
lg K тв |
|
FeO |
–1749/ Т + 1,062 |
–6320/ Т + 2,734 |
–8069/ Т + 5,8 |
|
В 2 O 3 |
–1257/ Т + 1,738 |
–44 005/ Т + 15,615 |
|
|
MgO |
–4044/ Т + 1,305 |
–22 457/ Т + 6,54 |
–26 500/ Т + 7,85 |
|
CaO |
–2623/ Т + 0,913 |
–31 480/ Т +12,55 |
–34 103/ Т + 13,46 |
|
MnO 3 |
–2842/ Т + 1,323 |
–12 175/ Т + 5,45 |
–15 017/ Т + 6,77 |
|
SiO 2 |
–874/ Т + 0,437 |
–30 225/ Т +11,56 |
–31 000/ Т +12,00 |
|
Al2O 3 |
–5683/ Т + 2,447 |
–58 320/ Т +18,02 |
–64 000/ Т +20,48 |
Таблица 2
Подобранные значения параметров теории субрегулярных ионных растворов
В табл. 1 представлены данные по процессам плавления оксидов, а также реакциям раскисления железа с образованием оксидов соответствующих компонентов. В табл. 2 приведены подобранные значения параметров теории субрегулярных ионных растворов для двойных и тройных оксидных систем с B2O3. Индексы 1, 2, 3 отнесены к катио- нам Fe2+ , B3+ и другим составляющим металлических триад.
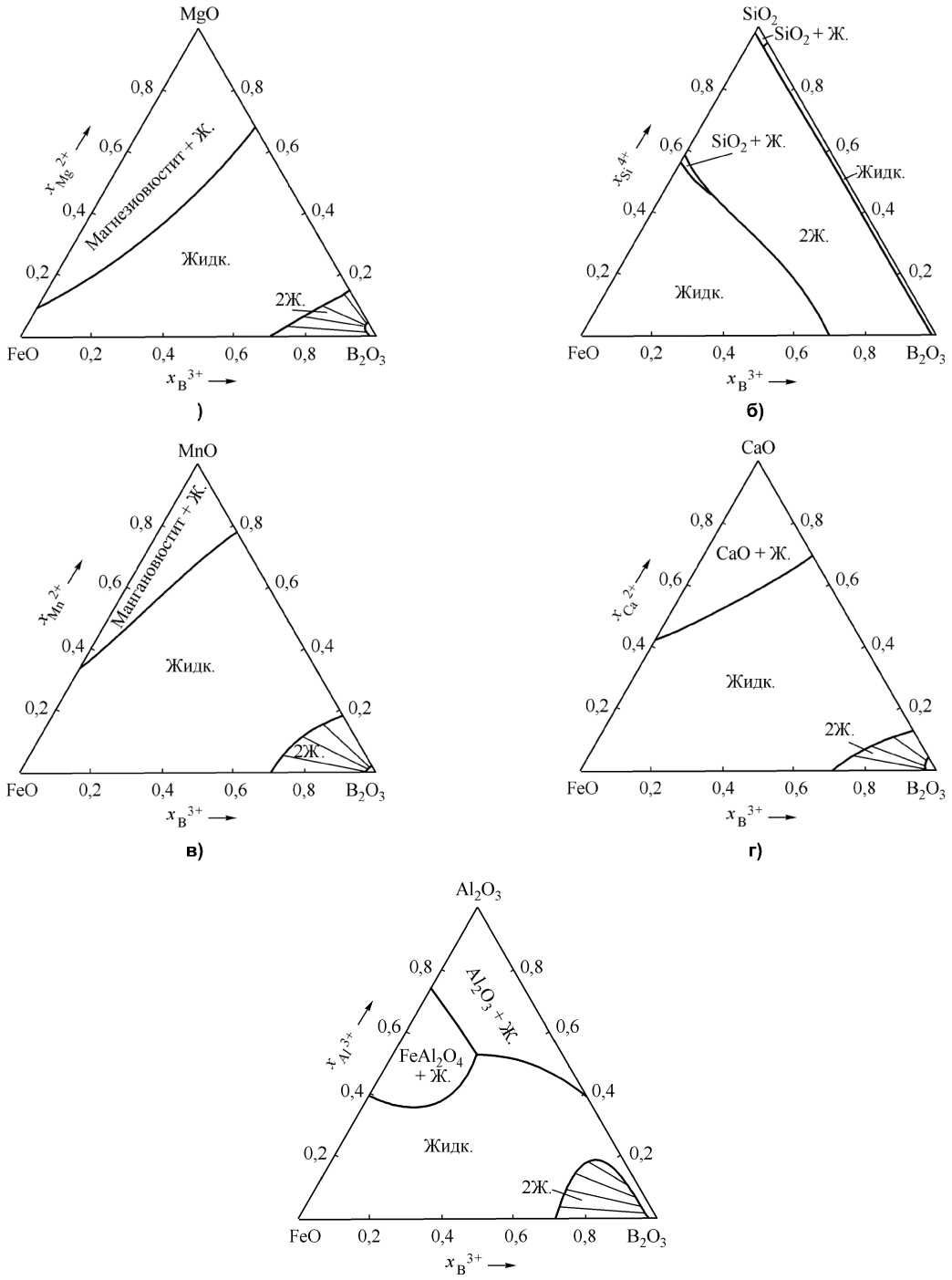
На основании данных табл. 1 и 2 (для бинарных систем), координат линий ликвидус для исследованных двойных систем и основных положений использованной теории субрегулярных ионных растворов удалось провести моделирование диаграмм состояний для тройных оксидных систем FeO–B 2 O 3 –CaO, FeO–B 2 O 3 –MgO, FeO–B 2 O 3 –Al 2 O 3 ,
FeO–B 2 O 3 –MnO и FeO–B 2 O 3 –SiO 2 . Это вызвано тем, что из указанных тройных систем в литературе приведено только одно изотермическое сечение при 1600 °С для системы FeO–B 2 O 3 –CaO [1]. Для остальных необходимые для расчетов координат тройных систем какие-либо сведения о строении поверхностей ликвидус отсутствуют. Из приведенных на рис. 2 изотермических сечений тройных диаграмм состояний следует отметить наличие в
а)
д)
Рис. 2. Расчетные диаграммы состояний: а) FeO–B 2 O 3 –MgO; б) FeO–B 2 O 3 –SiO 2 ; в) FeO–B 2 O 3 –MnO; г) FeO–B 2 O 3 –CaO; д) FeO– B 2 O 3 –Al 2 O 3
углах B 2 O 3 областей расслоения на две жидкости. Имеются большие области жидких оксидных расплавов, содержащих FeO–B 2 O 3 – Me O, где Me О – это оксиды Ca, Mg, Mn, Si, Al. Имеются также двухфазные области магнезиовюстита и мангано-вюстита, равновесных со шлаковыми расплавами переменного состава, CaO с жидкостью, Al 2 O 3 с жидкостью и FeO·Al2O3 с жидкостью, то есть с соответствующими оксидными расплавами. На диаграмме состояний FeO–B 2 O 3 –SiO 2 можно увидеть в основном либо область оксидных расплавов, либо область расслаивания расплавов на высококремнистые и боратные системы.
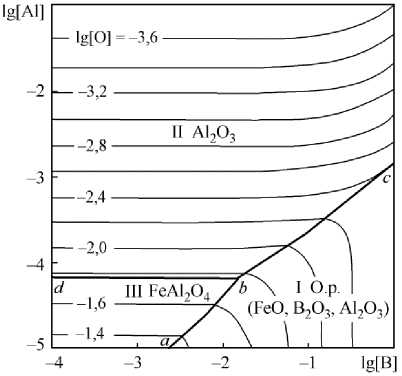
Рис. 3. ПРКМ системы Fe–B–Al–O при 1600 °С
На основании данных табл. 2 и сведений, приведенных на рис. 2, построена поверхность растворимости компонентов в жидком металле для системы Fe–Al–B–O (рис. 3). На этой диаграмме контрастными линиями нанесены составы жидкого металла, равновесного с двумя оксидными фазами, тонкими линиями нанесены изокислородные сечения. Если посмотреть на рис. 3, то при обычных концентрациях раскислителя (алюминия) [Al] = 0,001 и [В] = 0,005 мас. % в равновесии с металлом будет только корунд и, следовательно, бор не будет окисляться кислородом металла.
Из приведенного термодинамического анализа следует, что имеется возможность выйти на формирование комплексных раскислителей для предохранения бора от окисления. Эти данные можно получить при построении ПРКМ для систем Fe–B–Si–O, Fe–B–Ca–O, Fe–B–Mg–O, Fe–B–Mn–O, Fe–B–Ti–O.
Выводы
-
1. Выполнены термодинамические расчеты координат линий ликвидус двойных диаграмм состояний, определяющих природу неметаллических фаз, сопряженных с борсодержащим железом, раскисленным алюминием, кальцием, магнием, кремнием, марганцем.
-
2. Установлены координаты изотермических сечений тройных диаграмм состояний, определяющих состав неметаллических включений, образующихся при раскислении борсодержащего железа алюминием, кальцием, магнием, кремнием и марганцем.
-
3. Установлена принципиальная возможность определения добавок активных элементов для финишной операции рафинирования стали, предохраняющей вводимые в сталь добавки бора от окисления. Построена ПРКМ системы Fe–B–Al–O.
Работа поддержана грантом РФФИ № 13-08-12167.
Список литературы Термодинамическое моделирование фазовых равновесий в оксидных системах, содержащих B 2o 3
- Slag Atlas. 2nd Edition. Edited by Verein Deutscher Eisenhüttenleute (VDEh). -Düsseldorf: Verlag Stahleisen GmbH., 1995. -616 p.
- Acuna, C. Mutual dissolution between matte and ferrite slag./C. Acuna, A. Yazawa//Trans. Japan Inst. Metals. -1986. -Vol. 27, no. 11. -P. 881-889.
- Seifert, H.J. Thermodynamic Databases of Ceramic Materials and Composites/H.J. Seifert, F. Aldinger//Netsu Sokutei. -1997. -24 (4). -P. 188-193.
- Диаграммы состояния силикатных систем. Справочник. Выпуск первый. Двойные системы/Н.А. Торопов, В.П. Барзаковский, В.В. Лапин, Н.Н. Курцева. -Л.: Наука, Ленингр. отд-ние, 1969. -822 с.
- Hoch, M. The Quaternary System B2O3-PbO-SiO2-ZnO: Thermodynamics and Phase Diagram/M. Hoch//Journal of Phase Equilibria. -1996. -Vol. 17, no. 4. -P. 302-310.
- Growth Process of Cu2Al6B4O17 Whiskers/C. Zhu, X. Nai, D. Zhu et al.//Journal of Solid State Chemistry. -2013. -Vol. 197, no. 7. -P. 1-6.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов -М.: Издат. Дом МИСИС. -2009. -519 с.


