Термодинамическое моделирование линии ликвидус системы Ni-Si
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна, Михайлов Геннадий Георгиевич, Трофимов Евгений Алексеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Используя модели регулярных и субрегулярных растворов, рассчитана линия ликвидус диаграммы состояния Ni-Si. Показано, что модель регулярных растворов неудовлетворительно описывает данную систему. Результаты расчета по теории субрегулярных растворов хорошо согласуются с литературными данными. Полученные значения энергетических параметров теории могут быть использованы для термодинамического моделирования более сложных систем.
Теория регулярных растворов, теория субрегулярных растворов, диаграмма состояния системы ni-si
Короткий адрес: https://sciup.org/147160236
IDR: 147160236 | УДК: 544.3.01+544.32
Текст научной статьи Термодинамическое моделирование линии ликвидус системы Ni-Si
Интерес к системе Ni–Si обусловлен большим количеством образующихся в ней силицидов. Известно, что силициды никеля в сплавах системы Cu–Si–Ni существенно упрочняют их [1]. С другой стороны, одной из рекомендуемых [2] методик повышения эффективности удаления никеля из меди при окислительном рафинировании является использование кремния при раскислении меди (так называемое «силицирование»). В работе [3] содержатся данные о возможности отделения силицидов никеля при электрохимическом растворении медного анода. Указывается, что скорость растворения основного материала анода на 2,5–3 порядка больше скорости растворения силицидных фаз.
Ключевой для понимания процессов, реализующихся в системе Cu–Si–Ni, является система Ni–Si, адекватная термодинамическая модель которой откроет путь к моделированию более сложных систем.
Методика исследования
Для моделирования фазовых равновесий, реализующихся в системе Ni–Si, опробовано два подхода: посредством модели регулярных растворов и с помощью модели субрегулярных растворов.
Активность компонентов бинарной системы в приближении теории регулярных растворов описывается выражением [4]:
(1-Ni )2 Q ai = Nie RT . (1)
В соответствии с приближением теории субрегулярных растворов [5] активность компонентов для бинарной системы будет равна
Nj 2( NiQj + NjQji )
a i = N i e RT . (2)
В этих формулах N – атомные доли компонентов раствора; Q – энергии смешения его компонентов; Т – температура; R – универсальная газовая постоянная.
Методика моделирования состоит в следующем. На первом этапе расчета определяются значения энергий смешения Q . Для этого используются данные по температурам и теплотам плавления чистых простых веществ, а также литературные данные о положении некоторых (реперных) точек на линии ликвидус диаграммы состояния. Далее, зная параметры Q и задаваясь значением атомной доли компонентов раствора, рассчитывается вся линия ликвидус для выбранной системы. Следует отметить, что для систем с интерметаллидами, силицидами и т. п. на стадии определения Q требуются данные по константам плавления соединений. Если литературных данных нет, то методика расчета позволяет их оценить.
Согласно диаграмме состояния системы Ni–Si [6] в ходе взаимодействия никеля с кремнием могут образовываться следующие соединения: Ni 3 Si, Ni 5 Si 2 , Ni 2 Si, Ni 3 Si 2 , NiSi и NiSi 2 . В некоторых источниках указывается на существование еще и фаз Ni 31 Si 12 и Ni 25 Si 9 [7, 8] (рис. 1).
Физическая химия
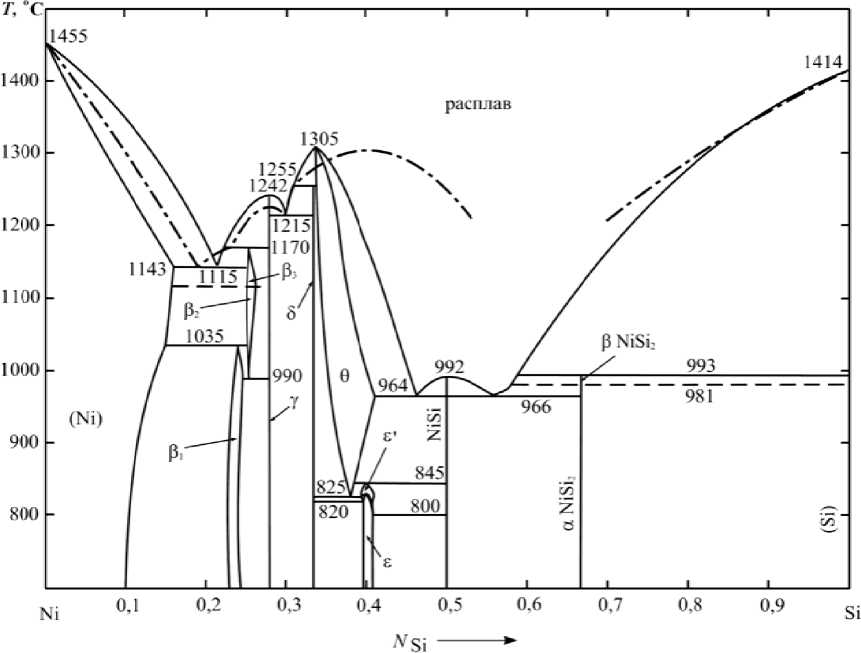
Рис. 1. Диаграмма состояния системы Ni–Si: сплошные линии – литературная диаграмма [8]; пунктир – результат расчета по теории регулярных растворов
Данная диаграмма состояния характеризуется большим количеством двойных соед и нений.
Процесс перехода соединения в жидкое состояние будем описывать сле д ующей реакцией:
|MmNn| = m[M] + n[N].(3)
Здесь |M m N n | – чистое твердое соединение; [М] и [N] – компоненты металли ч еского расплава.
Для реакции (3) закон действующих масс (актив н ость соединения равна 1)
K = «[M]«[N].
Если температурную зависимость константы рав н овесия реакции (3) записать в виде
1g K = -T + B,(5)
то с учетом соотношений (4), (5) можно получить
A m lg «[M] + n lg «[N] + T " B = 0.
Используя выбранные опорные точки диаграммы, а также значения т еплот плавления для никеля и кремния, можно определить значения энергий смешения компон е нтов расплава системы Ni–Si, а также величины A и B для реакций образования из компонентов расплава с илицидов этой системы.
Термодинамические характеристики плавления чистых веществ приведены в табл. 1.
Таблица 1
Температуры и теплоты плавления веществ по данным справочника [9]
|
Вещество |
o T m , С |
A m H O0 , Дж/моль Tm |
|
Si |
1414 |
49789 |
|
Ni |
1455 |
17489 |
Обсуждение результатов
Помимо литературных данных, обобщенных в с п равочнике [8], на ри с . 1 приведена диаграмма состояния, рассчитанная по теории регулярных растворов. Значение энергетического параметра, использованное в ходе расчета, Q = –18741 Дж/моль. Расчет по теории регуляр н ых растворов недостаточно корректно описывает линию ли к видус, а для некоторого интервала значений атомной доли кремния полученные данные не имеют физического смысла и на рис. 1 этот участок линии ликвидус не представлен.
На рис. 2 представлены результаты расчета по теории субрегулярных рас т воров. Полученные результаты вполне согласуются с литературной диаграммой состояния. Однако есть и ряд отличий расчетной диаграммы состояния от литературной. Прежде всего, в избранном нами приближении не учитывалась нестехиометричность состава некоторых силицидов. Допустимос т ь такого упрощения связана с тем, что нас, прежде всего, интересовало положение линии ликви д ус. Фаза Ni 2 Si на расчетной диаграмме конгруэнтно плавится п ри 1305 °С, в то время как по литературным данным это соединение распадается по перитектической реакции. Также пришлось сделать некоторые допущения при описании равновесия распл а ва с силицидом NiSi2. При расчете учитывалась только одна из его кристаллографических модификаций. Полученны е в работе з начения энергетических параметров для теории субрегулярны х растворов приведены в табл. 2, 3. Константы, характеризующие процесс перехода вещества в жидкое состояние, приведены в табл. 4.
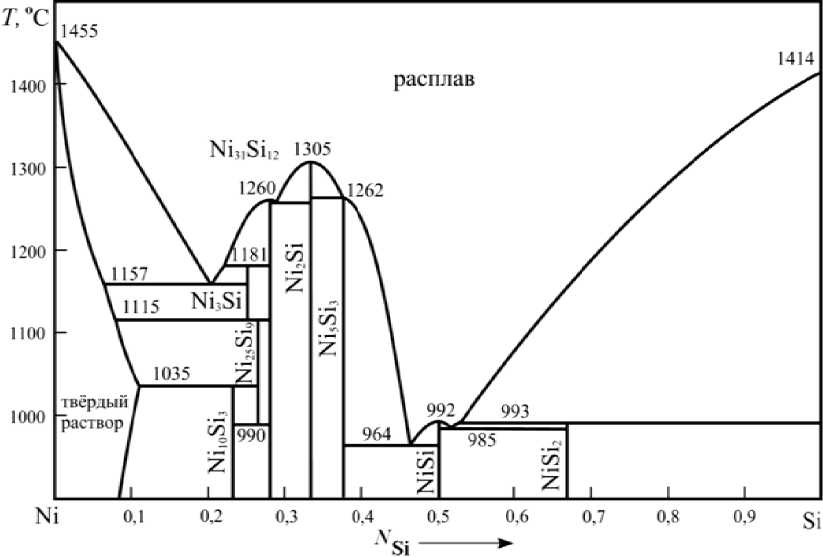
Рис. 2. Диаграмма состояния системы Ni–Si, рассчитанная в приближении теории субрегулярных растворов
Таблица 2
Параметры модели субрегулярного раствора для расплава (Дж/моль)
|
1 2 |
Si |
Ni |
|
Si |
0 |
–26269 |
|
Ni |
–25970 |
0 |
Таблица 3
Параметры модели субрегулярного раствора для твёрдого раствора (Дж/моль)
|
1 2 |
Si |
Ni |
|
Si |
0 |
0 |
|
Ni |
6000 |
0 |
Список литературы Термодинамическое моделирование линии ликвидус системы Ni-Si
- Dynamics of phase transformation of Cu-Ni-Si alloy with super-high strength and high conductivity during aging/L. Qian, L. Zhou, P. Zhi-yong et al.//Trans. Nonferrous Met. Soc. China. -2010. -Vol. 20 -P. 1006-1011.
- Вольхин, А.И. Анодная и катодная медь/А.И. Вольхин, Е.И. Елисеев, В.П. Жуков. -Челябинск: ЮУКИ, 2001. -431 с.
- Киткина, М.Г. Физико-химический фазовый анализ литых и термически обработанных сплавов системы Cu-Ni-Si/М.Г. Киткина, Р.В. Седлецкий, Н.П. Капитонова//Заводская лаборатория. -1980. -Т. 46, № 11. -С. 995-998.
- Бурылев, Б.П. О применении теории регулярных растворов к жидким сплавам кремния с элементами II-V периодов/Б.П. Бурылев//Известия вузов. Черная металлургия. -1963. -№ 8. -С. 35-40.
- Hardy, H.K. A «sub-regular» solution model and its application to some binary alloy systems/H.K. Hardy//Acta metallurgica. -1953. -Vol. 1. -P. 202-209.
- Хансен, М. Структуры двойных сплавов/М. Хансен, К. Андерко. -М.: Металлургиздат, 1962. -Т. 2. -880 с.
- Binary Alloy Phase Diagrams, Second Edition/Ed. T.B. Massalski. -ASM International, Materials Park, Ohio. -1990. -Vol. 3. -P. 2859-2861.
- Диаграммы состояния двойных металлических систем: справ.: в 3 т./под общ. ред. Н.П. Лякишева. -М.: Машиностроение, 1999. -Т. 3, кн. I. -880 с.
- Глушко, В.П. Термические константы веществ. База данных/В.П. Глушко. -http://www.chem.msu.su/


