Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu 2O-Al 2O 3-ZrO 2
Автор: Самойлова Ольга Владимировна, Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Трофимов Евгений Алексеевич, Сидоренко Александр Юрьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.15, 2015 года.
Бесплатный доступ
Проведен расчёт линий ликвидус диаграмм состояния бинарных систем Cu 2O-Al 2O 3, Cu 2O-ZrO 2 и Al 2O 3-ZrO 2, а также расчёт поверхности ликвидус диаграммы состояния тройной системы Cu 2O-Al 2O 3-ZrO 2. В процессе термодинамического моделирования перечисленных систем было использовано приближение теории субрегулярных ионных растворов. В ходе моделирования были подобраны значения модельных параметров Q, уточнены термодинамические характеристики (температура плавления, теплота и энтропия плавления) соединения CuAlO 2, а также значения констант процессов перехода Cu 2O, Al 2O 3, ZrO 2 и CuAlO 2 из твердого состояния в жидкое. Помимо построения диаграмм состояния, в ходе настоящей работы были рассчитаны активности компонентов расплавов систем Cu 2O-Al 2O 3 и Cu 2O-ZrO 2 для условий, при которых существует оксидный расплав. В рассмотренных интервалах активности характеризуются отрицательными отклонениями от закона Рауля. Полученные в результате расчёта значения активности оксида алюминия хорошо совпадают с литературными экспериментальными данными. Построение поверхности ликвидус для тройной системы Cu 2O-Al 2O 3-ZrO 2 позволило определить координаты точек нонвариантных превращений, реализующихся в системе. Результаты термодинамического моделирования показывают, что в тройной системе реализуется равновесие «оксидный расплав - чистый твердый оксид меди - чистый твердый оксид алюминия», которое нехарактерно для бинарной системы Cu 2O-Al 2O 3. Результаты работы могут быть использованы в ходе анализа производства циркониевых бронз, а также для анализа поведения шлаков индустрии меди и сплавов на ее основе в ходе взаимодействия таких шлаков с футеровкой печей.
Система cu 2o-al 2o 3-zro 2, термодинамическое моделирование, диаграммы состояния, шлаки производства меди и сплавов на ее основе
Короткий адрес: https://sciup.org/147156972
IDR: 147156972 | УДК: 669.33 | DOI: 10.14529/met150402
Текст научной статьи Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu 2O-Al 2O 3-ZrO 2
Система Cu 2 O–Al 2 O 3 –ZrO 2 представляет интерес как часть сложной многокомпонентной шлаковой системы, образующейся при производстве алюминиевых и циркониевых бронз. Цирконий используется при плавке алюминиевых бронз как модификатор, улучшающий свойства медных сплавов (например, жаропрочность). А при производстве циркониевых бронз во избежание угара циркония металл предварительно хорошо раскисляют, например, алюминием [1]. Помимо этого исследование особенностей взаимодействия оксида меди с керамикой системы Al 2 O 3 –ZrO 2 актуально, так как такая керамика может использоваться в качестве огнеупора при производстве меди и сплавов на ее основе.
Для построения диаграммы состояния трехкомпонентной системы необходимы сведения и о диаграммах состояния бинарных систем. Поэтому целью данной работы стало проведение термодинамического моделирования линий ликвидус диаграмм состояния бинарных систем Cu2O–Al2O3, Cu 2 O–ZrO 2 и Al 2 O 3 –ZrO 2 , а также моделирование поверхности ликвидус диаграммы состояния тройной системы Cu 2 O–Al 2 O 3 –ZrO 2 .
Подробно методика моделирования диаграмм состояния оксидных систем изложена в моногра- фии [2]. Расчет опирается на координаты (состав и температура) наиболее надежно определенных характерных точек на диаграммах: точек эвтектических, перитектических, фазовых переходов и т. п. Для моделирования диаграмм состояния также необходимы сведения о температурах и теплотах плавления чистых веществ. Для исследуемых систем эти данные приведены в табл. 1.
Координаты линий ликвидус диаграмм состояния бинарных систем Cu 2 O–Al 2 O 3 , Cu 2 O–ZrO 2 и Al 2 O 3 –ZrO 2 рассчитывались с помощью приближения теории субрегулярных ионных растворов, значения энергетических параметров теории приведены в табл. 2. Результаты моделирования представлены на рис. 1–3. Римскими цифрами на этих рисунках обозначены реперные точки, использованные при расчете.
Данных по диаграмме состояния системы Cu2O–Al2O3 в литературе мало. В работе S.K. Misra и A.C.D. Chaklader [5] приводится лишь часть диаграммы состояния этой системы. Термодинамическое моделирование позволило описать линию ликвидус полностью (рис. 1). Помимо оксидов меди и алюминия в системе присутствует соединение CuAlO 2 . Использованная методика расчёта позволила оценить некоторые термодинамические
Физическая химия и физика металлургических систем
Таблица 1
Данные о температурах и теплотах плавления веществ
|
Вещество |
Т 0 °C Tm , С |
A mH ° , Дж/моль T m |
Источник |
|
Cu 2 O |
1242 |
64 300 |
[3] |
|
Al2O 3 |
2051 |
107 850 |
[4] |
|
ZrO 2 |
2680 |
86 950 |
[4] |
Таблица 2
Энергетические параметры теории субрегулярных ионных растворов
|
Система |
Значения параметров |
||
|
Q 1112 , Дж/моль |
Q 1122 , Дж/моль |
Q 1222, Дж/моль |
|
|
Cu 2 O–Al 2 O 3 |
+1050 ( Q 1112 )* |
+42888 ( Q 1122 )* |
+11313 ( Q 1222 )* |
|
Cu 2 O–ZrO 2 |
–39940 ( Q 1113 )* |
+18590 ( Q 1133 )* |
–29628 ( Q 1333 )* |
|
Al 2 O 3 –ZrO 2 |
+18407 ( Q 2223 )* |
–7177 ( Q 2233 )* |
+16812 ( Q 2333 )* |
См. формулы (1)–(4).

Рис. 1. Диаграмма состояния системы Cu 2 O–Al 2 O 3 : сплошная линия – результаты моделирования по теории субрегулярных ионных растворов; штрихпунктир – литературные данные S.K. Misra и A.C.D. Chaklader [5]

Рис. 2. Диаграмма состояния системы Cu 2 O–ZrO 2 : сплошная линия – результаты моделирования по теории субрегулярных ионных растворов; литературные данные A.M.M. Gadalla и J. White [6] нанесены штрихпунктиром
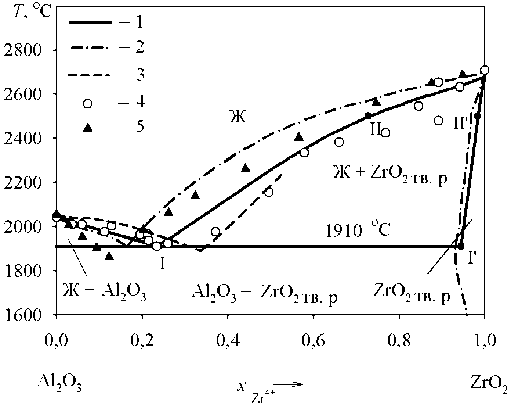
Рис. 3. Диаграмма состояния системы Al 2 O 3 –ZrO 2 : 1 –результаты моделирования по теории субрегулярных ионных растворов (линия ликвидус) и теории регулярных ионных растворов (твердый раствор на основе ZrO 2 );
2 – справочные данные А.С. Бережного [7]; 3 – экспериментальные данные H. Suzuki и др. [8]; 4 – экспериментальные данные G.R. Fischer и др. [9];
5 – расчетные данные W. Tao и J. Zhanpeng [10]
характеристики этого соединения: T m =1260 °С;
A H ° =106 544 Дж/моль; A S° =42,73 Дж/моль^К. mm mm
Сведения в литературе по диаграмме состояния системы Cu 2 O–ZrO 2 также немногочисленны. Координаты точки эвтектики для этой системы представлены в работе A.M.M. Gadalla и J. White [6]. Результаты термодинамического моделирования позволили построить линию ликвидус для всего возможного интервала составов (рис. 2).
Система Al 2 O 3 –ZrO 2 изучалась неоднократно [7–10]. Однако данные разных авторов по координатам точки эвтектики сильно расходятся (рис. 3). Координаты точки эвтектики меняются от 55 мас. % ZrO2 и 1890 °С [8] до 25 мас. % ZrO2 и 1862 °С [10]. За исходные данные для термодинамического моделирования были взяты данные [9] с координатами точки эвтектики 42,50 мас. % ZrO2 и 1910 °С.
В процессе расчета диаграммы состояния системы Al 2 O 3 –ZrO 2 линия солидус, ограничивающая область существования твердого раствора на основе оксида циркония, была определена с использованием теории регулярных ионных растворов. Энергетический параметр теории, использованный при расчете, Q 12 = +58610 Дж/моль.
Для оценки адекватности проведенного термодинамического моделирования линий ликвидус были рассчитаны активности компонентов оксидного расплава для бинарных систем с оксидом меди. Результаты представлены на рис. 4–5. Расчеты проведены только для концентраций, при которых существует оксидный расплав. В рассмотренных интервалах a(Cu2O) , a(Al2O3) и a(ZrO2) характери- зуются отрицательными отклонениями от закона Рауля.
Данных по диаграмме состояния тройной системы Cu2O–Al2O3–ZrO2 в литературе нет. Расчёт поверхности ликвидус диаграммы состояния этой системы в настоящей работе осуществлялся с использованием теории субрегулярных ионных растворов на основании данных, полученных при моделировании бинарных систем.
Для построения поверхности ликвидус тройной диаграммы состояния необходимы сведения не только об энергетических параметрах, характеризующих бинарные системы, но и значения перекрестных энергетических параметров для тройной системы. Эти значения можно оценить по формулам:
SQ = Q 1112 + Q 1122 + Q 1222 + Q 111 3 + Q 11 33 +
+ Q1333 + Q2223 + Q2233 + Q2333;(1)
Q 1123 = ( SQ + 3 Q 1112 + Q 1122 – Q 1222 +
+ 3Q1113 + Q1133 – Q1333) / 4;(2)
Q 122 3 = ( SQ + 3 Q 1222 + Q 1122 – Q 1112 +
+ 3Q2223 + Q2233 – Q2333) / 4;(3)
Q 1233 = ( SQ + 3 Q 1333 + Q 1133 – Q 1113 +
+ 3 Q2333 + Q2233 – Q2223) / 4.(4)
Расчёт с использованием данных табл. 2 позволил получить следующие значения:
Q 1123 = –1141 Дж/моль;
Q 1223 = + 34831 Дж/моль;
Q 1233 = + 6703 Дж/моль.
Необходимые для моделирования сведения о константах равновесия перехода твердых веществ в жидкое состояние приведены в табл. 3. Для простых веществ расчет производился по формуле (5), а для соединения – по формуле (6):
Физическая химия и физика металлургических систем
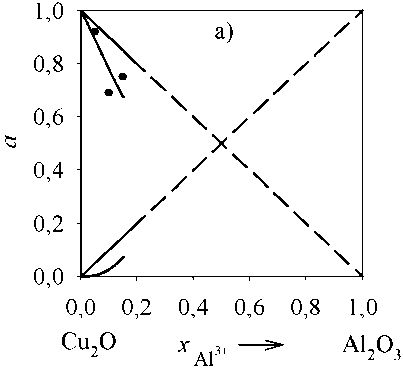

Рис. 4. Зависимость активностей компонентов оксидного расплава (Cu 2 O, Al 2 O 3 ) от состава: а) T = 1380 °С; б) T = 1500 °С; в) T = 2000 °С. Точками указаны литературные экспериментальные данные [11] при 1380 °С
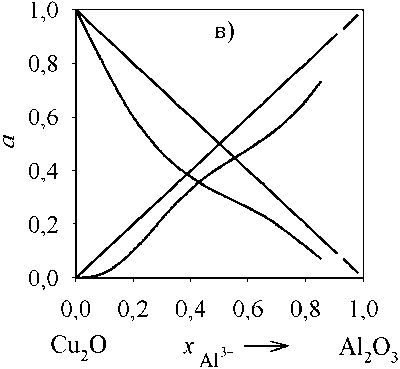
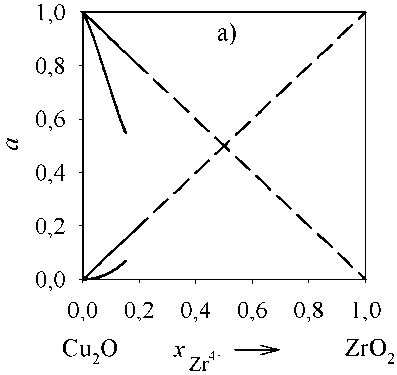
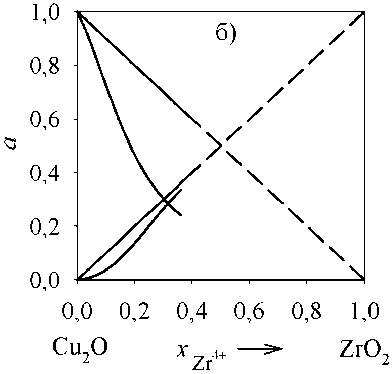
Рис. 5. Зависимость активностей компонентов оксидного расплава (Cu 2 O, ZrO 2 ) от состава: а) T = 1500 °С; б) T = 2000 °С
Таблица 3
Константы равновесия, характеризующие процесс перехода вещества в жидкое состояние
A m H °r A m H °
_________ 1 m + 1 m ;
2,303 RT 2,30 3 RTm ’
lg K пл
A mH°r ____________ 1 m । 2,30 3 RT
A m S°r
m
2 ,30 3 R
Здесь K пл – к онс тан та ра вновесия п ерехода тверд ого вещества в жидкое состояние; Am H° - теплота m m
плавления вещества, Дж/моль; A mS° - энтропия Tm
плавления вещества, Дж/моль^К; T - температура плавления вещества, К; R – универсальная газовая постоянная, R = 8,314 Дж/моль·К.
Рассчитанная диаграмма состояния системы Cu2O–Al2O3–ZrO2 представлена на рис. 6. Координаты точек нонвариантных превращений I и II приведены в табл. 4. На диаграмме состояния помимо границ областей, равновесных с оксидным расплавом, нанесены изотермы для температур из интервала 1200–2600 °С с шагом 200 °С.

Рис. 6. Поверхность ликвидус диаграммы состояния системы Cu 2 O–Al 2 O 3 –ZrO 2
Координаты точек нонвариантных превращений на диаграмме состояния системы Cu 2 O–Al 2 O 3 –ZrO 2
Таблица 4
|
Наименование точки |
Равновесие |
Т , °С |
x (Cu + ) |
x (Al3 + ) |
x (Zr4 + ) |
|
I |
Ж–Cu 2 O–Al 2 O 3 –ZrO 2 тв. р |
1105 |
0,8578 |
0,0598 |
0,0824 |
|
II |
Ж–Cu 2 O–Al 2 O 3 –CuAlO 2 |
1150 |
0,8849 |
0,0844 |
0,0307 |
Выводы
Проведено термодинамическое моделирование линий ликвидус диаграмм состояния бинарных систем Cu2O–Al2O3, Cu2O–ZrO2 и Al2O3–ZrO2, а также поверхности ликвидус диаграммы состояния тройной системы Cu2O–Al2O3–ZrO2. Согласно результатам моделирования в тройной системе реализуется равновесие «оксидный расплав – чистый твердый оксид меди – чистый твердый оксид алюминия», которого нет в системе Cu2O–Al2O3. Показано, что тройная система характеризуется наличием двух точек нонвариантных превращений, положение которых смещено в сторону угла, вершиной которого является чистый оксид меди Cu2O. Температура точки тройного эвтектического равновесия составляет 1105 °С и, соответственно, численно меньше, чем для бинарных систем. Таким образом, стойкость футеровки из керамики Al2O3–ZrO2 при контакте с оксидом меди будет ниже, чем стойкость футеровки из чистого корунда или оксида циркония.
Работа осуществлена при финансовой поддержке РФФИ, грант № 13-03-00534.
Список литературы Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu 2O-Al 2O 3-ZrO 2
- отливок из сплавов цветных металлов: учеб. для вузов/А.В. Курдюмов, М.В. Пикунов, В.М. Чурсин, Е.Л. Бибиков. -М.: Металлургия, 1986. -416 с.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Химическая энциклопедия: в 5 т./под ред. И.Л. Кнунянца. -М.: Сов. энцикл. -1990. -Т. 2. -671 с.
- Кубашевский, О. Металлургическая термохимия/О. Кубашевский, С.Б. Олкокк. -М.: Металлургия, 1982. -392 с.
- Misra, S.K. The System Copper Oxide-Alumina/S.K. Misra, A.C.D. Chaklader//Journal of the American Ceramic Society. -1963. -Vol. 46, no. 10. -P. 509.
- Gadalla, A.M.M. Equilibrium Relationships in the System CuO-Cu2O-ZrO2/A.M.M. Gadalla, J. White//Transactions of the British Ceramic Society. -1966. -Vol. 65, no. 7. -P. 383-390.
- Бережной, А.С. Многокомпонентные системы окислов/А.С. Бережной. -Киев: Наукова думка, 1970. -544 с.
- Studies of the Systems Al2O3-ZrO2 and Na2O-ZrO2. Studies on the Refractories of the System Na2O-Al2O3-ZrO2 (I)/H. Suzuki, Sh. Kimura, H. Yamada, T. Yamauchi//J. Ceram. Assoc. Japan. -1961. -Vol. 69, no. 2. -P. 72-79.
- The Eutectic and Liquidus in the Al2O3-ZrO2 System/G.R. Fischer, L.J. Manfredo, R.N. McNally, R.C. Doman//Journal of Materials Science. -1981. -No. 16. -P. 3447-3451.
- Tao, W. Thermodynamic Assessment of the ZrO2-AlO1.5 System/W. Tao, J. Zhanpeng//J. Cent. South Univ. Technol. -1997. -Vol. 4, no. 2. -P. 108-112.
- Активности окислов в жидких алюмосиликатах/Ю.П. Никитин, Л.В. Таранухина, Л.Р. Середина, С.А. Пушкарева и др.//Известия ВУЗов. Цветная металлургия. -1962. -№ 1. -С. 74-76.


