Термодинамическое моделирование процессов взаимодействия кальция, магния, алюминия и бора с кислородом в металлических расплавах
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 1 т.19, 2019 года.
Бесплатный доступ
Разработана методика расчета диаграмм раскисления и модифицирования стали кальцием, магнием, алюминием и бором. Установлены координаты поверхностей ликвидус оксидных систем B2O3-Al2O3-MgO, B2O3-Al2O3-CaO, B2O3-MgO-CaO при 1600 °С. Определены энергетические параметры теории субрегулярных ионных растворов для изученных оксидных систем. Рассчитаны координаты поверхностей растворимости для систем Fe-Mg-Al-B-O, Fe-Ca-Al-B-O, Fe-Mg-Ca-Al-B-O. Изучено влияние общего давления на растворимость магния и кальция в жидком железе. Активности компонентов металлического расплава рассчитаны с применением параметров взаимодействия первого порядка (теория Вагнера). Активности компонентов твердых растворов (оксидов и шпинелей) приравнивали их мольным долям. Показано, что при глубоком рафинировании металла от кислорода лишь незначительная часть бора будет окисляться и эти оксиды войдут в состав оксидных расплавов. Основными неметаллическими оксидными включениями будут магнезиальная шпинель, биалюминат кальция и жидкие оксидные образования. Так называемый свободный бор может быть растворен в жидком металле в количествах, отвечающих равновесию с оксидными фазами.
Моделирование, термодинамика, бор, магний, алюминий, кальций, раскисление, фазовые равновесия
Короткий адрес: https://sciup.org/147232525
IDR: 147232525 | УДК: 669.017.3 | DOI: 10.14529/met190104
Текст научной статьи Термодинамическое моделирование процессов взаимодействия кальция, магния, алюминия и бора с кислородом в металлических расплавах
Все более широкое применения бора в металлургии, особенно при выплавке малоуглеродистых сталей, связано с уникальной способностью бора повышать механические и эксплуатационные свойства стали при микродобавках бора в сталь, не превышающих 0,002–0,008 % по массе. При этом необходимо учитывать, что бор активно взаимодействует с серой, азотом и кислородом в стали, способен образовывать интерметаллиды с компонентами жидкого металла [1]. Сейчас путем лабораторных и промышленных экспериментов доказано, что положительное влияние на прочность, прокаливаемость, пластичность, снижение показателей анизотропии удается реализовать в технологии выплавки борсодержащей стали при наличии в металле так называемого свободного бора, бора, растворенного в металле, а не связанного в неметаллические включения [2–3]. Использование микролегирования стали бором, вводимым в пределах 0,001–0,025 % по массе, позволяет заменить в ряде случаев до 1,3 % никеля, 0,3 % хрома, 0,04 % молибдена на 0,001 % бора [4]. Прокаливаемость стали увеличивается с увеличением содержания углерода до 0,6 % [3, 5]. По мере работы над оптимизацией процесса микролегирования бором открываются все новые возможности использования бора. Бористые стали с содержанием бора 1–2 % являются эффективными поглотителями нейтронов и применяются в атомной энергетике [6, 7]. Использование далеко не полного перечня положительных свойств бора в металлургии требует дальнейшего изучения этих свойств. Для этого необходимо расширить круг изучаемых металлургических систем. Предварительно в работе [8] изучены и построены отдельные диаграммы состояний оксидных систем FeO–B2O3, B2O3–Al2O3, MnO–B2O3, SiO2–B2O3, MgO–B2O3, CaO–B2O3 с указанием сложных оксидных соединений, образующихся в этих системах. Также были построены поверхности растворимости компонентов в металлических системах (ПРКМ) для систем Fe–B–O, Fe–B–Si–O, Fe–B–Mg–O, Fe–B–Ca–O, Fe–B–Mn–O, Fe–B–Al–O [9]. Термодинамическая проработка литератур- ных и экспериментальных данных позволила установить зависимости констант равновесия, необходимых для расчетов, от температуры и параметры теории субрегулярных ионных растворов для оксидных систем. На основе этих расчетов установлено, что при современном уровне металлургических технологий можно добиться рафинирования стали по кислороду до 0,0001 %, по сере – до 0,002 % при реализации технологии печь-ковш. Для снижения концентрации азота в металле необходимо использовать присадки титана [10]. Это позволит снизить потери «эффективного» бора.
Для выяснения строения ПРКМ для бор- содержащих систем, раскисленных кальцием, алюминием и магнием, необходимо построить диаграммы состояния MgO–Al2O3–B2O3, CaO–Al2O3–B2O3, CaO–MgO–B2O3, т. е. существенным образом усложнить термодинамические расчеты. С использованием данных изученных ранее диаграмм состояний можно построить ПРКМ систем Fe–Mg–Al–B–O, Fe–Ca– Al–B–O и Fe–Ca–Mg–Al–B–O при фиксированном содержании бора ([B] = 0,001 мас. %), давления (1 и 1,5 атм) и температуры (1600 °С).
На рис. 1 представлены полученные расчетом координаты поверхностей ликвидус для систем MgO–Al 2 O 3 –B 2 O 3 , CaO–Al 2 O 3 –B 2 O 3 ,
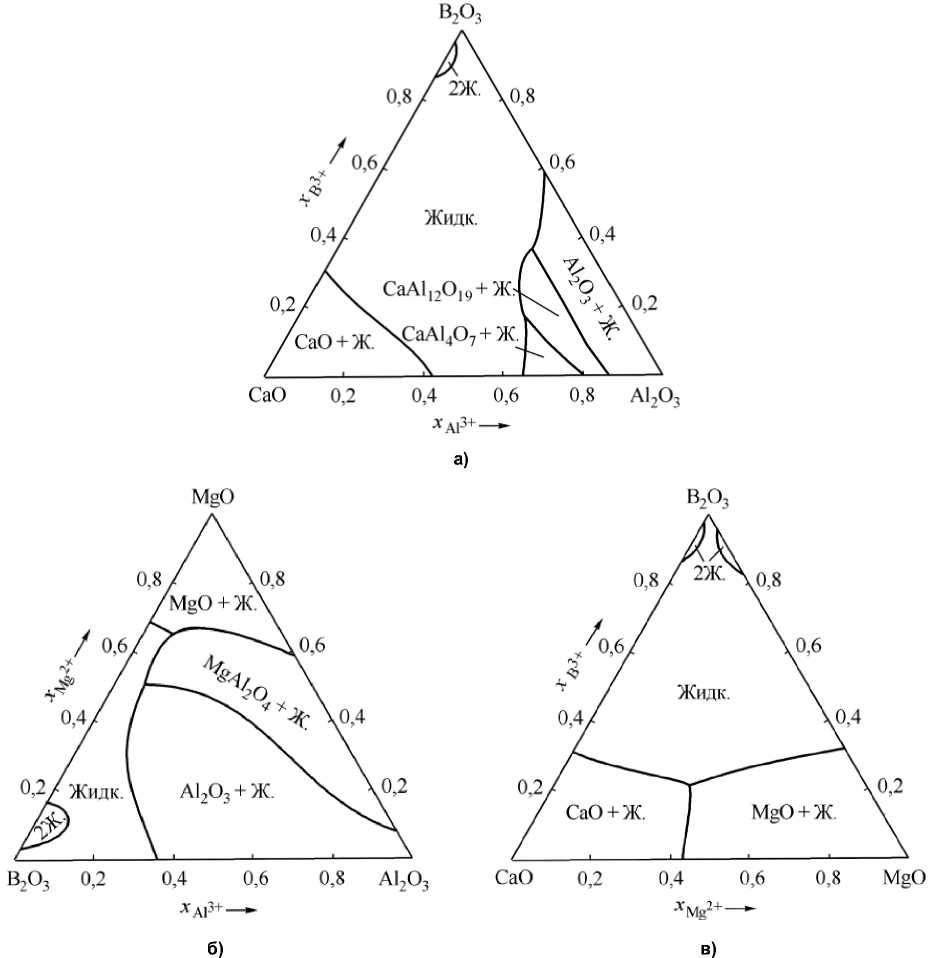
Рис. 1. Расчетные диаграммы состояний систем при 1600 °С: а) B 2 O 3 –Al 2 O 3 –CaO; б) B 2 O 3 –Al 2 O 3 –MgO; в) B 2 O 3 –MgO–CaO
CaO–MgO–B 2 O 3 при температуре 1600 °С, сведения о которых практически отсутствуют в научной литературе.
Диаграмма CaO–Al 2 O 3 –B 2 O 3 изучена Шефером и Куцелем только при 900–1500 °С [11]. В работе установлено существование двух тройных соединений: CaO·Al 2 O 3 ·B 2 O 3 и 2CaO·Al 2 O 3 ·B 2 O 3 . Температура плавления 2CaO·Al 2 O 3 ·B 2 O 3 по данным [11] на 9Al 2 O 3 ·2B 2 O 3 и расплав составляет 1015 °С. Соединение 9Al 2 O 3 ·2B 2 O 3 может существовать до температуры 1440 °С. Соединение 2CaO·Al2O3·B2O3 плавится инконгруэнтно при 1098 °С. Следовательно, в тройной диаграмме CaO–Al 2 O 3 –B 2 O 3 при 1600 °С возможно образование только алюминатов кальция, оксидов кальция и алюминия и наблюдалось расслоение расплава при высоком содержании В 2 О 3 в жидкости. В данной работе на основании двойных оксидных систем смоделирована тройная диаграмма состояний CaO–Al 2 O 3 –B 2 O 3 . Ранее тройные оксидные системы с B2O3 и FeO рассчитывали при 1600 °С, так как в литературе присутствует только одна диаграмма с FeO и B 2 O 3 – диаграмма FeO–B 2 O 3 –CaO, которая приводится именно при этой температуре, поэтому и наши расчетные тройные диаграммы состояний с B 2 O 3 приведены в [8] при 1600 °С. Энергетические параметры, подобранные в данной работе для системы CaO–Al 2 O 3 –B 2 O 3 , имеют следующие значения: Q 1123 = –110 000; Q 1223 = –72 000; Q 1233 = = –70 000 кал/моль.
На полях диаграмм (см. рис. 1) указаны химические оксидные соединения, которые могут быть в равновесии с оксидным расплавом (жидкостью). Так, на рис. 1а указаны поля изотермических фазовых равновесий
(CaO + Ж.), (CaAl 4 O 7 + Ж.), CaAl 12 O 19 + Ж.), (Al 2 O 3 + Ж.). Расслоение оксидного расплава обозначено символом (2 Ж.). Символом Ж. обозначены оксидные расплавы (CaO–Al 2 O 3 –B 2 O 3 ) для рис. 1а, (MgO–Al 2 O 3 –B 2 O 3 ) – для рис. 1б, (CaO–MgO–B 2 O 3 ) – для рис. 1в.
Диаграмма состояний B 2 O 3 –MgO–Al 2 O 3 (см. рис. 1 б) изучалась при более низких температурах [12–15], но полная диаграмма состояний системы B 2 O 3 –MgO–Al 2 O 3 не построена. В настоящей работе была построена эта диаграмма при 1600 °С. Подобранные в данной работе параметры теории субрегулярных ионных растворов для данной системы: Q 1123 = –50 000; Q 1223 = –100 000; Q 1233 = = –30 000 кал/моль.
Также были рассчитаны координаты поверхности ликвидус для диаграммы состояний системы B 2 O 3 –MgO–CaO (рис. 1в). Данная диаграмма была изучена в работе [16] только при 900 °С. Энергетические параметры, подобранные для этой системы в данной работе, имеют следующие значения: Q 1123 = –116 000; Q 1223 = –120 000; Q 1233 = –110 000 кал/моль.
В табл. 1 представлены необходимые для построения тройных диаграмм состояний значения зависимостей констант равновесия (плавления) от температуры. Круглые скобки обозначают жидкое состояние фазы, прямые – чистая твердая фаза.
В работе используется теория субрегулярных растворов с допущениями о квадратичной зависимости координационного числа раствора от химического состава взаимодействующих фаз. Основы теории и ее использование при определении термодинамических параметров взаимодействующих неметаллических фаз достаточно подробно изложены
Таблица 1
Термодинамические данные для реакций фазовых превращений, K – константа плавления оксидов и их соединений
В табл. 2 приведены реакции, константы равновесия и их температурные зависимости, используемые для описания процесса раскисления стали кальцием, магнием, алюминием и бором. у - коэффициент активности иона металла в оксидном расплаве с использованием теории субрегулярных ионных растворов. Активности компонентов твердого раствора оксидов | FeO, CaO | приравнивали их ионным долям ( ^F^ = xFe2+|, ас^ = xСа2+| ), твердого раствора оксидов | FeO, MgO | также приравнивали их ионным долям а|FeO| = xF 2+|, aMgO| = xMg2+ . Твердые растворы | FeO, CaO | и | FeO, MgO | не смешиваются между собой в случае присутствия в системе и магния, и кальция. Активности компонентов твердого раствора шпинелей | FeAl2O4, MgAl2O4 | приравнивали их мольным долям ( а|FeAl2O4 = xFeAl2O4| , a|MgAl2O4| = xMgAl2O4|).
Опыт расчетов и анализов показывает, что при построении диаграмм рафинирования
Таблица 2
Зависимости констант равновесия реакций раскисления от температуры
Имеющиеся в справочных и научных изданиях сведения о высокотемпературных реакциях зачастую либо отрывочны, либо неизвестны, либо получены методом косвенных термодинамических расчетов. Для целей выполнения представленной работы необходимо получить сведения по химическим реакциям, представленным в табл. 1 и 2.
Особенности термодинамических расчетов, методы построения систем уравнений и их решения достаточно подробно изложены в монографии [17]. Активности компонентов металлического расплава рассчитывали с использованием параметров взаимодействия первого порядка (по теории Вагнера) [18–22]. Активности компонентов оксидных расплавов рассчитывали с использованием теории субрегулярных ионных растворов. Параметры теории для диаграмм состояний систем MgO–Al2O3–B2O3, CaO–Al2O3–B2O3, CaO–MgO–B2O3 приведены выше. Недостающие для расчетов энергетические параметры теории (для диаграмм, содержащих FeO) приведены в [8, 17].
На рис. 2 приведены диаграммы раскисления железа сплавами Mg–B–Al и Ca–B–Al. На полях диаграмм указаны названия фаз. Так, на рис. 2а в области I указаны составы жидкого металла, содержащего 0,001 мас. % бора, равновесного с оксидным расплавом (FeO, Al 2 O 3 , B 2 O 3 , MgO), в области II – с твердым раствором оксидов на основе MgO, в области III – с твердым шпинельным раствором, в области IV – с корундом. На линии no заданы составы металла, равновесного с твердым раствором оксидов и парами магния при давлении p Mg = 1 атм. Аналогично линия n′o′ – для 1,5 атм. На линии om заданы составы металла, равновесного со шпинельным твердым раствором и парами магния при давлении 1 атм, на линии o′m′ – для 1,5 атм. Тонкими линиями на ПРКМ нанесены изотермы кислорода в логарифмических координатах. На осях рис. 2а нанесены концентрации компонентов в логарифмических координатах. Аналогичные обозначения и на рис. 2б (для случая раскисления кальцием, алюминием и бором).
На рис. 3 приведена ПРКМ системы Fe–Mg–Ca–Al–B–O при 1600 °С и фиксированных концентрациях [Mg] = 0,001 и [B] = = 0001 мас. %. Газовая фаза состоит из двух компонентов – паров магния и кальция. При общем давлении 1 атм p Mg = 0,83 атм,
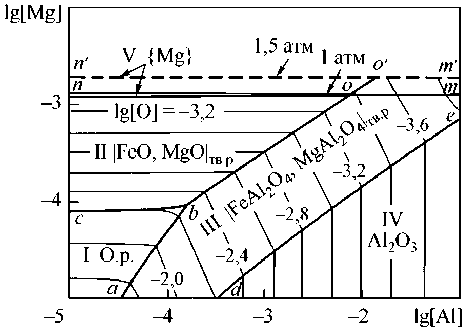
а)
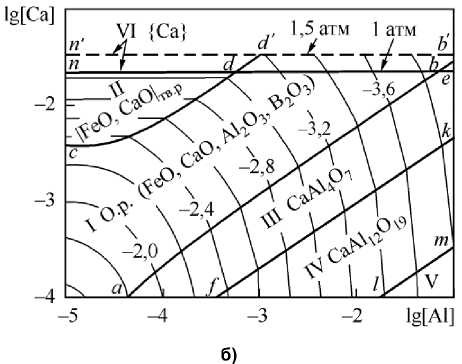
Рис. 2. Поверхности растворимости компонентов в металле (ПРКМ) при T = 1600 °С, [B] = 0,001 мас. % систем: а) Fe–Mg–Al–B–O; б) Fe–Ca–Al–B–O (V – Al 2 O 3 )
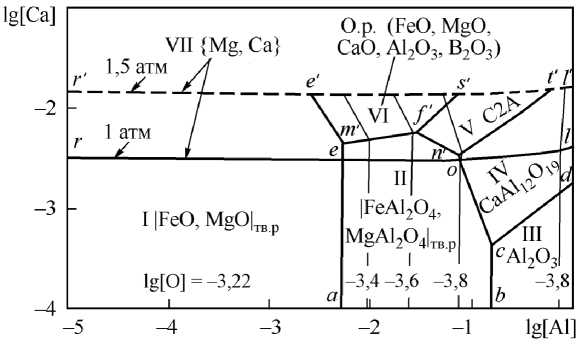
Рис. 3. ПРКМ системы Fe–Mg–Ca–Al–B–O, T = 1600 °С, [Mg] = 0,001, [B] = 0,001 мас. % (С2A – CaAl 4 O 7 )
p Ca = 0,17 атм (линия reol ). В глубине металла возможно гидростатическое повышение давления. При общем давлении 1,5 атм p Mg = 0,83 атм, p Ca = 0,67 атм (линия r′e′s′t’l′ ).
Из рис. 2 и 3 видно, что равновесные по бору составы металла не содержат чистой фазы бора. Бор может входить в состав металлических расплавов и в небольших количествах расходоваться на раскисление металла. Основными же неметаллическими включениями будут магнезиальная шпинель, биалюминат кальция и жидкие оксидные включения (при [Ca] ≈ 0,001–0,005 и [Al] = 0,01–0,03 мас. %).
Заключение
Разработана методика расчета составов равновесного металла и шлака, при которых в основном бор не должен расходоваться на участие в оксидных фазах, а будет находиться в жидком металле. Построены диаграммы состояний систем MgO–Al 2 O 3 –B 2 O 3 , CaO–Al 2 O 3 –B 2 O 3 , CaO–MgO–B 2 O 3 при 1600 °С с использованием теории субрегулярных ионных растворов. Впервые построены поверхности растворимости компонентов для термодинамических систем Fe–Mg–Al–B–O, Fe–Ca– Al–B–O, Fe–Mg–Ca–Al–B–O при высоких температурах. Изучено влияние общего давления на растворимость магния и кальция в жидком железе.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011.
Список литературы Термодинамическое моделирование процессов взаимодействия кальция, магния, алюминия и бора с кислородом в металлических расплавах
- Барадынцева, Е.П. Влияние микролегирования бором на прокаливаемость сталей / Е.П. Барадынцева, Н.А. Глазунов, О.В. Роговцова // Литье и металлургия. - 2016. - № 3 (84). - С. 70-74.
- Лякишев, Н.П. Борсодержащие стали и сплавы / Н.П. Лякишев, Ю.Л. Плинер, С.И. Лаппо. - М.: Металлургия, 1986. - 191 с.
- Новое применение бора в металлургии / В.В. Парусов, А.Б. Сычков, И.В. Деревянченко, М.А. Жигарев // Вестник МГТУ им. Г.И. Носова, 2005. - № 1 (9). - С. 15-17.
- Потапов, А.И. Технологические особенности легирования стали бором / А.И. Потапов, А.Е. Семин // Известия высших учебных заведений. Черная металлургия, 2012. - № 55 (9). - С. 68-69.
- Перспективы выплавки стали с повышенной прокаливаемостью за счет бора / Л.Б. Исаева, И.Е. Лев, Н.М. Великонская, А.Г. Безшкуренко // Сборник тезисов IX Международной научно-практической конференции «Литье 2013», Украина, Запорожье, 2013. - С. 261-262.
- Козлов, Д.В. Возможности применения бористых сталей в существующих и перспективных ядерных реакторах / Д.В. Козлов, В.Д. Рисованный // Известия Самарского научного центра РАН. - 2012. - Т. 14, № 4 (4). - С. 966-970.
- Нестеренко, А.М. Размерно-геометрические спектры легирования стали бором и медью / А.М. Нестеренко, А.Б. Сычков // Фундаментальные и прикладные проблемы черной металлургии: сб. науч. тр. - Днепропетровск: Bision, 2004. - Вып. 7. - С. 181-183.
- Михайлов, Г.Г. Термодинамическое моделирование фазовых равновесий в оксидных системах, содержащих B2O3 / Г.Г. Михайлов, Л.А. Макровец, Л.А. Смирнов // Вестник ЮУрГУ. Серия «Металлургия». - 2014. - № 14 (4). - С. 11-16.
- Михайлов, Г.Г. Термодинамический анализ реакций взаимодействия марганца, кремния, магния, кальция, алюминия с кислородом в борсодержащем расплаве на основе железа / Г.Г. Михайлов, Л.А. Макровец, Л.А. Смирнов // Вестник ЮУрГУ. Серия «Металлургия». - 2015. - Т. 15, № 2. - С. 5-12.
- Лысенкова, Е.В. Образование нитридов титана в стальных расплавах - термодинамические расчеты на основе уточненных справочных данных / Е.В. Лысенкова, А.Я. Стомахин // Известия высших учебных заведений. Черная металлургия. - 2015. - Т. 58, № 6. - С. 439-443.
- Диаграммы состояния силикатных систем. Справочник. Выпуск четвертый. Тройные окисные системы / В.П. Барзаковский, В.В. Лапин, А.И. Бойкова, Н.Н. Курцева. - Л.: Наука, Ленинград. отд-ние, 1974. - 514 с.
- Hamzawy, E.M.A. Vitrification and devitrification phenomena in the ternary MgO-Al2O3-B2O3 system / E.M.A. Hamzawy, H. Darwish // Ceramics International. - 2008. - Vol. 34. - P. 1965-1969.
- Kiss, S.J. The influence of B2O3 on spinel formation in the Al2O3-MgO-B2O3 system / S.J. Kiss // Sci. Ceram.; Proc. 12th Int. Conf. Saint-Vincent, 23-30 June 1983, Faenza, 1984. - Vol. 12. - P. 195-198.
- Sokolov, V.A. Synthesis and properties of flux-cast refractories in Al2O3-MgO-B2O3 system / V.A. Sokolov, T.Ya. Malysheva, M.D. Gasparyan // Refractories and Inductrial ceramics. - 2008. - Vol. 49, no. 2. - P. 146-149.
- The Effects of Gravity on the Combustion Synthesis of B2O3-Al2O3-MgO Glass Ceramic Composites / A.R. Manerbino, H.C. Yi, J.Y. Guignt et al. // 12th International Proceedings of the Experimental Methods for Microgravity Materials Science, ASM International, April 2, 2000. Document ID: 20010064835/ - https://ntrs.nasa.gov/ search.jsp?R=20010064835.
- Fletcher, B.L. Phase Equilibria in the System CaO-MgO-B2O3 at 900°C / B.L. Fletcher, J.R. Stevenson, A. Whitaker // Journal of the American Ceramic Society, 1970. - Vol. 53, no. 2. - P. 95-97. - 10.1111/j.1151-2916. 1970.tb12018.x
- DOI: 10.1111/j.1151-2916.1970.tb12018
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М.: Издат. Дом МИСИС. - 2009. - 519 с.
- Bůžek, Z. Základní termodynamické údaje o metalurgických reakcích a o interakcích prvků v soustavách významných pro hutnickou teorii a praxi / Z. Bůžek // Hutnické aktuality. - 1979. - Vol. 20, no. 1-2. - P. 3-111.
- Балковой, Ю.В. Параметры взаимодействия первого порядка в расплавах на основе железа: обзор. информ. / Ю.В. Балковой, Р.А. Алеев, В.К. Баканов. - М.: Черметинформация, 1987. - 42 с.
- Steelmaking Data Sourcebook, The Japan Society for the Promotion of Science, The 19th Committee on Steelmaking, Gordon and Breach Science Publishers, New York. NY, 1988. - P. 288-289.
- Evolution Mechanisms of MgO•Al2O3 Inclusions by Cerium in Spring Steel Used in Fasteners of High-Speed Railway / L.J. Wang, Y.Q. Liu, Q. Wang, K.C. Chou // ISIJ International. - 2015. - Vol. 55, no. 5. - P. 970-975.
- Park, J.H. Control of MgO•Al2O3 Spinel Inclusions in Stainless Steels / J.H. Park, H. Todoroki // ISIJ International, 2010. - Vol. 50, no. 10. - P. 1333-1346.


