Термодинамическое описание фазовых равновесий в системе Cu-Al-Zr-O в условиях существования металлического расплава
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Самойлова Ольга Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.16, 2016 года.
Бесплатный доступ
Проведено термодинамическое моделирование и экспериментальное изучение фазовых равновесий в системе Cu-Al-Zr-O. Термодинамический анализ фазовых равновесий был выполнен с использованием методики построения поверхности растворимости компонентов в металле (ПРКМ). Анализ проводился для температур 1200 и 1300 °С. По результатам расчета были построены области фазовых равновесий жидкого металлического расплава и сопряженных оксидных фаз в зависимости от концентрации элементов, растворенных в металлическом расплаве. В присутствии циркония и алюминия в расплаве образование оксида меди и соединения CuAlO2 термодинамически маловероятно. Области этих фазовых равновесий смещены по концентрации алюминия 10-13 мас. % и менее, а по концентрации циркония 10-20 мас. % и менее. Также были просчитаны изокислородные сечения. Показано, что цирконий в медном расплаве является более сильным раскислителем, чем алюминий. Таким образом, для системы Cu-Al-Zr-O характерен механизм альтернативного раскисления. В первую очередь взаимодействовать с кислородом будет растворенный в металлическом расплаве цирконий. При снижении его концентрации в расплаве, связанном с образованием оксида циркония, при достаточном содержании растворенного в расплаве кислорода возможно образование и оксида алюминия. Экспериментальные исследования подтверждают результаты термодинамического моделирования. Анализ образовавшихся в металле оксидных включений был выполнен с использованием растрового электронного микроскопа и микрорентгеноспектрального анализа. Результаты исследования могут быть интересны для технологии производства меди и сплавов на ее основе.
Система cu-al-zr-o, термодинамическое моделирование, пркм, раскисление меди и сплавов на ее основе
Короткий адрес: https://sciup.org/147157030
IDR: 147157030 | УДК: 669.35 | DOI: 10.14529/met160302
Текст научной статьи Термодинамическое описание фазовых равновесий в системе Cu-Al-Zr-O в условиях существования металлического расплава
Лигатуры с алюминием и цирконием используются при раскислении сплавов на основе меди [1]. В литературе имеются сведения о термодинамике процессов взаимодействия в трехкомпонентных системах Cu–Al–O и Cu–Zr–O [2–4], согласно которым и алюминий, и цирконий являются сильными раскислителями в медном расплаве. Однако данных о термодинамике процессов взаимодействия в четырехкомпонентной системе Cu–Al–Zr–O в литературе не встречается.
Целью настоящей работы стало изучение фазовых равновесий в системе Cu–Al–Zr–O в условиях существования медного расплава, и, на основании проведенных исследований, определение механизма раскисления в представленной системе.
Термодинамический анализ фазовых равновесий был выполнен с использованием методики построения поверхности растворимости компонентов в металле (ПРКМ). Подробно методика моделирования ПРКМ изложена в монографии [5] и включает в себя:
-
1) расчет линий ликвидус оксидных диаграмм состояния с выбором модели, описывающей оксидный шлаковый расплав, находящийся в сопряжении с металлическим;
-
2) расчёт ПРКМ с использованием данных об оксидном шлаковом расплаве, о константах равновесия взаимодействия элементов в металлическом
расплаве и данных о параметрах взаимодействия элементов в металлическом расплаве.
Термодинамическое моделирование координат линий ликвидус диаграмм состояния бинарных систем Cu 2 O–Al 2 O 3 , Cu 2 O–ZrO 2 и Al 2 O 3 –ZrO 2 и поверхности ликвидус диаграммы состояния тройной системы Cu 2 O–Al 2 O 3 –ZrO 2 было проведено нами ранее [6]. Для моделирования поверхности ликвидус диаграммы состояния тройной системы Cu2O–Al2O3–ZrO2 использовалось приближение теории субрегулярных ионных растворов со следующими значениями энергетических параметров:
Q 1123 = –1141 Дж/моль;
Q 1223 = +34831 Дж/моль;
Q 1233 = +6703 Дж/моль.
Рассчитанная диаграмма состояния системы Cu 2 O–Al 2 O 3 –ZrO 2 представлена на рис. 1 [6]. Координаты точек нонвариантных превращений I и II приведены в табл. 1.
Моделирование ПРКМ проводилось для температур 1200 и 1300 °С, характерных для производства меди и сплавов на ее основе. Согласно рис. 1 для температуры 1200 °С в равновесии с жидким металлом в системе Cu–Al–Zr–O будут находиться: оксидный расплав (Cu 2 O, Al 2 O 3 , ZrO 2 ); твердый оксид меди Cu 2 O; твердое соединение CuAlO 2 ; твердый оксид алюминия Al 2 O 3 ; твердый
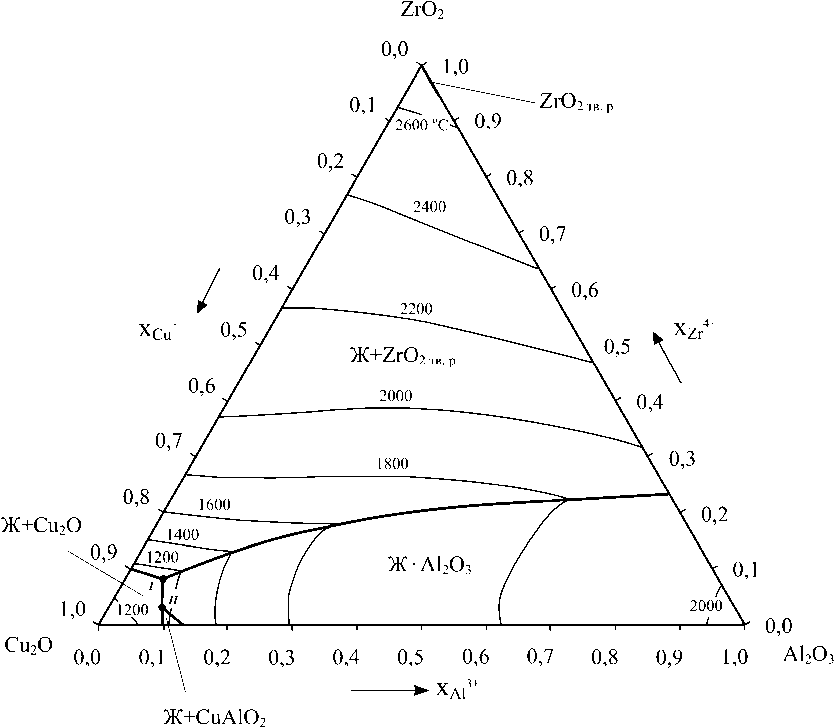
Рис. 1. Поверхность ликвидус диаграммы состояния системы Cu 2 O–Al 2 O 3 –ZrO 2 [6]
Таблица 1
раствор на основе оксида циркония ZrO2тв.р. Для температуры 1300 °С в равновесии с жидким металлом будут находиться: оксидный расплав (Cu 2 O, Al 2 O 3 , ZrO 2 ); твердый оксид алюминия Al 2 O 3 ; твердый раствор на основе оксида циркония ZrO 2тв.р .
Для построения ПРКМ необходимы сведения о константах равновесия реакций в исследуемой системе. Реакции, протекающие в медном расплаве системы Cu–Al–Zr–O, и температурные зависимости констант равновесия этих реакций приведены в табл. 2. Следует отметить, что компоненты шлакового расплава пишутся в круглых скобках, компоненты металлического расплава – в квадратных, а чистые твердые вещества указываются в прямых скобках. Для моделирования ПРКМ необходимы также сведения о параметрах взаимодействия компонентов в медном расплаве (табл. 3).
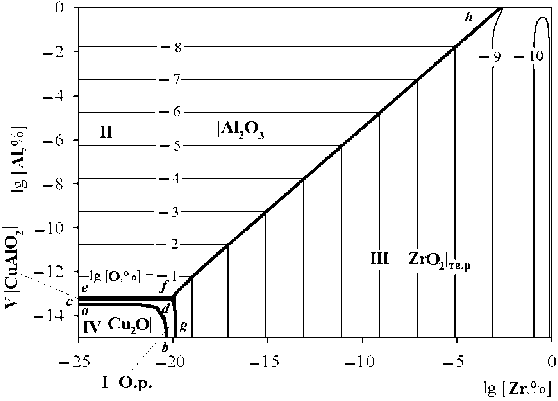
Результаты моделирования ПРКМ приведены на рис. 2 и 3 для температур 1200 и 1300 °С соответственно (концентрации определены в массовых
процентах). Область I определяет составы жидкого металла, равновесного с оксидным расплавом (О.р.); область II – с чистым твердым оксидом алюминия; область III – с твердым раствором на основе оксида циркония; область IV – с чистым твердым оксидом меди; область V – с чистым твердым соединением CuAlO2. Линия a–b определяет положение трехфазного равновесия «жидкий металл – оксидный расплав – чистый твердый оксид меди», линия c–d – «жидкий металл – оксидный расплав – чистое твердое соединение CuAlO 2 », линия d–f – «жидкий металл – оксидный расплав – чистый твердый оксид алюминия», линия f–g – «жидкий металл – оксидный расплав – твердый раствор на основе оксида циркония», линия e–d – «жидкий металл – чистый твердый оксид алюминия – чистое твердое соединение CuAlO 2 », линия f–h – «жидкий металл – чистый твердый оксид алюминия – твердый раствор на основе оксида циркония». При температуре 1200 °С реализуются две точки четырехфазного равновесия: точка d опре-
Координаты точек нонвариантных превращений на диаграмме состояния системы Cu 2 O–Al 2 O 3 –ZrO 2
|
Наименование точки |
Равновесие |
Т , °С |
x (Cu + ) |
x (Al3 + ) |
x (Zr4 + ) |
|
I |
«Ж–Cu 2 O–Al 2 O 3 –ZrO 2 тв.р » |
1105 |
0,8578 |
0,0598 |
0,0824 |
|
II |
«Ж–Cu 2 O–Al 2 O 3 –CuAlO 2 » |
1150 |
0,8849 |
0,0844 |
0,0307 |
Михайлов Г.Г., Макровец Л.А., Самойлова О.В.
Таблица 2
Константы равновесия процессов взаимодействия медного расплава и сопряжённых фаз ( lg K = A / T + B )
|
Уравнение реакции |
A |
B |
Источник |
|
(Cu 2 O) = 2[Cu]+ [O] |
–3141 |
2,251 |
[7] |
|
(Al 2 O 3 ) = 2[Al]+ 3 [O] |
–61 383 |
15,536 |
[Настоящая работа] |
|
(ZrO 2 ) = [Zr] + 2 [O] |
–41 999 |
8,956 |
[4] |
|
|Cu 2 O| = 2[Cu] +[O] |
–6500 |
4,468 |
[7] |
|
|Al 2 O 3 | = 2[Al] + 3[O] |
–67 016 |
17,960 |
[3] |
|
|ZrO 2 | = [Zr] + 2[O] |
–46 540 |
10,494 |
[2] |
|
|CuAlO 2 | = [Cu] + [Al] + 2[O] |
–36 876 |
11,191 |
[3] |
Таблица 3
Параметры взаимодействия первого порядка в медном расплаве e i j
|
j i |
O |
Al |
Zr |
|
O |
- 630/ T + 0,327 [8] |
- 371 T [3] |
- 250/ T [4] |
|
Al |
- 626/ T [3] |
- 891 T + 0,128 [3] |
0 |
|
Zr |
- 1425/ T [4] |
0 |
- 1407/ T [9] |
а)
б)
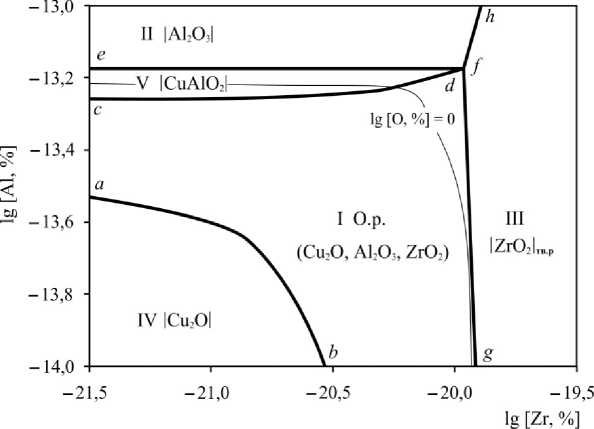
Рис. 2. ПРКМ системы Cu–Al–Zr–O для температуры 1200 °С: а – общий вид; б – увеличенный фрагмент равновесия жидкого металла с соединением CuAlO 2
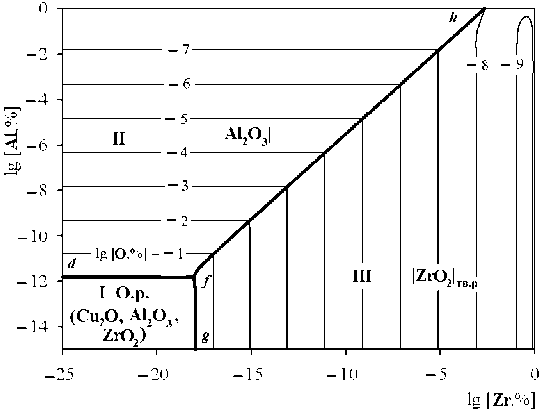
Рис. 3. ПРКМ системы Cu–Al–Zr–O для температуры 1300 °С
деляет состав жидкого металла, равновесного с оксидным расплавом, Al2O3, CuAlO2; точка f определяет состав жидкого металла, равновесного с оксидным расплавом, Al2O3, ZrO2тв.р. При температуре 1300 °С реализуется только одно четырехфазное равновесие в точке f , определяющее состав жидкого металла, равновесного с оксидным расплавом, Al 2 O 3 , ZrO 2тв.р .
Согласно проведенному моделированию при 1200 °С термодинамически маловероятно образование оксида меди и соединения CuAlO2 в присутствии значимых концентраций алюминия и циркония, растворенных в жидком металле. Основными продуктами раскисления для температур 1200 и 1300 °С будут являться Al2O3 и ZrO2тв.р.
Следует отметить, что в твердом растворе на основе оксида циркония ZrO 2тв.р содержится не более 2 мас. % оксида алюминия [10], оксид меди с оксидом циркония твердых растворов не образуют [11].
Тонкими линиями на ПРКМ нанесены изо-кислородные сечения. Концентрация кислорода в жидком металле резко уменьшается при увеличении концентраций алюминия и циркония, растворенных в жидком металле.
Для подтверждения выполненного моделирования для системы Cu–Al–Zr–O были проведены экспериментальные исследования. Составы образцов приведены в табл. 4.
Для проведения экспериментальных плавок использовались металлическая медь (чистота 99,99 мас. %), металлический алюминий (чистота
99,99 мас. %), металлический цирконий (чистота 99,9 мас. %), оксид меди Cu2O чистотой «ос.ч».
В процессе выплавки экспериментальных образцов в печи сопротивления в алундовых тиглях при температуре 1200 °С сплавляли медь с необходимым количеством алюминия и циркония. Затем в металлический расплав вводили оксид меди Cu 2 O (в качестве поставщика кислорода в расплав). Следует отметить, что количество использованного оксида меди было заведомо избыточным, так как учитывалась возможность всплытия его к поверхностным слоям расплава и перехода в шлаковую фазу. После восстановления температуры до 1200 °С тигли выдерживались в объёме печи в течение 20 мин. Затем тигли извлекали из печи и охлаждали на воздухе, на чугунном поддоне для хорошей теплоотдачи.
Далее металлические образцы разрезали вдоль вертикальной оси, после чего из них изготавливали шлифы, которые исследовали на растровом электронном микроскопе (РЭМ) JEOL JSM–6460LV, оснащенном спектрометром энергетической дисперсии фирмы «Oxford Instruments» для проведения качественного и количественного микрорентгеноспектрального анализа (МРСА).
Структура шлифов экспериментальных образцов приведена на рис. 4. Включения на образце № 1 представлены оксидом алюминия (темные включения). Включения на образце № 3 представлены оксидом циркония (светлые включения). Интересен образец № 2, так как по составу он должен попасть на линию тройного равновесия «металл –
Таблица 4
Составы образцов для проведения экспериментального исследования, мас. %
|
Номер образца п/п |
Al |
Zr |
Cu 2 O |
Cu |
|
1 |
0,200 |
– |
0,500 |
Ост. |
|
2 |
0,200 |
0,001 |
0,500 |
Ост. |
|
3 |
0,200 |
0,100 |
0,500 |
Ост. |
Михайлов Г.Г., Макровец Л.А., Термодинамическое описание фазовых равновесий в системе
Самойлова О.В. Cu–Al–Zr–O в условиях существования металлического расплава

а)

б)

в)
Рис. 4. Структура шлифов экспериментальных образцов: а – образец № 1; б – образец № 3; в, г – образец № 2

г)
оксид алюминия – о ксид цир к о ни я » . Со г л ас н о д анным МР СА в к л ючени я в обра з це № 2 пре дс та в л ены о к с и дом а люм и ни я (те мные включе н ия) и ок си дом ц ирко ни я (с в ет л ые вкл ючени я, отм а ркир о- в ан н ы е с тре л ко й с наим е н ов а ние м ). Р а с пре де ле ние в кл ючени й из м е н яе тс я от в е р х ней ча с т и о бразца (рис. 4, в ) к н и ж ней ч а с ти (рис . 4, г). Также в стре ча ютс я ком п л е ксные в ключе ния, состоящие из н ескол ь ки х с в етл ы х и т е м ных у ча с т ков , соо т в етс т вую щи х окс и д у цир кони я и окс и д у ал юминия соответственно.
В це л ом , экспе рим е н та л ь ны е ре зул ь та ты по д тв ерж д а ют ра с че тные данн ые о фа зов ых ра в новесиях в системе Cu–Al–Zr–O.
Выводы
Цирконий является более сильным раскислителем в медном расплаве, чем алюминий. Как при 1200, так и при 1300 °С согласно проведенному моделированию фактически не реализуется механизм комплексного раскисления, а преобладает альтернативное. Только при значительном понижении концентрации циркония в металлическом расплаве, связанном, например, с образованием включений оксида циркония, в качестве раскисли- теля начнет выступать алюминий. Соответственно в лигатурах для раскисления содержание алюминия должно быть выше, чем содержание циркония, что выгодно и с экономической точки зрения. Либо возможно разделить процесс удаления кислорода на две стадии: основное раскисление проводить лигатурами с алюминием, а лишь затем добавлять цирконий в металлический расплав для достижения более низких концентраций кислорода, чем это возможно при использовании алюминия.
Работа осуществлена при финансовой поддержке РФФИ, грант № 16-08-00133 а.
Список литературы Термодинамическое описание фазовых равновесий в системе Cu-Al-Zr-O в условиях существования металлического расплава
- Производство отливок из сплавов цветных металлов: учеб. для вузов/А.В. Курдюмов, М.В. Пикунов, В.М. Чурсин, Е.Л. Бибиков. -М.: Металлургия, 1986. -416 с.
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Михайлов, Г.Г. Фазовые равновесия в многокомпонентных системах с жидкими цветными металлами/Г.Г. Михайлов, Е.А. Трофимов, А.Ю. Сидоренко. -М.: Издат. Дом МИСиС, 2014. -158 с.
- Термодинамический анализ процессов взаимодействия в системе Cu-Zr-O, реализующихся в условиях существования медного расплава/О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец, Е.А. Трофимов//Вестник ЮУрГУ. Серия «Металлургия». -2014. -Т. 14, № 4. -С. 17-22.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Термодинамическое моделирование поверхности ликвидус диаграммы состояния системы Cu2O-Al2O3-ZrO2/О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец и др.//Вестник ЮУрГУ. Серия «Металлургия». -2015. -Т. 15, № 4. -С. 15-21.
- Трофимов, Е.А. Взаимодействие никеля с кислородом в жидкой меди/Е.А. Трофимов, Г.Г. Михайлов//Известия вузов. Цветная металлургия. -2002. -№ 2. -С. 10-13.
- Линчевский, Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами/Б.В. Линчевский. -М.: Металлургия, 1986. -222 с.
- Gierlotka, W. Thermodynamic description of the binary Cu-Zr system/W. Gierlotka, K.-Ch. Zhang, Y.-P. Chang//Journal of Alloys and Compounds. -2011. -Vol. 509. -P. 8313-8318 DOI: 10.1016/j.jallcom.2011.04.141
- Бережной, А.С. Многокомпонентные системы окислов/А.С. Бережной. -Киев: Наукова думка, 1970. -544 с.
- Gadalla, A.M.M. Equilibrium Relationships in the System CuO-Cu2O-ZrO2/A.M.M. Gadalla and J. White//Transactions of the British Ceramic Society. -1966. -Vol. 65, no. 7. -P. 383-390.


