Термодинамическое описание фазовых равновесий в системе Cu2O-CeO2-Ce2O3-La2O3
Автор: Самойлова Ольга Владимировна, Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 1 т.17, 2017 года.
Бесплатный доступ
С использованием теорий совершенных ионных растворов и субрегулярных ионных растворов проведено термодинамическое моделирование линий ликвидуса для двойных оксидных фазовых диаграмм и поверхностей ликвидуса для тройных оксидных фазовых диаграмм, составляющих систему Cu2O-CeO2-Ce2O3-La2O3. Линия солидуса, ограничивающая существование твердого раствора в системе CeO2-La2O3, рассчитывалась с использованием теории регулярных ионных растворов. В ходе работы определены параметры применяемых моделей и температурные зависимости констант равновесия реакций перехода веществ из твердого состояния в жидкое, используемые для расчета фазовых диаграмм исследуемых систем. Большинство систем (Cu2O-CeO2, Cu2O-Ce2O3, Cu2O-La2O3, CeO2-Ce2O3, Ce2O3-La2O3, Cu2O-CeO2-Ce2O3, Cu2O-Ce2O3-La2O3) представляют собой диаграммы эвтектического типа с одной точкой эвтектики. Для вышеперечисленных систем, включающих Cu2O как компонент, характерны достаточно низкие температуры эвтектического равновесия. Система CeO2-La2O3 характеризуется наличием твердого раствора и точкой на линии ликвидуса, имеющей нулевой интервал кристаллизации. Фазовые диаграммы Cu2O-CeO2-La2O3 и CeO2-La2O3-Ce2O3 характеризуются наличием обширной области равновесия оксидного расплава с твердым раствором |CeO2, La2O3|тв.р.
Система cu2o-ceo2-ce2o3-la2o3, термодинамическое моделирование, фазовые равновесия
Короткий адрес: https://sciup.org/147157068
IDR: 147157068 | УДК: 669.35 | DOI: 10.14529/met170102
Текст научной статьи Термодинамическое описание фазовых равновесий в системе Cu2O-CeO2-Ce2O3-La2O3
Использование редкоземельных элементов (РЗМ) в качестве элементов-раскислителей при производстве меди и сплавов на ее основе [1, 2] требует данных не только по термодинамике процессов, происходящих в металлическом расплаве, но также и сведений о сопряженном с жидким металлом оксидном шлаковом расплаве, содержащем оксиды РЗМ.
В литературе практически не встречается данных о диаграммах состояния систем вида «оксид меди Cu2O – оксид/оксиды РЗМ». Целью данной работы является построение двойных и тройных диаграмм состояния, входящих в систему Cu 2 O–CeO 2 –Ce 2 O 3 –La 2 O 3 .
Подробно методика моделирования диаграмм состояния оксидных систем приведена в работах [3, 4]. Расчет должен опираться на координаты (состав и температура) наиболее надежно определенных характерных точек на диаграммах: точек эвтектических, перитектических, фазовых переходов (например, плавления веществ в исследуемой системе) и т. п. Таким образом, для моделирования диаграмм состояния необходимы сведения о температу- рах и теплотах плавления веществ исследуемой системы. В табл. 1 приведены данные для веществ, составляющих систему Cu2O–CeO2– Ce2O3–La2O3. В табл. 2 приведены температурные зависимости констант равновесия процесса перехода веществ из твердого состояния в жидкое, рассчитанные по формуле (использованы сведения из табл. 1):
оо
AmHT о A тнт о lg Кц л =--m--+--m .
пл 2,3026 RT 2,3026 RTm о
Здесь K пл – константа равновесия перехода твердого вещества в жидкое состояние; A mH O o - теплота плавления вещества,
Tm
Дж/моль; Tmo – температура плавления веще- ства, К; R – универсальная газовая постоянная, R = 8,314 Дж/моль·К.
Для моделирования линий ликвидуса фазовых диаграмм Cu 2 O–CeO 2 , Cu 2 O–Ce 2 O 3 , Cu 2 O–La 2 O 3 , CeO 2 –Ce 2 O 3 , Ce 2 O 3 –La 2 O 3 и поверхностей ликвидуса фазовых диаграмм Cu 2 O–CeO 2 –Ce 2 O 3 , Cu 2 O–Ce 2 O 3 –La 2 O 3 использовалось приближение теории совершенных ионных растворов [3]. Согласно этой теории
Таблица 1
Данные о температурах и теплотах плавления веществ
|
Вещество |
o Tm , С |
A mH O o , Дж/моль Tm |
|
Cu 2 O |
1242 [5] |
64300 [5] |
|
CeO 2 |
2397 [6] |
79549 [7] |
|
Ce 2 O 3 |
2210 [8] |
83736 [7] |
|
La2O3 |
2301 [9] |
78000 [9] |
Таблица 2 Температурные зависимости для констант равновесия, характеризующих процесс перехода вещества из твердого состояния в жидкое
|
Вещество |
lg K |
|
Cu 2 O |
- 3359/ T + 2,217 |
|
CeO 2 |
- 4155/ T + 1,556 |
|
Ce 2 O 3 |
- 4374/ t + 1,762 |
|
La2O3 |
- 4074/ t + 1,5 83 |
Таблица 3
Сведения о координатах эвтектического равновесия в исследуемых системах
Для указанных выше систем в литературе практически нет данных о виде фазовых диаграмм. Для системы CeO2–Ce2O3 по результатам проведенного авторами работы [10] моделирования имеются сведения о наличии эвтектического превращения при температуре 1803 °С. Имеются данные о наличии соединения Cu2O·La2O3 (CuLaO2) в системе Cu2O–La2O3 [11–14]. Практически все исследователи указывают на твердофазный распад данного соединения, то есть на то, что это соединение не может находиться в равно- весии с оксидным расплавом. Только в работе [14] в ячейке EMF при температурах порядка 1012 °С появилась жидкая фаза, однако авторы работы никак не объясняют данный результат и, тем более, не связывают его с плавлением CuLaO2 или образованием эвтектики с участием этого соединения. По результатам проведенного нами моделирования соединение CuLaO2 распадается при температуре 1100 °С без выхода на линию ликвидуса.
Результаты расчета поверхностей ликвидуса фазовых диаграмм систем Cu 2 O–CeO 2 – Ce 2 O 3 и Cu 2 O–Ce 2 O 3 –La 2 O 3 приведены на рис. 1 и 2 соответственно.
Моделирование линии ликвидуса системы CeO2–La2O3 проводилось с использованием приближения теории субрегулярных ионных растворов [3], согласно которому активности компонентов раствора равны:
1g ax =V i 1g x i +
V i Г 3 x 2 x 2 S iii2 + x i x 2 ( 2 - 3 x i ) 6 1122 + x 2 ( 1 - 3 x i ) S i222
2,3026 RT
;
1g a 2 =V 2 1g x 2 +
V 2 Г x i3 ( i - 3 x 2 ) S iii2 + x 2 x 2 ( 2 - 3 x 2 ) S ii22 + 3 x 2 x 2 6 i222
2,3026 RT
где ν i – число катионов в молекуле компонента; x i – ионная доля компонента; Q ijkl – ские параметры теории, Дж/моль; Т – температура, К; R – универсальная газовая R = 8,314 Дж/моль·К.
энергетиче-постоянная,
Ce2O3
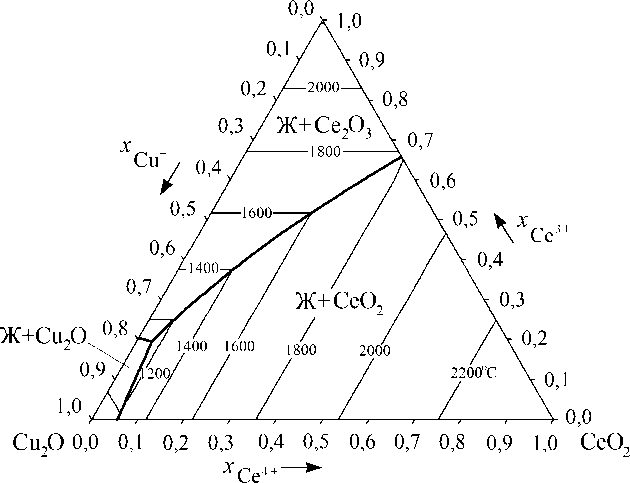
Рис. 1. Результаты расчета поверхности ликвидуса фазовой диаграммы системы Cu 2 O–CeO 2 –Ce 2 O 3
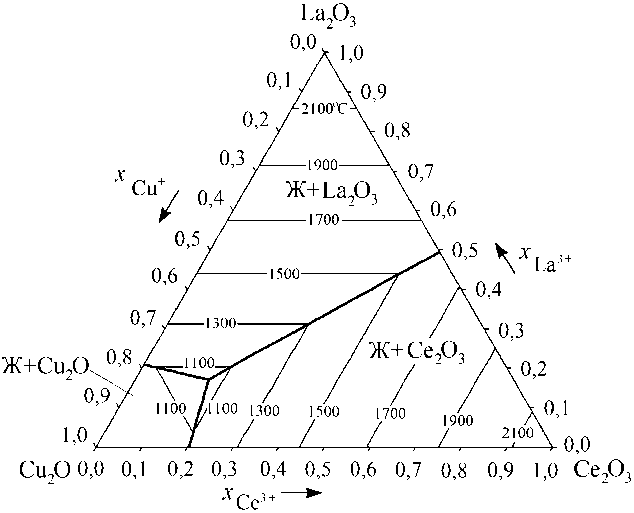
Рис. 2. Результаты расчета поверхности ликвидуса фазовой диаграммы системы Cu 2 O–Ce 2 O 3 –La 2 O 3
Моделирование линии солидуса, ограничивающей область существования твердого раствора в системе CeO 2 –La 2 O 3 , проводилось с использованием теории регулярных ионных растворов [3], согласно которой активности равны:
1g ax = Vj 1g xx + V 1 x 2 Q12 ; (4)
-
1 1 1 2,3026 RT
1g a 2 = v2 1g x 2 + V 2 x 1 Q 12 , (5)
-
2 2 2 2,3026 RT
где ν i – число катионов в молекуле компонента; x – ионная доля компонента; Q 12 – энергетический параметр теории, Дж/моль; Т – температура, К; R – универсальная газовая постоянная, R = 8,314 Дж/моль·К.
В ходе моделирования фазовой диаграммы CeO 2 –La 2 O 3 с использованием нескольких характерных точек для поиска энергетических параметров применяемых моделей составлялась система нелинейных уравнений, которая решалась с использованием метода Ньютона. После того, как энергетические параметры были найдены, линии ликвидуса и солидуса рассчитывались целиком.
Результаты моделирования фазовой диаграммы системы CeO 2 –La 2 O 3 приведены на рис. 3. При моделировании учитывалась возможность образования твердых растворов в данной системе [15]. Согласно результатам расчета линия ликвидуса системы CeO 2 –La 2 O 3
характеризуется точкой минимума, имеющей нулевой интервал кристаллизации, что совпадает с данными работы [16]. Энергетические параметры теории субрегулярных ионных растворов оказались равными (Дж/моль): Q 1112 =–20 816; Q 1122 =–16679; Q 1222 =–61445. Энергетический параметр теории регулярных ионных растворов равен Q 12 = –6843 Дж/моль.
Для расчета поверхностей ликвидуса систем Cu 2 O–CeO 2 –La 2 O 3 (рис. 4) и CeO 2 –La 2 O 3 – Ce 2 O 3 (рис. 5) использовалась совокупность теорий совершенных ионных растворов, субрегулярных ионных растворов и регулярных ионных растворов. Для системы Cu 2 O–CeO 2 –La 2 O 3 вводились дополнительные перекрестные энергетические параметры теории субрегулярных ионных растворов, которые подбирались методом последовательных итераций. Численно эти параметры оказались равны (Дж/моль): Q 1123 =–20565; Q 1223 =–51538; Q 1233 =–30722.
Таким образом, по результатам моделирования при добавлении в систему с простой эвтектикой Cu 2 O–CeO 2 третьего компонента La 2 O 3 , фазовая диаграмма тройной оксидной системы Cu 2 O–CeO 2 –La 2 O 3 характеризуется обширной областью равновесия оксидного расплава с твердым раствором |CeO 2 , La 2 O 3 | тв.р . Диаграмма состояния системы CeO 2 –La 2 O 3 – Ce 2 O 3 также характеризуется наличием области равновесия оксидного расплава с твердым раствором |CeO 2 , La 2 O 3 | тв.р .
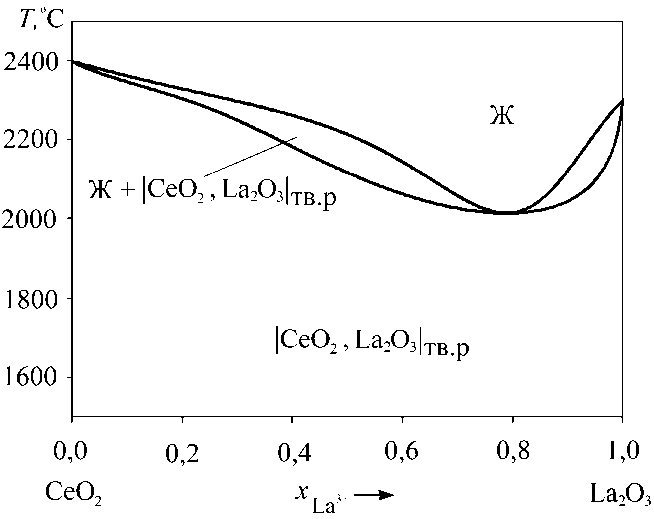
Рис. 3. Результаты расчета фазовой диаграммы системы CeO 2 –La 2 O 3
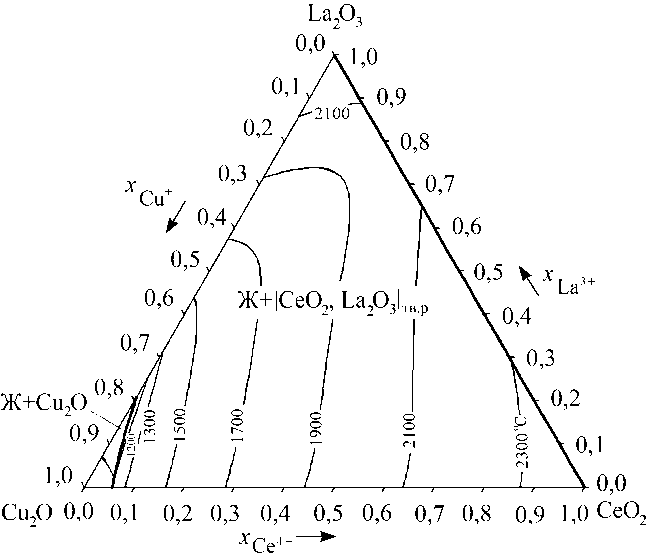
Рис. 4. Результаты расчета поверхности ликвидуса фазовой диаграммы системы Cu 2 O–CeO 2 –La 2 O 3
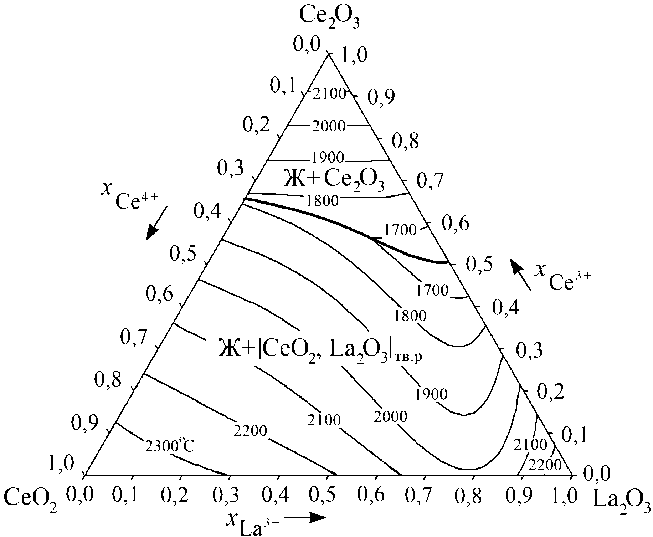
Рис. 5. Результаты расчета поверхности ликвидуса фазовой диаграммы системы CeO 2 –La 2 O 3 –Ce 2 O 3
Выводы
Проведено термодинамическое описание фазовых равновесий в двойных и тройных диаграммах состояния, составляющих систему Cu2O–CeO2–Ce2O3–La2O3. Определены термодинамические модели и их параметры, необходимые для описания фазовых диаграмм ис- следуемых систем. По результатам расчета показано, что системы Cu2O–CeO2, Cu2O– Ce2O3, Cu2O–La2O3, CeO2–Ce2O3, Ce2O3–La2O3, Cu2O–CeO2–Ce2O3, Cu2O–Ce2O3–La2O3 представляют собой диаграммы эвтектического типа с одной точкой эвтектики. Для вышеперечисленных систем, включающих Cu2O как компонент, характерны достаточно низкие температуры эвтектического равновесия, которое смещено по составу в сторону больших концентраций оксида меди. Также показано, что соединение CuLaO2 в системе Cu2O–La2O3 распадается при температуре 1100 °С без выхода на линию ликвидуса. Системы CeO2– La2O3, Cu2O–CeO2–La2O3 и CeO2–La2O3–Ce2O3 характеризуются наличием твердого раствора |CeO2, La2O3|тв.р.
Работа осуществлена при финансовой поддержке РФФИ, грант № 16-38-60144 мол_а_дк.
Список литературы Термодинамическое описание фазовых равновесий в системе Cu2O-CeO2-Ce2O3-La2O3
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Судавцова, В.С. Влияние лития, бора, магния и иттрия на активность кислорода в жидкой меди/В.С. Судавцова, М.В. Михайловская, А.В. Калмыков//Расплавы. -1987. -Т. 1, № 2.-С. 43-46.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Михайлов, Г.Г. Фазовые равновесия в многокомпонентных системах с жидкими цветными металлами/Г.Г. Михайлов, Е.А. Трофимов, А.Ю. Сидоренко. -М.: Издат. Дом МИСиС, 2014. -158 с.
- Химическая энциклопедия: в 5 т./под ред. И.Л. Кнунянца. -М.: Сов. энцикл, 1990. -Т. 2. -671 с.
- Мордовин, О.А. Определение температур плавления окислов редкоземельных элементов/О.А. Мордовин, Н.И. Тимофеева, Л.Н. Дроздова//Неорганические материалы. -1967. -Т. III, № 1. -С. 187-189.
- Физико-химические свойства окислов. Справочник/под ред. Г.В. Самсонова. -М.: Металлургия, 1969. -456 с.
- Sata, T. Some material properties of cerium sesquioxide/T. Sata, M. Yoshimura//J. Ceram. Assoc. Japan. -1968. -Vol. 76, no. 4. -P. 116-122.
- Ushakov, S.V. Direct measurements of fusion and phase transition enthalpies in lanthanum oxide/S.V. Ushakov, A. Navrotsky//Journal of Materials Research. -2011. -Vol. 26, no. 7. -P. 845-847 DOI: 10.1557/jmr.2010.79
- Zinkevich, M. Thermodynamic modelling of the cerium-oxygen system/M. Zinkevich, D. Djurovic, F. Aldinger//Solid State Ionics. -2006. -Vol. 177. -P. 989-1001 DOI: 10.1016/j.ssi.2006.02.044
- Thermodynamic stability of ternary oxides in Ln-M-O (Ln = La, Pr, Nd; M = Co, Ni, Cu) systems/A.N. Petrov, V.A. Cherepanov, A.Yu. Zuyev, V.M. Zhukovsky//Journal of Solid State Chemistry. -1988. -Vol. 77, no. 1. -P. 1-14 DOI: 10.1016/0022-4596(88)90083-7
- LaCuO2.5+x and YCuO2.5+x delafossites: materials with triangular Cu2+δ planes/R.J. Cava, H.W. Zandbergen, A.P. Ramirez et al.//Journal of Solid State Chemistry. -1993. -Vol. 104, no. 2. -P. 437-452 DOI: 10.1006/jssc.1993.1179
- Kucharski, R. Reduction and oxidation of simple oxocuprates/R. Kucharski, Z. Gontarz//Journal of Thermal Analysis and Calorimetry. -2000. -Vol. 60, no. 1. -P. 219-227 DOI: 10.1023/A:1010121913036
- Jacob, K.T. Phase relations in the system Cu-La-O and thermodynamic properties of CuLaO2 and CuLa2O4/K.T. Jacob, K.P. Jayadevan//Journal of Materials Science. -2002. -Vol. 37, no. 8. -P. 1611-1620 DOI: 10.1023/A:1014957910889
- Minkova, N. Isomorphic substitutions in the CeO2-La2O3 system at 850 °C/N. Minkova, S. Aslanian//Crystal Research and Technology. -1989. -Vol. 24, no. 4. -P. 351-354 DOI: 10.1002/crat.2170240402
- Measurement and calculation of the ZrO2-CeO2-LaO1.5 phase diagram/Y. Du, M. Yashima, T. Koura et al.//Calphad. -1996. -Vol. 20, no. 1. -P. 95-108 DOI: 10.1016/0364-5916(96)00017-X


