Термодинамическое описание процесса сорбции ванадия на углеродсодержащем сорбенте
Автор: Ординарцев Денис Павлович, Свиридов Алексей Владиславович, Свиридов Владислав Владимирович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 2 т.16, 2016 года.
Бесплатный доступ
Показана возможность сорбционного извлечения соединений ванадия из кислых сред на высокоразвитой поверхности активированного древесного угля, модифицированного катионными ПАВ. Установлено, что сорбируются преимущественно полиоксосоединения ванадия. Доказано, что сорбционному извлечению ванадия из водного раствора не мешают ионы меди, никеля, железа, кальция, магния, натрия и калия. Наилучшие показатели сорбции ванадия на модифицированном углеродсодержащем сорбенте достигаются в диапазоне рН от 2 до 4, то есть в кислой области. При данных значениях рН гидроксиды других металлов еще не начинают осаждаться, что позволяет получить чистый продукт. Уменьшение сорбции ванадия при увеличении рН среды связано с тем, что полианионы ванадия, которым соответствуют поликислоты состава: Н2V4O11, Н6V10O28, H4V6O17, распадаются на анионы, которым соответствуют кислоты состава: Н4V2O7, HVO3, H3VO4. Таким образом, на один сорбционный центр улавливается анион, содержащий меньшее количество атомов ванадия. Заполнение поверхности сорбента соединениями ванадия идет по типу сорбции Ленгмюра, что позволяет провести термодинамическое описание процесса и определить основные энергетические составляющие. Термодинамические исследования показали, что извлечение ванадия сводится к физической адсорбции полиоанионов на положительно заряженной поверхности древесного угля (степень извлечения составляет 84 %). Вывод о физической адсорбции сделан исходя из того, что ΔG реакции с увеличением температуры уменьшается, а тепловой эффект реакции не превышает 13 кДж/моль. Дополнительно продукты обжига насыщенного сорбента исследованы при помощи рентгенофазового анализа. На рентгенограмме обнаружены фазы оксида ванадия V2O5 и сложного оксида на основе оксида ванадия и оксида марганца состава MnO∙V2O5. Таким образом, конечный продукт обжига насыщенного сорбента - пентоксид ванадия с примесями марганца. Если проводить обжиг насыщенного сорбента совместно с восстановителем, то можно получить металлический ванадий. При этом степень чистоты конечных продуктов составляет порядка 99 %.
Сорбционное извлечение ванадия, модифицированные углеродсодержащие сорбенты, термодинамика сорбции ванадия
Короткий адрес: https://sciup.org/147157015
IDR: 147157015 | УДК: 66.081 | DOI: 10.14529/met160202
Текст научной статьи Термодинамическое описание процесса сорбции ванадия на углеродсодержащем сорбенте
Основной потребитель ванадия – черная металлургия, где его используют как легирующий элемент для выплавки специальных сортов сталей [1, 2]. Даже небольшие добавки его существенно повышают прочность стали, уменьшают размер зерна, снижают склонность стали к перегреву, улучшают свариваемость и многие другие физико-механические, технологические и эксплуатационные свойства. В настоящее время также велика потребность в пентоксиде ванадия. Этот материал нашел широкое применение в производстве феррованадиевых сплавов [3], катализаторов для производства серной кислоты, катализаторов, использующихся в крупнотоннажном органическом синтезе [4, 5] как компонент стекол и люминофоров.
Основной промышленный источник получения ванадия – железные руды, содержащие ванадий как примесь. Сложности, возникающие при получении ванадия в гидрометаллургическом производстве, состоят в следующем. Во-первых, ванадий необходимо селективно отделить от сопутствующих ионов металлов, которые переходят в раствор при кислотном вскрытии железных руд. Во-вторых, ванадий образует большое количество разнообразных соединений, в зависимости от концентрации и рН среды [3–6].
Существует достаточно много способов получения чистого пентоксида ванадия, таких как содово-карбонатно-аммиачная технология [4], методы хлорирования ванадийсодержащего сырья, осаждение содой и известковая технология, экстракционные и сорбционные методы [7–10]. Наименее изученными и наиболее перспективными являются сорбционные методы, которые в основном представлены улавливанием ванадия на анионообменных смолах и сорбентах на основе специфических матриц [7–11]. Среди недостатков способов можно отметить недостаточно высокую селективность, введение дополнительной стадии регенерации ионообменной смолы или стадии отмывки сорбента от соединений ванадия, образование большого количества промывного раствора. Также не акцентируется внимание на дальнейшем извлечении ванадия с поверхности насыщенного сорбента.
По нашему мнению, одной из актуальных задач является изучение возможностей селективного сорбционного извлечения ванадия из кислых растворов на высокодисперсных модифицированных углеродсодержащих сорбентах. Использование такой технологии позволяет избежать многих перечисленных выше недостатков [7, 12].
В качестве объекта исследования использовали жидкий полупродукт, полученный после сернокислотной гидрометаллургической обработки ванадиевого шлака Чусовского металлургического завода – ОАО «ЧМЗ». В раствор дополнительно были введены сульфаты металлов Ni, Fe, Cu с целью изучения, селективности процесса извлечения ванадия. Состав кислого раствора, проанализированный на приборе Optima 4300 c индуктивносвязанной плазмой, приведен в табл. 1.
Таблица 1
Состав кислого ванадийсодержащего раствора
|
Элемент (в пересчете на оксид) |
Содержание, г/дм3 |
|
V 2 O 5 |
0,18 |
|
MnO |
3,12 |
|
CaO |
0,69 |
|
MgO |
0,13 |
|
Na2O |
3,60 |
|
K 2 O |
0,14 |
|
NiO |
1,0 |
|
Fe 2 O 3 |
3,0 |
|
CuO |
1,0 |
|
SO 4 2– |
10,4 |
|
NO 3 |
1,0 |
|
Сухой остаток |
13,3 |
В качестве исходного материала для сорбции использовали березовый уголь марки БАУ. Первая стадия подготовки сорбента состояла в измельчении угля на шаровой мельнице до размеров частиц от 1 до 5 мкм. При этом площадь удельной поглощающей поверхности составляла 400 м2/г, что говорит о преобладании микропор в структуре сорбента. Суммарный объем пор по воде 1,7 см3/г. Далее проводили обработку угля 10%-ным водным раствором катионного ПАВ. Уголь выдерживали в растворе катионного ПАВ при постоянном перемешивании в течение 2 ч. В качестве катионного ПАВ использовали дидецилдиметилбензиламмо-ний хлорид, марки хч, значение ККМ составляет
0,0189 моль/л. Полученный сорбент (БАУ-М) промывали, отфильтровывали и сушили при комнатной температуре. Модификатор в виде катионного ПАВ прививали на поверхность активированного угля с целью увеличения количества положительно заряженных сорбционных центров. Закрепление катионного ПАВ на поверхности угля происходило за счет гидрофобного взаимодействия углеводородного радикала ПАВ с неполярными участками поверхности сорбента и наружной ориентацией полярных групп. Модификация угля схематично показана на рис. 1.
Исходя из приведенной схемы, сорбционный процесс должен сводиться к обмену Cl– и OH– на анионы ванадия.
Сорбцию ванадия проводили в диапазоне температур от 22 до 55 °С, температуру контролировали и измеряли при помощи термостата LT-TWC/7, при рН раствора от 1 до 10 и при исходной концентрации ионов ванадия от 0,2 до 27 ммоль/л. На первом этапе осуществляли быстрое перемешивание сорбента при помощи лопастной мешалки RB-25/40-RM (400 об/мин) для его равномерного распределения по всему объему раствора, а затем медленное перемешивание (50 об/мин) до установления сорбционного равновесия. Твердую фазу отделяли от жидкой фазы при помощи центрифугирования при 8000 об/мин на центрифуге ОПн-8. Концентрацию ванадия в ходе сорбционного процесса контролировали фотокалориметрически на приборе КФК-2. В методе прямой фотокалориметрии использовали свойство ванадия образовывать окрашенные комплексы с перекисью водорода в кислой среде, с пиком интенсивности при длине волны 440 нм, кювету использовали объемом 25 мл. В качестве реагентов для анализа использовали 3%-ную медицинскую перекись водорода и концентрированную серную кислоту марки х.ч. Сорбцию измеряли по разности концентраций ванадия в растворе до и после сорбции.
Время перемешивания во всех случаях составляло 10 мин. Этого времени было достаточно для установления сорбционного равновесия. Из графика, приведенного на рис. 2, следует, что поверхность сорбента насыщается через 6 мин,
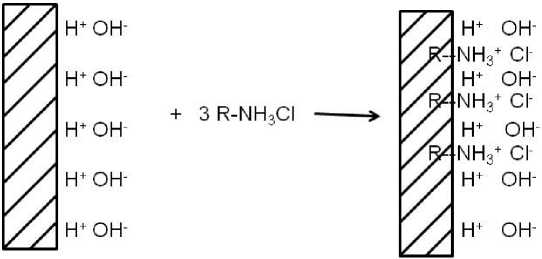
Рис. 1. Схема модификации поверхности угля катионным ПАВ
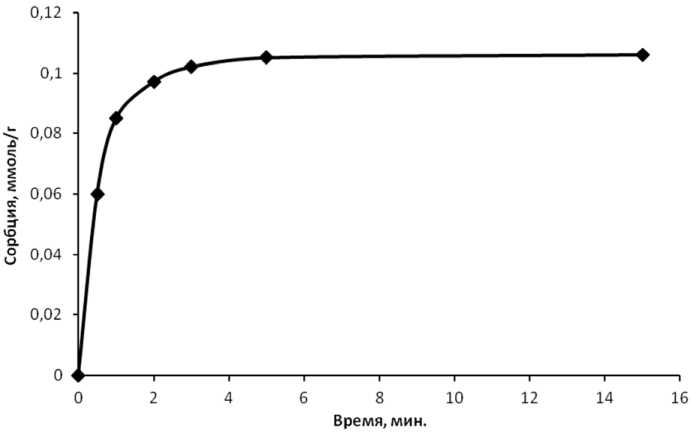
Рис. 2. Зависимость сорбции ванадия от времени
при исходной концентрации ванадия 0,03 моль/л и при рН раствора 3,4 температура раствора составляла 22 °С.
Подобная скорость установления сорбционного равновесия позволяет предположить, что сорбция соединений ванадия на поверхности сорбента протекает без видимых энергетических затруднений, а лимитирующей стадией процесса является диффузия адсорбтива к поверхности адсорбента.
На рис. 3 приведены изотермы сорбции в зависимости от количества введенного модификатора. Лучшие показатели сорбции наблюдали при количестве модификатора 1 % от массы угля.
Дальнейшее увеличение количества модификатора (выше 1 %) не приводит к улучшению показателя сорбции ванадия на угольном сорбенте.
Как уже говорилось выше, ванадий в растворе образует множество различных соединений. Наиболее подробно соединения ванадия описаны в работе [2]. В зависимости от концентрации и рН среды, ванадий в растворе может находиться в анионной или катионной форме. При рН < 1 ванадий в основном находится в форми катиона VO2+, а при рН > 13 в форме ортованадат-аниона VO4–. В области рН от 2 до 6 и при концентрации > 1 ммоль/л ванадий существует в форме различных полиионов, таких как H 2 V 10 O 28 4–, HV 10 O 28 5–,
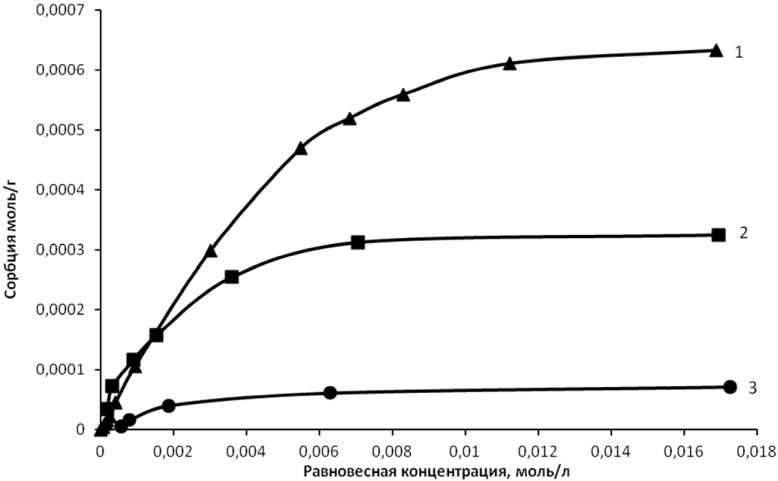
Рис. 3. Изотермы сорбции ванадия при разных количествах модификатора: 1 – концентрация модификатора 1 % от массы сорбента; 2 – концентрация модификатора 0,5 % от массы сорбента; 3 – сорбент без модификатора
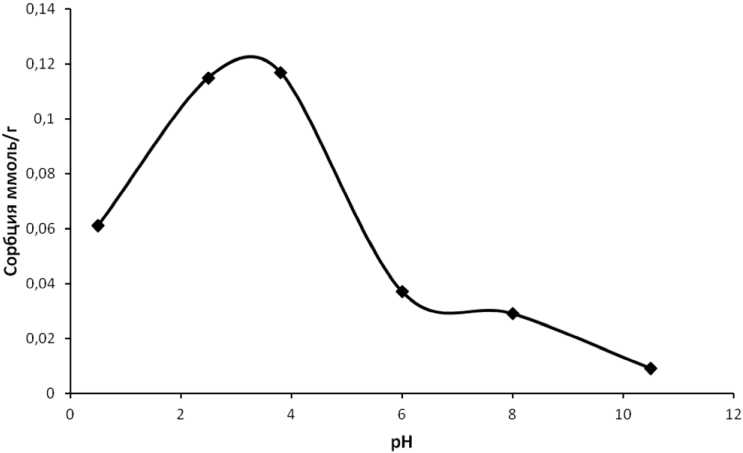
Рис. 4. Зависимость сорбции ванадия на сорбенте БАУ-М от рН среды
V10O286–. Также в литературе можно встретить данные о существовании переходного полииона ванадия с общей формулой V 12 O 33 6– [3], но пока существование данного иона является лишь предположением, которое основывается на косвенных доказательствах.
На рис. 4 приведена зависимость сорбции ванадия на угле (БАУ-М) от рН среды при исходной концентрации ванадия 5 ммоль/л.
Из рис. 4 следует, что сорбция ванадия протекает наиболее полно в диапазоне рН от 2,5 до 4. В этой области значений рН ванадий существует в форме полианионов, преимущественно H 2 V 10 O 28 4–, HV 10 O 28 5–. Таким образом, на один сорбционный центр приходится 10 атомов ванадия, входящих в состав полисоединений.
При повышении рН сорбция ванадия в интервале 6–8 снижается в связи с преобладанием в растворе анионов V3O93–, VO3–, имеющих меньшее энергетическое сродство с активными центрами поверхности сорбента. С дальнейшим повышением значения рН > 6, сорбция продолжает падать, поскольку возрастает концентрация ОН–-ионов, конкурирующих с ванадат-анионами за место на активных участках поверхности.
Из изложенного следует, что наиболее оптимальная область извлечения ванадия находится в пределах значений рН – 2–4. Дополнительным преимуществом извлечения ванадия в кислой среде является то, что практически исключается вероятность выпадения гидроксидов сопутствующих металлов и загрязнения ими конечного продукта.
На рис. 5 приведены изотермы сорбции ванадия на модифицированном угле при различных значениях рН среды. Также на рисунке указана извлекаемая форма ванадия, то есть та ионная структура ванадия, которая улавливается одним сорбционным центром сорбента БАУ-М.
Таким образом, основной особенностью сорбента можно считать его высокую активность в отношении поливанадат-ионов. Именно поэтому лучшие показатели по сорбции достигнуты при рН 3,4 и при концентрации ванадия от 4 до 16 ммоль/л. При концентрации ванадия ниже 4 ммоль/л величина сорбции резко уменьшается из-за того, что полиионы H2V10O284– и HV10O285– распадаются на метаванадат-ионы VO3–.
Изотерма сорбции поливанадат-ионов при рН 3,4 описывается уравнением Ленгмюра:
Г = Г
да
KC
1 + KC ’
где K – равновесная константа сорбции; Г – сорбция сорбента, моль/г; Г да - предельная сорбция, моль/г; С – равновесная концентрация адсорбата, моль/л.
Величину предельной сорбции Гда и кон- станту сорбционного равновесия K определяли графически из уравнения Ленгмюра в линейном виде:
C _ C 1
Г = Г , ' г , к ■
Сорбция мономолекулярных соединений при рН < 1,5 и при рН > 7,0 описывается уравнением Генри:
Г _ KC , (3) где K – константа Генри; С – равновесная концентрация, моль/л.
Из рис. 5 видно, что для полного извлечения ванадия при этих значениях рН требуется значительно больший расход адсорбента.
Для выявления механизма сорбции были дополнительно проведены термодинамические исследования, для чего изучали сорбцию ванадия в зависимости от температуры (рис. 6).
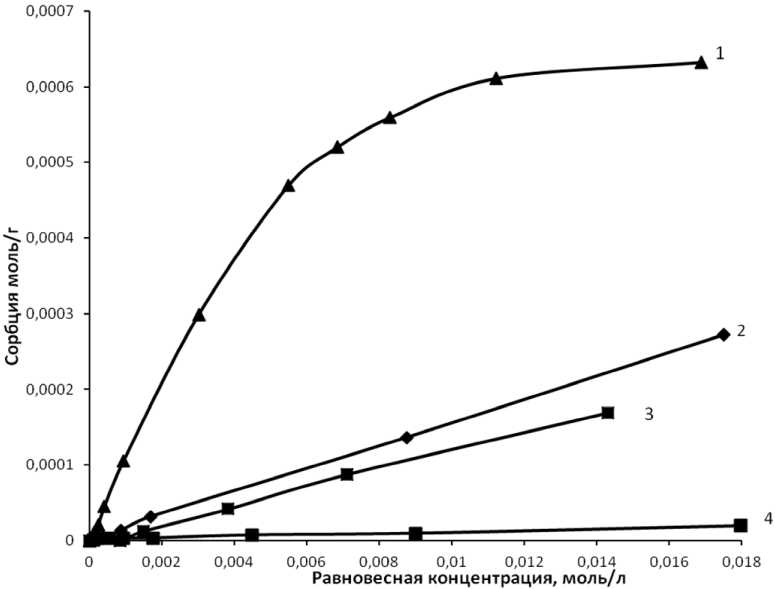
Рис. 5. Изотермы сорбции ванадия на модифицированном угольном сорбенте: 1 – сорбция иона H 2 V 10 O 28 4– (рН = 3,4); 2 – сорбция иона VO2+ (рН = 0,9); 3 – сорбция иона V 3 O 9 3– (рН = 7,8);
4 – сорбция иона HVO 4 2– (рН = 10,5)
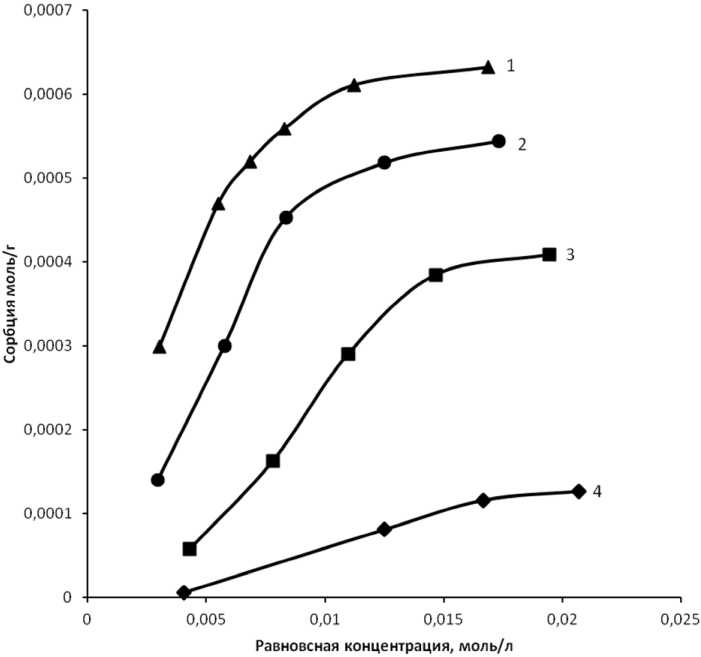
Рис. 6. Изотермы сорбции ванадия на угольном сорбенте при различных температурах: 1 – 296 К; 2 – 303 К; 3 – 318 К; 4 – 328 К
Таблица 2
Термодинамические параметры сорбционного процесса
|
Термодинамический параметр |
Угольный сорбент БАУ-М |
|||
|
Температура, К |
296 |
303 |
318 |
328 |
|
Предельная собция, ммоль/г |
0,6 |
0,5 |
0,4 |
0,1 |
|
Константа сорбции |
1,64 |
1,43 |
1,09 |
1,01 |
|
∆ G , кДж/моль |
–1,223 |
–0,895 |
–0,220 |
–0,023 |
|
∆ H , кДж/моль |
–12,6 |
|||
|
∆ S , Дж/моль ⋅ К |
–38,5 ± 0,5 |
|||
Таблица 3
Концентрации веществ в растворе после сорбции на модифицированном угле
|
Элемент |
После сорбции, г/дм3 |
|
V 2 O 5 |
0,036 ± 0,002 |
|
MnO |
2,97 ± 0,05 |
|
CaO |
0,64 ± 0,06 |
|
MgO |
0,14 ± 0,01 |
|
Na 2 O |
3,60 ± 0,2 |
|
K 2 O |
0,14 ± 0,007 |
|
NiO |
1,07 ± 0,1 |
|
Fe 2 O 3 |
3,10 ± 0,2 |
|
CuO |
1,05 ± 0,1 |
Расчеты проводили в соответствии с фундаментальным уравнением термодинамики:
Δ G = Δ H – T ⋅∆ S . (4)
∆ G реакции рассчитывали по уравнению
∆ G = – RT ln K . (5)
Энтальпию ∆ H процесса определяли с помощью уравнения изобары Вант-Гоффа:
d ln K = ∆ H dT RT 2 .
Предполагая, что ∆ H в узком исследованном интервале температур не зависит от температуры, уравнение (6) можно представить в интегральном виде и определить тепловой эффект сорбции графически из уравнения прямой линии в координатах «ln K – 1/ T »:
∆H ln K = + const.
RT
Энтропию сорбционного процесса ∆ S вычисляли из уравнения (4) по ранее определенным значениям ∆ G и ∆ H .
Термодинамические параметры процесса приведены в табл. 2.
Термодинамические данные, приведенные в табл. 2, вероятнее всего соответствуют процессу физической сорбции, поскольку для нее характерны тепловые эффекты не превышающие 30 кДж/моль и соответствующие эндотермическому процессу (∆H < 0).
При сорбции ванадия из гидрометаллургических растворов Чусовского металлургического завода удалось селективно извлечь 80 % ванадия при значениях рН = 3,4–4,0 и температуре 25 °С. Данные по концентрациям металлов после сорбции ванадия приведены в табл. 3.
Из табл. 1 и 3 следует, что сорбционное извлечение ванадия является селективным процессом, которому не мешает присутствие в растворе таких катионов как K+, Na+, Ca2+, Mg2+, Ni2+, Fe3+, Cu2+. Единственным элементом, частично сорбируемым вместе с ванадием, является марганец. Это подтверждается рентгенофазовыми исследованиями конечного продукта, проведенными на дифрактометре Bruker AXS Advance, результаты которых представлены на рис. 7. Из рентгенограммы следует что содержание основной фазы V 2 O 5 в конечном продукте составляет около 95 %, а оставшееся количество приходится на фазу MnV2O6. Чистота конечного продукта вычислена по соотношению интенсивностей максимальных пиков существующих фаз.
Конечный продукт – пентоксид ванадия – был получен путем обжига насыщенного угольного сорбента при температуре 640 °С в окислительной среде.
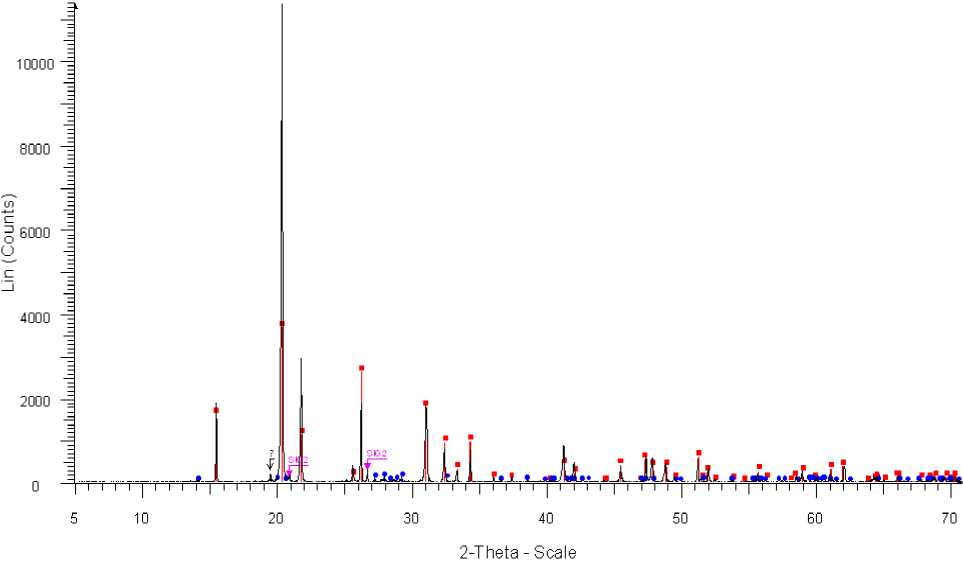
Рис. 7. Рентгенограмма пентоксида ванадия: залитые круги обозначают пики фазы MnV 2 O 6 , остальные пики относятся к V 2 O 5
Заключение
Изучены закономерности селективного сорбционного извлечения ванадия из кислых растворов металлургических производств. Высокая селективность и извлечение ванадия достигнуты на древесном активированном угле, модифицированном катионными ПАВ. Оптимальные условия для наиболее селективного и полного извлечения ванадия создаются при значениях рН среды 3–4 и концентрации ванадия, превышающей 4 ммоль/л, что соответствует образованию в растворе полисоединений H2V10O284– и HV10O285–. Сорбционное извлечение ванадия может быть удовлетворительно описано с помощью изотерм Ленгмюра, соответствующих мономолекулярной сорбции. Проведенные кинетические исследования и термодинамический анализ показали, что закрепление ванадата на поверхности адсорбентов происходит за счет физической сорбции.
Полученный полупродукт может быть использован для получения пентоксида ванадия. Чистота конечного продукта пентоксида ванадия составляла 99 %. В составе продукта не обнаружено сопутствующих соединений, калия, натрия, кальция, магния, никеля, железа и меди. В качестве примеси в конечном продукте присутствовал в небольших количествах лишь марганец, в количестве 1 %. В соответствии с существующей классификацией полученный пентоксид ванадия можно отнести к категории «продукт повышенного качества».
Список литературы Термодинамическое описание процесса сорбции ванадия на углеродсодержащем сорбенте
- Иванкин, А.А., Химия пятивалентного ванадия в водных растворах/А.А. Иванкин, А.А. Фотиева. -Свердловск: Уральский научный центр АН, 1971. -194 с.
- Рабинович, Е.М. Комплексная переработка ванадиевого сырья/Е.М. Рабинович, В.Г. Мизин. -Екатеринбург: УрО РАН, 2005. -414 с.
- Музгин, В.Н. Аналитическая химия ванадия/В.Н. Музгин, Л.Б. Хамзина. -М.: Наука, 1981. -189 с.
- A Phase Rule Study of the System: Na2O-V2O5-H2O/R.A. Robinson, G.B. Jones, A.W. Wylie, J.E. Brundell//Transactions and Proceedings of the Royal Society of New Zealand. -1938-39. -Vol. 68, P. 390-398.
- Düllberg, P. Über das Verhalten der Vanadate in wässriger Lösung/P. Düllberg//Zeitschrift für physikalische Chemie. -1903. -Bd. 45, H. 2. -S. 129-181.
- Ситтиг, М. Извлечение металлов и неорганических соединений из отходов/М. Ситтиг. -М.: Металлургия, 1985. -408 с.
- Пат. 2515154 (РФ). Способ получения пентаксида ванадия из ванадийсодержащего шлака/А.В. Свиридов, Д.П. Ординарцев, В.В. Свиридов, Ю.Л. Юрьев. -2014.
- Graphite Furnace Atomic Absorption Spectrometric Detection of Vanadium in Water and Food Samples After Solid Phase Extraction on Multiwalled Carbon Nanotubes/S.K. Wadhwa, M. Tuzen, T.G. Kazi, M. Soylak//Talanta. -2013. -Vol. 116. -P. 205-209. DOI: DOI: 10.1016/j.talanta.2013.05.020
- Measurement and Modeling for Vanadium Extraction from the (NaVO3+ H2SO4+ H2O) System by Primary Amine N1923/F. Liu, P.G. Ning, H.B. Cao, Y. Zhang//The Journal of Chemical Thermodyna¬mics. -2015. -Vol. 80. -P. 13-21. DOI: DOI: 10.1016/j.jct.2014.08.011
- Selective Solvent Extraction of Vanadium over Iron from a Stone Coal Black Shale Acid Leach Solution by D2EHPA/TBP/X. Li, Ch. Wei, Z. Deng et al.//Hydrometallurgy. -2011. -Vol. 105. -P. 359-363. DOI: DOI: 10.1016/j.hydromet.2010.10.006
- Preparation and Characterization of Chitosan-Zirconium (IV) Composite for Adsorption of Vanadium (V)/L. Zhang, X. Liu, W. Xia, W. Zhang//International Journal of Biological Macromolecules. -2014. -Vol. 64. -P. 155-161 DOI: 10.1016/j.ijbiomac.2013.11.040
- Ordinartsev, D.P. A Procedure for Preparing Vanadium Pentoxide of Improved Quality/D.P. Ordinartsev, A.V. Sviridov, V.V. Sviridov//Russian Journal of Applied Chemistry. -2014. -Vol. 87, no. 11. -P. 1773-1776 DOI: 10.1134/S1070427214110317


