Термодинамическое описание системы Cu2O-SiO2
Автор: Трофимов Евгений Алексеевич, Михайлов Геннадий Георгиевич, Жихарев Владилен Михайлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 36 (169), 2009 года.
Бесплатный доступ
Посредством термодинамических расчётов построены несколько вариантов фазовых диаграмм системы Cu2O-SiO2, которые могут быть использованы для анализа имеющихся литературных данных. Результаты расчёта сопоставлены с экспериментальными данными.
Диаграмма состояния, оксид меди, оксид кремния, термодинамические расчёты
Короткий адрес: https://sciup.org/147156624
IDR: 147156624 | УДК: 669.33+541.123
Текст научной статьи Термодинамическое описание системы Cu2O-SiO2
Система Cu2O-SiO2 является основой медерафинировочных шлаков. Несмотря на то, что попытки термодинамического описания этой системы предпринимались неоднократно, удовлетворительной модели фазовых равновесий, реализующихся в системе Cu2O-SiO2, описывающей состояние системы в широком интервале температур и концентраций, до сих пор не создано.
Настоящая работа посвящена изучению возможностей термодинамического описания системы Cu2O-SiO2 при температурах выше 1000 °C посредством различных модельных теорий строения шлаковых расплавов. В ходе работы предпринята попытка расчёта диаграммы состояния бинарной системы Cu2O-SiO2, опираясь на различные модельные представления. Для расчёта диаграмм использовались значения термодинамических функций плавления индивидуальных веществ (табл. 1), заимствованные из справочника [1]. Для подбора модельных параметров и оценки достоверности результатов расчёта в работе использованы данные справочника [2].
Таблица 1
Термодинамические характеристики плавления оксидов
|
Вещество |
Энтальпия плавления, АЯПЛ, Дж/моль |
Температура плавления, Т, °C |
|
Си2О, куприт |
64300 |
1242 |
|
SiO2, тридимит |
9002 |
1680 |
|
SiO2, кристобалит |
7704 |
1720 |
В ходе работы изучены возможности использования некоторых наиболее распространённых подходов. Результаты расчётов представлены на рис. 1 и 2.
В ходе расчёта по теории совершенных ионных расплавов считалось, что расплав состоит из ионов: положительных - Си+ и отрицательных -О2- и SiO44-. Интересно отметить, что расчет, проведённый исходя из предположения, что расплав состоит из ионов Cu+, Si4+ и О2", приводит к следующим координатам точки эвтектики: Т= 793 °C, 65,9 мол. % SiO2.
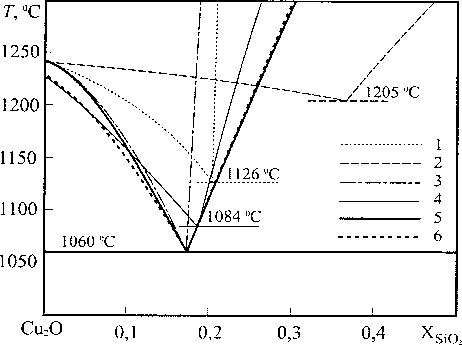
Рис. 1. Окрестности точки эвтектики на диаграмме состояния системы Cu2O-SiO2: 1 - результаты расчёта по теории совершенных ионных расплавов; 2 -результаты расчёта по теории фаз с коллективной системой электронов; 3 - результаты расчёта по теории субрегулярных ионных расплавов; 4 - расчёт посредством уравнений Маргулиса, проведённый авторами работы [6]; 5 ~ расчёт посредством уравнений Маргулиса, проведённый авторами настоящей работы; 6 - данные экспериментального исследования, приведённые в справочнике [2]
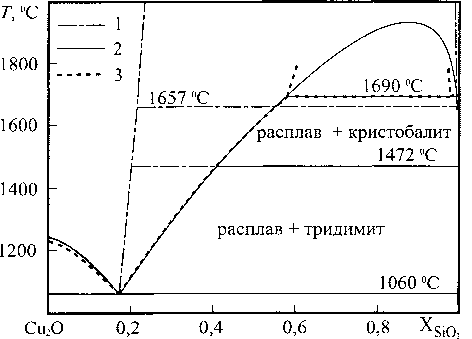
Рис. 2. Диаграмма состояния системы Cu2O-SiO2: 1 - результаты расчёта по теории субрегулярных ионных расплавов; 2 - расчёт посредством уравнений Маргулиса, проведённый авторами настоящей работы; 3 - данные экспериментального исследования, приведённые в справочнике [2]
При использовании приближения теории фаз с коллективной системой электронов (АТ. Пономаренко), активности оксидов меди и кремния в расплаве рассчитывались по формулам:
_ 2 _ 2
^Си2О - aCu * аО ’ aSiO2 ~ ^Si ' аО ’ где дСи, asi, ао - атомные активности соответствующих элементов в шлаке, которые рассчитываются по теории АТ. Пономаренко следующим образом:
«i = Q т,,
( к
= ycj6 ” , )
Sy =0,5(х^-Х^)2, где Cj, Cj - атомные доли элементов в шлаке, R - универсальная газовая постоянная (R = 0,00831 кДж/моль), Т - температура (К), Хь Щ - энергетические параметры элементов, из которых образуется расплав. В табл. 2 представлены значения параметров, рекомендованные автором теории в работе [3] и использованные в ходе нашего расчёта. Некоторое изменение значений параметров помогает добиться большего совпадения результатов расчёта с экспериментальными данными, однако, в любом случае применение этого подхода не позволяет рассчитывать координаты купола расслаивания, наличие которого характерно для изучаемой системы.
Таблица 2 Параметры теории строения фаз с коллективной системой электронов
|
Элемент i |
Си |
О |
Si |
|
Xi по [3], кДж/моль |
418 |
1255 |
172 |
В соответствии с использованным приближением теории субрегулярных ионных расплавов активности компонентов оксидного расплава можно вычислить по формулам следующего вида [4]:
lg ах = vx Igxj -bviPxf х| Qxxn +
+ ххх| (2 - 3x02im + XI (1 - 3x0 g1222]/2,3^T, lg «2 = V2 lgX2 +У2 [*1 (1 - 3x2)21112 +
+ x j x2(2 — 3x0g! 122 + 3xj x 2 21222]/2,ЗЛТ, где к - число катионов, которые образуются при диссоциации молекулы компонента шлака, число катионов в молекуле компонента шлака (для Си2О v = 2, для SiO2 v = 1), X! и х2 - катионные доли ионов Си+ и Si4+, a Q - энергетические параметры теории.
Определённый в ходе работы набор значений параметров: QXXn = -38 100 Дж/моль, 21122 = = 318 000 Дж/моль, 2i222= 59 3 00 Дж/моль.
Согласно подходу, связанному с использованием модифицированных уравнений Маргулиса третьего порядка [5], коэффициенты активности компонентов рассчитываются по формулам следующего вида:
In Y, = 0,5^^ + w^Xj-Q^^jpXjXp + >1 . j=lp=l
/=1 Hp=^
где yz - коэффициент активности /-го компонента, х - мольные доли компонентов в растворе, Wy - параметры взаимодействия, зависящие от температуры:
wy =cuiT + dll.
Отметим, что в работе [6] сделана попытка использования уравнений Маргулиса для расчёта диаграммы состояния системы Cu2O-SiO2. Однако значения, представленные в табл. 3, по нашему мнению, позволяют лучше описывать экспериментальные данные, приведённые в справочнике [2].
Таблица 3
Параметры взаимодействия для расчёта по уравнениям Маргулиса
|
н |
С |
d |
|
Си2О—SiO2 |
55 672 |
-27,06 |
|
SiO2-Cu2O |
25 445 |
-23,52 |
Работа проведена по научной программе Федерального агентства по образованию - «Развитие научного потенциала высшей школы (2009-2010 годы)», код проекта - 375 и при поддержке РФФИ, грант № 07-08-00365.
Список литературы Термодинамическое описание системы Cu2O-SiO2
- Физико-химические свойства окислов: справ./Г.В. Самсонов, А.Л. Борисова, Т.Г. Жидкова и др. М.: Металлургия, 1978. 472 с.
- Диаграммы состояния силикатных систем: справ. Вып. 1: Двойные системы/H.A. Торопов, В.П. Барзаковский, В.В. Лапин, H.H. Курцева. Л.: Наука. Ленингр. отд., 1969. 822 с.
- Пономаренко A.Г. Вопросы термодинамики фаз переменного состава, имеющих коллективную электронную фазу. II. Оценка энергетических параметров/A.Г. Пономаренко, Э.П. Мавренова//Журн. физ. химии. 1974. Т. 48, № 7. С. 1672-1674.
- Михайлов Г.Г. Термодинамика раскисления стали/Г.Г. Михайлов, Д.Я. Поволоцкий. М.: Металлургия, 1993. 144 с.
- Chuang Y.Y. Extantion of the associated solution model to ternary metal-sulfur melts: Cu-Ni-S/Y.Y. Chuang, Y.A. Chang//Met. Trans. 1982. V. 13B, № 9. P. 379.
- Сорокин М.Л. Термодинамика системы Cu-O-SiO2/М.Л. Сорокин, H.A. Андрюшечкин, A.Г. Николаев//Цветные металлы. 1997. № 6. С. 16-19.


