Термодинамика фазовых равновесий в системе Cu-Fe-S-O при температурах 1100-1300 °С
Автор: Трофимов Е.А., Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 (43), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156522
IDR: 147156522 | УДК: 669.33+
Текст обзорной статьи Термодинамика фазовых равновесий в системе Cu-Fe-S-O при температурах 1100-1300 °С
Среди исследований, направленных на разработку новых технологий и совершенствование существующих технологических процессов, особое, важное место занимает термодинамический анализ. Для пирометаллургических процессов, связанных с производством меди, характерны сложные равновесия с участием шлаков, штейнов, расплавленной металлической фазы и газа. Поэтому проведение термодинамического анализа системы Cu-Fe-S-O, в частности, методом построения поверхностей растворимости компонентов в металле (ПРКМ), имеет большое практическое значение.
В табл. 1 и 2 приведены данные о температурных зависимостях констант равновесия реакций и параметров взаимодействия первого порядка, необходимые для описания процессов происходящих в системе Cu-Fe-S-O. Температурные зависимости отчасти заимствованы из работ [1-4]. Значения других рассчитаны на основе данных о теплотах и температурах плавления соответствующих соединений и данных об энтальпиях их образования.
Используя методику, описанную ранее в работах [5, 6], построены изотермические разрезы ПРКМ системы Cu-Fe-S-O для температур 1100, 1200 и 1300 °C.
Таблица 1 Температурные зависимости констант равновесия реакций взаимодействия
' компонентов медного расплава
|
№ |
Процесс |
Константа равновесия, К |
Температурная зависимость, IgK |
|
1. |
(Cu2O)=2Cu+[O] |
К = 0j0] / Я(Си2О) |
— 3640/7+2,555 |
|
2. |
/Cu2O/=2Cu+[O] |
^ = cz[o] |
-6500/7+4,468 |
|
3. |
(Cu2S) = 2 Си + [S] |
К = a^ / «(cu2s) |
-2848/7+2,177 |
|
4. |
/Cu2S/ = 2 Си +[S] |
K = a[s] |
-4415/7+3,325 |
|
5. |
/CuFeO2/=Cu+[Fe]+2[O] |
K = a[O]a[Fe] |
-22562/7+10,208 |
|
6. |
/Fe3OV = 3[Fe] + 4[O] |
4 3 A - ^O]a[Fe] |
-50048/7+20,984 |
|
7. |
(РезО4)= 3[Fe] + 4[O] |
^ ^Oj^Fe] / a(Fe3O4) |
-42826 / 7+ 17,122 |
|
8. |
/FeO/ = [Fe] + [O] |
K = ^O^Fe] |
- 12389 / 7+ 5,084 |
|
9. |
(FeO) = [Fe] + [O] |
K = ^Oj^Fe]1 a(FeO) |
- 10701/7+4,060 |
|
10. |
[S] + 2 [O] = {SO2} |
= ^foj^s]z /’(so,) |
6520 / 7- 0,996 |
|
11. |
0,5 {O2} = [O] |
-3870/7+0,562 |
|
|
12. |
0,5 [S2} = [S] |
-4350/7+0,879 |
|
|
13. |
/FeS/= [Fe] + [S] |
K = ^s]-^Fe] |
-7067 / 7 + 4,792 |
|
14. |
(FeS) = [Fe] + [S] |
^ = a[S]' a[Fe] ^ a(FeS) |
-5374/7+3,637 |
Таблица 2 Температурные зависимости параметров взаимодействия
|
ej |
Температурная зависимость |
ej |
Температурная зависимость |
< |
Температурная зависимость |
|
eg |
— 6307 7 + 0,327 |
-1154 / 7 + 0,664 |
epe |
-65/7 |
|
|
eg |
-339/7 |
eg |
-678 IT |
4е |
-134/7 |
|
-5007 7 |
ege |
- 1700 IT |
-235 /7 |
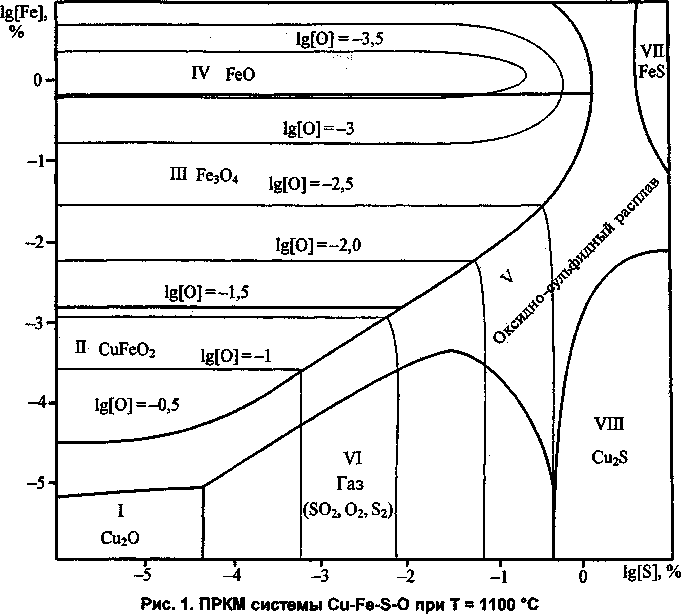
На рис. 1 изображен разрез ПРКМ системы Cu-Fe-S-O для температуры 1100 °C. Контрастными линиями показаны границы равновесных с жидким металлом неметаллических фаз. Тонкими -линии равных концентраций кислорода в металле. На диаграмме - восемь областей равновесия жидкой меди с неметаллическими соединениями.
В области I в равновесии с металлом находится твердый куприт. В области II - твердый делафоссит (CuFeO2). В области Ш в равновесии с жидкой медью находится твердый магнетит (Ге3О4), а в области IV - твёрдый вюстит (FeO).
В области V металл находится в равновесии с неметаллическим расплавом оксидов и сульфидов
меди и железа, а в области VI, при низких концентрациях железа в металлической меди, металл находится в равновесии с газом, преобладающей составляющей которого является SO2. В области VII фазой, равновесной с жидкой медью, является твёрдый сульфид железа (FeS), а в области VIII -твёрдый сульфид меди (Cu2S).
Положение границ области VI с другими областями зависит от давления компонентов газовой фазы. Границы, представленные на рисунках, рассчитаны исходя из общего давления газа в системе, равного одной атмосфере.
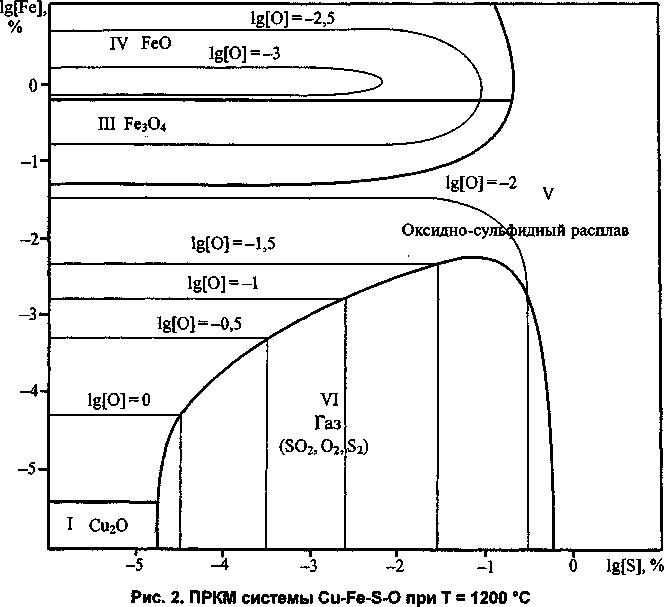
Повышение температуры сказывается на картине фазовых равновесий. На рис. 2 представлен разрез системы Си-Fe-S-O для Т= 1200 °C. Исчезли области И, VII и VIII, поскольку температура плавления веществ, соответствующих этим областям, ниже 1200 °C. Существенно расширилась область неметаллических расплавов - V. Несколько увеличилась и область VI.
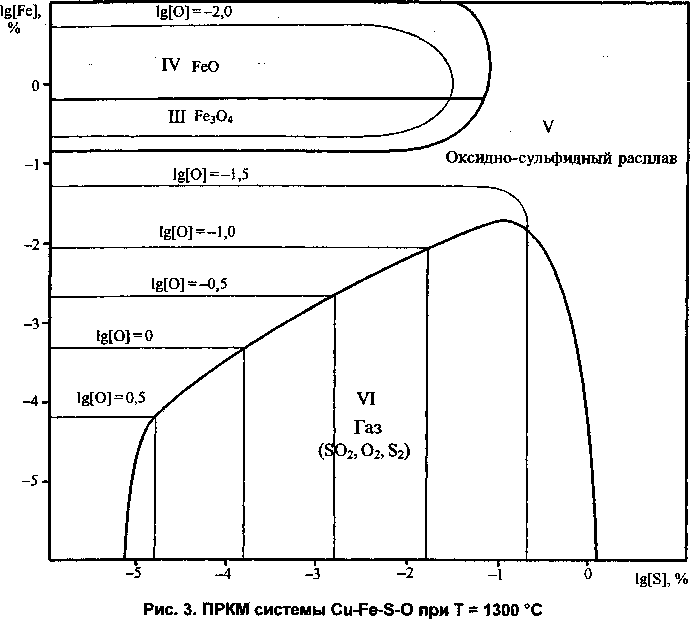
В ходе дальнейшего повышения температуры исчезает (при Т= 1240 °C) еще одна твердая оксидная фаза - куприт (Си2О). ПРКМ системы при Т= 1300 °C представлена на рис. 3. С металлом при этой, температуре могут быть сопряжены только четыре фазы: III - твердый магнетит, IV -твёрдый вюстит, V - оксидно-сульфидный расплав железа и меди и VI - газ.
Выводы
Посредством термодинамических расчётов построены поверхности растворимости компонентов в металле (ПРКМ) для системы Cu-Fe-S-O. Данные ПРКМ могут быть использованы для анализа технологических процессов, связанных с взаимодействием кислорода и серы с железом в медном расплаве.
Работа проводится по научной программе Федерального агентства по образованию - «Развитие научного потенциала высшей школы». Код проекта - 4304.
Список литературы Термодинамика фазовых равновесий в системе Cu-Fe-S-O при температурах 1100-1300 °С
- Козлов В.А., Набойченко С.С., Смирнов Б.Н. Рафинирование меди. -М.: Металлургия, 1992. -268 с.
- Куликов И.С. Раскисление металлов. -М.: Металлургия, 1975. -504 с.
- Туркдоган Е.Т. Физическая химия высокотемпературных процессов. -М.: Металлургия, 1985. -344 с.
- Линчевский Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами. -М.: Металлургия, 1986. -222 с.
- Трофимов Е.А., Михайлов Г.Г. Физико-химический анализ процессов взаимодействия элементов растворённых в жидкой меди с кислородом//Известия вузов. Цветная металлургия. -2003. -№ 3. -С. 9-12.
- Трофимов Е.А., Михайлов Г.Г. Термодинамический анализ системы Cu-S-O при температурах 1100..1300°С//Совершенствование наукоёмких технологий и конструкций: Сб. науч. тр. -Челябинск: Изд-во ЮУрГУ, 2001. -С. 137-140.
- Трофимов Е.А., Михайлов Г.Г. Термодинамический анализ системы Cu-Fe-O при температурах 1100-1300°С//Известия Челябинского научн. центра РАН. -2002. -№ 1. -С. 7 -12
- .urc.ac.ru' target='_new' rel='nofollow'>http://www.sci>.urc.ac.ru http://ac.ru>.