Термодинамика химической и электрохимической устойчивости силицидов кобальта
Автор: Тюрин Александр Георгиевич, Мосунова Татьяна Владимировна, Николайчук Павел Анатольевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 11 (187), 2010 года.
Бесплатный доступ
Построены диаграммы потенциал - рН систем Со-Н2О и Со-Si-H2O, a также фазовая диаграмма системы Со-Si-О при 25 °С. Анализируются термодинамические особенности коррозионно-электрохимического поведения сплавов системы Co-Si различного состава.
Силициды кобальта, низкотемпературное окисление, химическая устойчивость, коррозионно-электрохимическое поведение, диаграммы потенциал -рн, электрохимическая устойчивость
Короткий адрес: https://sciup.org/147160158
IDR: 147160158 | УДК: 541.1:620.193.01:669.14
Текст научной статьи Термодинамика химической и электрохимической устойчивости силицидов кобальта
Кобальт и кремний являются основными компонентами аморфных сплавов на основе кобальта. Состав некоторых из них представлен в табл. 1.
. Таблица 1
Состав аморфных и кристаллических сплавов на основе кобальта [1]
|
Сплав |
Индекс сплава |
Содержание компонентов, мае. % |
|||||
|
Со |
Ni |
Fe |
Si |
В |
Мп |
||
|
Virovac 6 010 |
Ai, Ci |
58 |
10 |
5 |
11 |
16 |
— |
|
Metglas 2 714А |
A2, C2 |
66 |
1 |
4 |
15 |
14 |
— |
|
Metglas 2 705Mn |
A3, Сз |
76 |
— |
2 |
6 |
18 |
4 |
* А - аморфные, С - кристаллические (отжиг в вакуумной печи при температуре 580 °C в течение 10 мин).
Аморфные металлические сплавы обладают комплексом необычных физико-химических свойств и являются перспективными материалами, представляющими теоретический и практический интерес. Следствием их аморфной структуры являются необычные магнитные, механические, электрические свойства и, в особенности, высокая коррозионная стойкость сплавов [2, 3]. Именно поэтому проводились и проводятся исследования коррозионного поведения системы кобальт-кремний как в воздушных, так и в водных средах. Результаты экспериментальных исследований состава и структуры пассивационных плёнок на сплавах приведены в работе [1]. Также широко исследуется [4-8] и электрохимическое поведение силицидов кобальта: Co2Si [4, 8], CoSi [5, 6, 8], CoSi2 [7, 8] и эвтектического сплава CoSi2-Si [7, 8] как в кислых [4-7], так и в щелочных [8] электролитах. В работе выполнен термодинамический анализ химической и электрохимической устойчивости сплавов системы кобальт-кремний при 25 °C.
Из анализа фазовой диаграммы состояния системы Co-Si [9] следует, что при этой температуре в системе существуют следующие промежуточные соединения: Co2Si, CoSi, CoSi2. Предельная растворимость Si в е-Со (с решёткой г. п. у.) лишь оценена и составляет чуть более 10 ат. %. Растворимость Со в Si если и существует, то ничтожно мала.
Избыточную энергию Гиббса СЕ твёрдых растворов кремния в кобальте (s-фаза) описывали в рамках двухпараметрического приближения обобщённой теории «регулярных» растворов [10]. Температурные зависимости энергетических параметров системы по данным [11] следующие:
Q® (Т) =-210 455 +32,01-Т, Дж/моль, Q<|)(T) = -141 419+ 32,01-Т, Дж/моль.
В литературе [11, 12] имеются различные данные о значениях энергии Гиббса образования интерметаллида C02SL Однако рассчитанные на их основании значения предельной растворимости кремния в кобальте, отвечающие равновесию 2Со(е) + Si(s) = Co2Si(T), хорошо согласуются между собой и с оценочными экспериментальными данными [9].
Химическая устойчивость
В соответствии с видом диаграмм состояния систем Со-0 и Si-O [13] при 25 °C на воздухе на чистых кобальте и кремнии возможны следующие фазовые равновесия: Со | "СоО" | "Со3О4" | {О2} и Si | SiO2 | {О2}. Оксиды кобальта имеют весьма широкую область нестехиометрии. Так состав фазы "СоО" может изменяться в пределах от СоО до СоО107, а фазы "СозОд” - от CoOij3095 до СоО1з409б [13]. Оксид Со2О3 может существовать только в форме гидрата Со2О3Н2О. Кроме того, в системе Co-Si-O возможно образование соединения CO2S1O4.
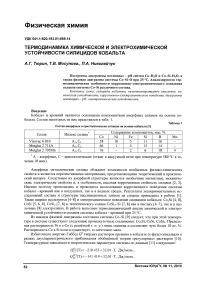
Диаграмма состояния системы Со-Si-O при 25 °C и 1 атм (воздух) представлена на рис. 1.
Стандартные энергии Гиббса образования оксидов взяты из справочников [12, 14] или рассчитаны с использованием интерполяционной формулы Лагранжа [10] и представлены в табл. 2. Рассчитанные характеристики трёхфазных равновесий представлены в табл. 3.
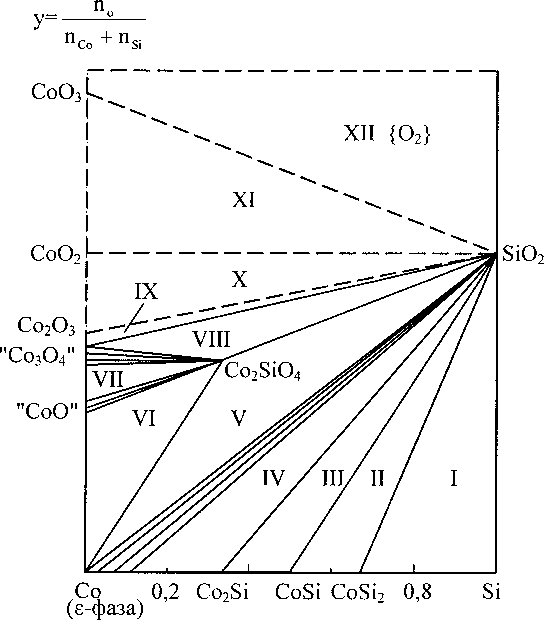
Рис. 1. Фазовая диаграмма состояния Со-Si-O при 25 °C
Стандартные энергии Гиббса образования соединений из элементов
Таблица 2
|
Оксидная фаза |
Формула оксида |
-AG0 Дж ^298’г_ат Со |
Ссылка |
Соединение |
-A G° Дж Af ^298 > моль |
Ссылка |
|
"СоО" |
СоО |
205 126 |
[12] |
СоО2 |
233 396 |
* |
|
СоО1 07 |
212 862 |
* |
СоО3 |
84 810 |
* |
|
|
"СО3О4" |
СОО13095 |
232 774 |
* |
CoSi2 |
102 260 |
[12] |
|
СоО) 3333 |
234 200 |
[12] |
CoSi |
98 817 |
[12] |
|
|
CoOi ,4096 |
23 8 090 |
* |
Co2Si |
104 856 |
[12] |
|
|
Со2О3 |
СоО1 5 |
241 368 |
* |
Co2SiO4 |
1 233 924 |
[12] |
|
SiO2 |
805 067 |
[14] |
||||
Оценка авторов по интерполяционной формуле Лагранжа.
Физическая химия
Таблица 3
Характеристики инвариантных состояний системы Co-Si-0 при 25 °C
|
Равновесие |
P02, атм |
Составы твёрдых фаз |
|
Si—CoSi2 — SiO2 (I) |
7,9-10"142 |
Si 9 CoSi2 9 S1O2 |
|
CoSi2-CoSi-SiO2 (II) |
3,2-10"141 |
xr.. = l;xr.. = l:xq;n =1 CoSi2 9 CoSi 9 SiO2 |
|
CoSi-Co2Si-SiO2 (III) |
2,8-1 O’125 |
xr.- =l;xrnS. =l;xq;n =1 |
|
s-фаза (Co)-Co2Si - SiO2 (IV) |
1Д-10422 |
xsi(e>= 0Д07, xCo2Si = 1 ;xsi02 = 1 |
|
s-фаза (Co)-Co2SiO4-SiO2 (V) |
1,5-IO"75 |
хэд = 4 • 10 , хСО2§Ю4 = l,xSi02 = 1 |
|
s-фаза (Co)-"CoO"-Co2SiO4 (VI) |
l,2-10”72 |
XSi(e) —810 , X„CoO„ = l?XCo2SiO4= |
|
"CoO"-"Co3O4"-Co2SiO4 (VII) |
7,1-IO"30 |
X"CoOn ~ ^9X"Co3O4" — ^9XCo2SiO4— 1 |
|
"Co3O4"-Co2SiO4-SiO2 (VIII) |
5,6-10”21 |
X"Co3O4" = ^XCo2SiO4=^9XSiO2= 1 |
|
"Co3O4"-Co2O3-SiO2 (IX) |
0,79 |
X"Co3O4" ” ^XCo2O3=^9XSiO2 |
|
Co2O3 - CoO2 - SiO2 (X) |
6,0-1016 |
хГпП =1;хГпП =l;xqin =1 |
|
CoO2-CoO3-SiO2 (XI) |
3,5-1063 |
хГпП =1;хГпП = 1:х„;п =1 Cov2 9 CoO3 9 SiO2 |
Из результатов расчёта следует, что химическое сродство кремния к кислороду намного выше, чем у кобальта. При содержании Si в е-Со большем, чем 10“37 мол. % единственным продуктом окисления сплава является кремнезём. Установлено, что с ростом температуры эта пороговая концентрация кремния в сплаве возрастает. Так, при 400 °C она составляет 10~15 мол. %. Экспериментально изученные состав и структура оксидных слоёв на сплавах, образовавшихся на воздухе при 400 °C в течение 400 часов, представлена в табл. 4.
Таблица 4
Состав и структура оксидных слоёв на сплавах, образовавшихся на воздухе при температуре 400 °C в течение 400 часов [1]
|
Индекс сплава* |
Оксидный слой |
Структурные составляющие окалины |
|
A] |
Тонкий |
Со28Юф; Со3Оф; СоО |
|
Толстый |
Со3О4; Fe3O4; Co2SiO4; СоО |
|
|
Ci |
Тонкий |
SiO2 (аморф); Со3О4 |
|
Толстый |
СО3О4; Со28Юф; СоО |
|
|
a2 |
Тонкий |
SiO2 (аморф); Со3О4 |
|
Толстый |
Со3О4; Co2SiO4; СоО |
|
|
C2 |
Тонкий |
Co2SiO4; СозОф^ [3-SiO2 |
|
Толстый |
СозОф^ Со281Оф^ СоО |
|
|
A3 |
Тонкий |
Co2SiOфj CoзOфj P-SiO2 |
|
Толстый |
CoзOфj Со281Оф^ СоО |
|
|
C3 |
Тонкий |
CoзOфj Со281Оф |
|
Толстый |
СозОф; Со28Юф; СоО |
* См. табл. 1.
Таким образом, при низких температурах (25 °C) химическая устойчивость сплавов системы кобальт-кремний определяется содержанием в них кремния. При средних (400 °C) и высоких температурах оксидная плёнка на сплавах многослойная и содержит оксиды кобальта и примесных элементов.
Электрохимическая устойчивость
Диаграммы потенциал - pH систем Со-Н2О и Co-Si-H2O при 25 °C и 1 атм (воздух) приведены на рис. 2 и 3. Для системы Со-Н2О она построена при активностях ионов в растворе, рав- ных 10°, 1(Г2? КГ4, КГ6 моль/л. Соответствующие линии обозначены числами 0, -2, -4, -6. Для системы Co-Si-H2O диаграмма построена при активностях ионов, равных ИГ3 моль/л. Результаты расчётов химических и электрохимических равновесий в системах приведены в табл. 5 и 6.
Таблица 5
Основные химические и электрохимические равновесия в системе Со-Н2О при 25 °C
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или pH раствора |
|
|
а |
2Н+ + 2е~ = Н2;РНз ^ 5 ■ 10~7 атм |
0,186-0,0591рН |
|
|
ь |
О2 + 4Н+ + 4е" = 2Н2О;РОз * 0,21 атм |
1,219 -0,0591рН |
|
|
1 |
НСоО2 + ЗН+ + 2е" = Со(е) + 2Н2О |
0,659-0,08865рН +0,02951g а |
|
|
2 |
СоО + 2Н+ + 2е" = Со(е) + Н2О |
0,166-0,0591рН |
|
|
3 |
Со2++ 2е~ = Со(е) |
-0,277-0,02951g аСо2+ |
|
|
4 |
СоОх + 2хН+ + 2(х -1 )е" = Со2+ + хН2О |
||
|
"СоО" |
х = 1,00 |
lgaCo2+ = 14,98-2рН |
|
|
1,00>х>1,07 |
(0,277 - 0,292х+ 0,458х2- -0,0591 хpH - 0,05911g «Со2+ )/(х -1) |
||
|
41 |
"Со3О4" |
1,3095 >х> 1,4096 |
|
|
5 |
СоОх + (2 - х)Н2О + 2(х - 1)е" = = НСоО2 + (3 - 2х)Н+ |
||
|
"СоО" |
х = 1,00 |
^^нсоо- --16,67 +pH ОС/2 |
|
|
1,00>х>1,07 |
(- 0,659 - 0,292х + 0,458х2 - -0,0295(3 - 2х)рН - 0,0295 lg«Co2+ У(х -1) |
||
|
51 |
"Со3О4" |
1,3095>х> 1,4096 |
|
|
6 |
ЗСоО13095 +1,437Н+ +1,437е" = = ЗСоО107+0,7185Н2О |
0,798-0,0591рН |
|
|
7 |
Со2О3 + 0,3616Н+ + 0,361 бе" = = 2СоО14096 +0,1808Н2О |
1,041 -0,0591рН |
|
|
8 |
Со2О3 + Н2О + 2е" = 2НСоО~ |
-0,135-0,05911ga НСОС>2 |
|
|
9 |
2СоО4" +10Н++6е =Со2О3+5Н2О |
1,770 - 0,0985рН + 0,01971g аСо()2_ |
|
|
10 |
2СоО2 + 2Н+ + 2е" = Со2О3 + Н2О |
1,312-0,0591рН |
|
|
И |
Со2О3 +6Н+ +2е" = 2Со2+ + ЗН2О |
1,739 - 0,1773рН - 0,05911g аСо2+ |
|
|
12 |
СоО2 + 4Н+ + 2е" = Со2+ + 2Н2О |
1,526 - 0,1182рН - 0,02951g аСо2+ |
|
|
13 |
СоО2" + 4Н+ + 2е" = СоО2 + 2Н2О |
1,999 - 0,1182рН + 0,02951g «Соо2. |
|
|
14 |
Со3++е" = Со2+ |
1,754 + 0,05911g Со |
|
|
15 |
СоО2 + 4Н+ + е" = Со3+ + 2Н2О |
1,297 - 0,2364рН - 0,05911g аСо3+ |
|
|
16 |
СоО2" + 8Н+ + Зе" = Со3+ + 4Н2О |
«ГпП2- 1,764 - 0,1577рН + 0,01971g 4 Со |
|
Физическая химия
Таблица 6
Основные химические и электрохимические равновесия в системе Co-Si-H2O при 25 °C, 1 атм (воздух) и ^ = 10-3 моль/л
|
№ линии |
. Электродная реакция |
Равновесный потенциал (В) или pH раствора |
|
а |
2Н+ + 2е~ = Н2;РН2 = 5 ■ 10~7 атм |
0,186-0,0591рН |
|
ь |
О2 + 4Н+ + 4е" = 2Н2О;РОз « 0,21 атм |
1,219 -0,0591рН |
|
1 |
SiO2+4H++4e" = Si + 2H2O |
- 0,857 -0,0591рН |
|
2 |
SiO2" + 4Н+ + бе" = Si + ЗН2О |
-0,499-0,0887рН |
|
3 |
SiO2+H2O = SiO3 +2Н+ |
pH 12,44 |
|
4 |
SiO2 + CoSi + 4Н+ + 4е" = CoSi2 + 2Н2О |
- 0,848-0,0591рН |
|
5 |
SiO2" + CoSi + 6Н+ + 4е" = CoSi2 + ЗН2О |
- 0,480-0,0887рН |
|
6 |
SiO2 + Co2Si + 4Н+ + 4е" = 2CoSi + 2Н2О |
-0,617-0,0591рН |
|
7 |
SiO2" + Co2Si + 6Н+ + 4е = 2CoSi + ЗН2О |
- 0,249-0,0887рН |
|
8 |
S1O2 + 2Со(е) + 4Н+ + 4е = Co2Si + 2H2Oj ^со(е) ~ ^’ 27 |
-0,602- 0,0591рН |
|
9 |
SiO2- + 2Со(е) + 6Н+ + 4е~ = Co2Si + ЗН2О; ^Со(с) ”0,27 |
- 0,237-0,0887рН |
|
10 |
Со2+ + 2е" = Co(E);aCo(6) «1 |
-0,366 |
|
11 |
Co2SiO4 + 4Н+ + 4е~ = 2Со(е) + SiO2 + 2Н2О; ^со(е) = 1 |
0,118-0,0591рН |
|
12 |
Co2SiO4+2H + 4е = 2Co(s) + SiOg + H2O^q)^q— 1 |
- 0,250-0,0295рН |
|
13 |
СоО + 2Н+ + 2е~ = Со(е) + Н2О; аСо^ ~ |
0,166-0,0591рН |
|
14 |
НСоО2 + ЗН+ + 2е“ = Со(е) + 2Н2О; аСо(Е) «1 |
0,571-0,0887рН |
|
15 |
СоОх + (2 - х)Н2О + 2(х -1 )е" = НСоО2 + (3 - 2х)Н+; 1,00 <х <1,07 ("СоО") |
(-0,571-0,292х + 0,458х2- -0,0295(3-2х)рН)/(х-1) |
|
16 161 |
СоОх + 2хН+ + 2(х -1)е" = Со2+ + хН2О; 1,00<х<1,07("СоО") 1,3095 < х < 1,4096("Со3О4") |
(0,454-0,292х + 0,458х2- -0,0591хрН)/(х-1) |
|
17 |
Co2SiO4 + 4Н+ = SiO2 + 2Со2+ + 2Н2О |
pH 8,18 |
|
18 |
ЗСоО, 3095 + 1,437Н+ + 1,437е” = ЗСоО, 07 + 0,7185Н2О |
0,798-0,0591рН |
|
19 |
2CoO]367 + SiO2 +1,468Н+ +1,468е" = Co2SiO4 +0,734Н2О |
0,972-0,0591 pH |
|
20 |
2СоОх +SiO32 +2(2х-1)Н+ +4(х-1)е’ = = Co2SiO4 + (2х -1 )Н2О; 1,3095 < х < 1,367 |
(2,158- 0,0295(2х-1 )рН)/(х -1) |
|
21 |
Со2О3 +0,3616Н+ +0,3616е~ =2СоО14096 +0,1808Н20 |
1,041-0,0591 pH |
|
22 |
2СоО4" + 10Н+ + бе’ = Со2О3 + 5Н2О |
1,711-0,0985рН |
|
23 |
Со2О3 + 6Н+ + 2е" = 2Со2+ + ЗН2О |
1,916-0,1773рН |
|
24 |
2СоО2 + 2Н+ + 2е" = Со2О3 + Н2О |
1,312-0,0591рН |
|
25 |
СоО2 + 4Н+ + 2е" = Со2+ + 2Н2О |
1,615-0,1182рН |
|
26 |
СоО2" + 4Н+ + 2е" = СоО2 + 2Н2О |
1,911-0,1182рН |
|
27 |
Со3+ + е” = Со2+ |
1,754 |
|
28 |
СоО2 + 4Н+ + е" = Со3+ + 2Н2О |
1,474-0,2364рН |
На диаграмме потенциал - pH системы Со-Н2О (рис. 2) можно выделить 9 областей преобладания различных фаз: I - Со (е); II - Со2+; III - "СоО"; IV -НСоО;; V - "Со3О4"; VI - Со2О3; VII - СоО2; VIII - Со3+; IX - СоО^.
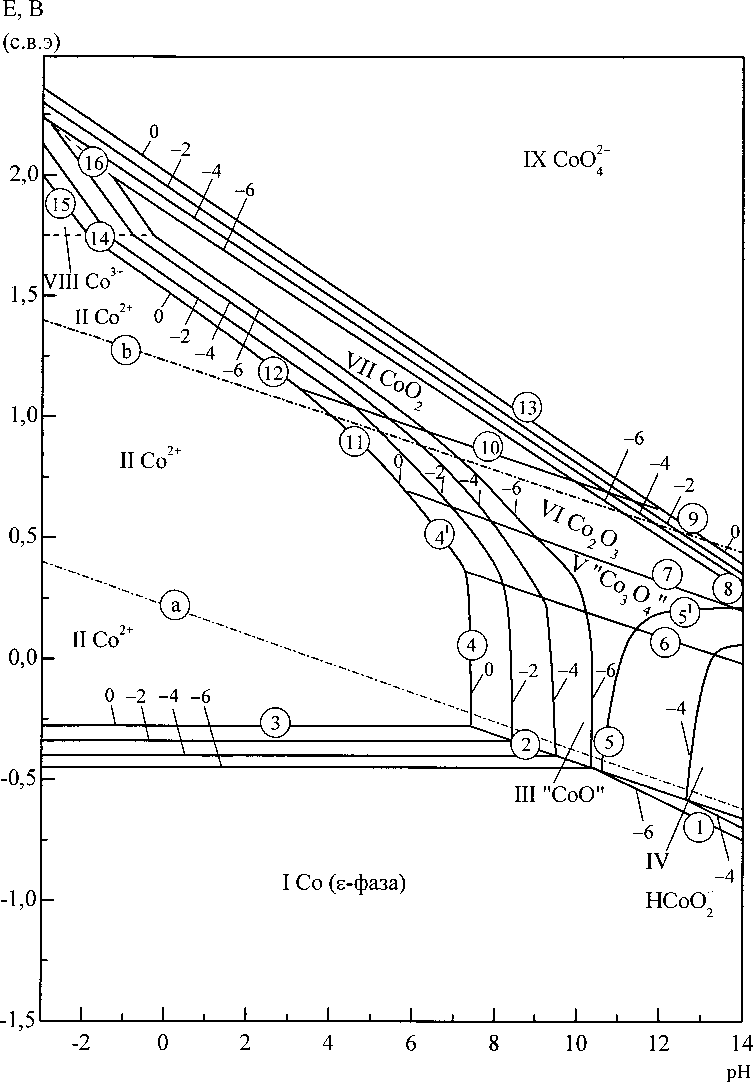
Рис. 2. Диаграмма потенциал - pH системы Со-Н2О при 25 °C, 1 атм (воздух) и ^ = 10°, 10"2,НГ4 и НГ6 моль/л (негидратированная форма оксидов)
На диаграмме потенциал - pH системы Co-Si-H2O (рис. 3) можно выделить 23 области преобладания различных фаз: I - 8-фаза (Со) + Co2Si + CoSi + CoSi2 + Si; II - 8-фаза (Co) + Co2Si + + CoSi + CoSi2 + SiO2; III - e-фаза (Co) + Co2Si + CoSi + CoSi2 + SiO^ ; IV - 8-фаза (Co) + Co2Si + + CoSi + SiO2; V - 8-фаза (Co) + Co2Si + CoSi + SiOf ~; VI - e-фаза (Co) + Co2Si + SiO^-; VII -
Физическая химия е-фаза (Со) + Co2Si + SiO2; VIII-IV - 8-фаза (Со) + SiO2; IX - е-фаза (Со) + SiO2 ; X - 8-фаза (Со) + + Co2SiO4; XI - Co2SiO4 + HCoO;; ХП - Co2SiO4 + "СоО"; XIII - Co2SiO4 + Со2+; XIV - SiO2 + Со2+; XV - Co2SiO4 + "Со3О4"; XVI - "Со3О4" + SiO2"; XVII - "Со3О4" + SiO2; XVIII - Со2О3 + SiO2"; XIX - Со2О3 + SiO2; XX - СоО2 + SiO2; XXI - SiO2 + Со3+; XXII - SiO2 + СоО2 ; XXIII - СоО2", SiO2".
Е, В (с.в.э)
-2 0 2 4 б 8 10 12 14
pH
Рис. 3. Диаграмма потенциал - pH системы Co-Si-H2O при 25 °C, 1 атм (воздух) и сц = 10"3 моль/л (негидратированная форма оксидов)
Как показывают расчёты, в кислых средах пассивационная плёнка на сплавах системы Co-Si будет представлять собой чистый S1O2, при условии отсутствия в растворе ионов F~. Если крем- ния в сплаве недостаточно для образования сплошной плёнки (его содержание не превышает 15 мае. %), то будет наблюдаться селективное растворение кобальта из сплавов с образованием в растворе ионов Со2+. Эти выводы подтверждаются и экспериментальными исследованиями [4-7].
В нейтральных и щелочных средах схема первичной пассивации сплавов системы Co-Si следующая:
I сплав + SiO2 —>
II
-
—> сплав + Co2SiO4 —>
III
-
—> сплав + СоО.
По аналогии с пассивацией силицидов железа [15] можно выделить три режима процесса. Если концентрация кремния в сплаве превышает 15 мае. %, то его достаточно для образования сплошной пассивирующей плёнки SiO2. В этом случае процесс завершается на первой стадии. При концентрации кремния в сплаве, меньшей 15 мае. %, но большей 3 мае. %, кремния в сплаве хватает лишь для образования сплошной плёнки Co2SiO4, и процесс завершается на второй стадии. Если концентрация кремния ниже 3 мае. %, то процесс завершится на третьей стадии, а защитная плёнка, как и на чистом кобальте, будет состоять из СоО, а кремний в виде локальных включений Co2SiO4 будет входить в её внутренний подслой. Зависимость структуры пассивирующей плёнки от содержания кремния в сплаве подтверждена экспериментально [8].
Таким образом, электрохимическая устойчивость сплавов системы кобальт - кремний целиком определяется содержанием в них кремния.
Заключение
-
1. Построена фазовая диаграмма состояния системы Co-Si-O при 25 °C и 1 атм (воздух). Показано, что химическая устойчивость сплавов Co-Si при низких температурах определяется только кремнием.
-
2. Построены диаграммы потенциал - pH систем Со-Н2О и Co-Si-H2O при 25 °C, 1 атм (воздух) и различных активностях ионов в растворе. Показано, что в кислых средах первичная пасси-вационная плёнка на сплавах Co-Si представляет собой чистый кремнезём. В нейтральных и щелочных средах она по мере снижения содержания кремния в сплавах может состоять из SiO2, Co2SiO4 или СоО.
Список литературы Термодинамика химической и электрохимической устойчивости силицидов кобальта
- Dark, A.M. The Oxidation Behaviour of Some Cobalt-Based Amorphous Alloys/A.M. Dark,G. Wei, B. Cantor//Mater. Sci. Eng. -1988. -P. 533-537.
- Аллотропные металлические сплавы: пер. с англ./под ред. Ф.Е. Люборского. -М.: Металлургия, 1987.-584 с.
- Глезер, A.M. Структура и механические свойства аморфных сплавов/A.M. Глезер,Б.В. Молотилов. -М.: Металлургия, 1992. -206 с.
- Шеин, А.Б. Электрохимическое поведение силицида кобальта Co2Si в кислотах/А.Б. Шеин//Защита металлов. -2000. -Т. 36, № 2. -С. 190-194.
- Шеин, А.Б. Коррозионно-электрохимическое поведение моносилицида кобальта в кислых растворах/А.Б. Шеин//Защита металлов. -1989. -Т. 25, № 1. -С. 112-114.
- Шеин, А.Б. Выделение водорода на моносилициде кобальта в сернокислом электролите, содержащем поверхностно-активные вещества/А.Б. Шеин//Электрохимия. -1988. -Т. 24. -Вып. 10.-С. 1335-1338.
- Шеин, А.Б. Электрохимическое поведение эвтектических сплавов силицидов и германидов металлов подгруппы железа с кремнием и германием/А.Б. Шеин//Защита металлов. -1998. -Т. 34, № 1.-С. 25-28.
- Шеин, А.Б. Анодное растворение силицидов кобальта в щелочном электролите/А.Б. Шеин, И.Л. Сергеева//Защита металлов. -2004. -Т. 40, № 6. -С. 624-628.
- Диаграммы состояния двойных металлических систем: справочник/под ред. Н.П. Ляки-шева. -М.: Машиностроение, 1997. -Т. 1. -С. 80-82.
- Тюрин, А.Г. Термодинамика химической и электрохимической устойчивости сплавов: учеб. пособие. Ч. 1: Общие принципы. Высокотемпературное окисление/А.Г. Тюрин. -Челябинск: Изд-во Челяб. гос. ун-та, 2004. -86 с.
- Могутнов, Б.М. Термодинамика сплавов железа/Б.М. Могутнов, И.А. Томилин, Л.А. Шварцман. -М.: Металлургия, 1984. -208 с.
- Рузинов, Л.П. Равновесные превращения металлургических реакций/Л.П. Рузинов,Б.С. Гуляницкий. -М.: Металлургия, 1975. -416 с.
- Физико-химические свойства окислов: справочник/под ред. Г.В. Самсонова -М.: Металлургия, 1978. -472 с.
- Справочник по электрохимии/под ред. A.M. Сухотина. -Л.: Химия, 1981. -488 с.
- Тюрин, А.Г. Термодинамическая оценка влияния кремния на химическую и электрохимическую устойчивость железохромистых сплавов/А.Г. Тюрин//Защита металлов. -2004. -Т.40.-№1.-С. 19-27.