Термодинамика химической и электрохимической устойчивости сплавов системы Mn-Si
Автор: Николайчук Павел Анатольевич, Шаляпина Татьяна Игоревна, Тюрин Александр Георгиевич, Мосунова Татьяна Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Проведён термодинамический анализ химических и фазовых равновесий в системе Mn-Si. Построены фазовая диаграмма Mn-Si-O и диаграмма потенциал - рН системы Mn-Si-H20 при 25 °С. С точки зрения термодинамики проанализированы процессы низкотемпературного окисления марганец-кремниевых сплавов на воздухе и в водных средах
Силициды марганца, низкотемпературное окисление, химическая устойчивость, коррозионно-электрохимическое поведение, диаграммы потенциал -рн, электрохимическая устойчивость
Короткий адрес: https://sciup.org/147160177
IDR: 147160177 | УДК: 541.1:620.193.01:669.14
Текст обзорной статьи Термодинамика химической и электрохимической устойчивости сплавов системы Mn-Si
Марганец в сплаве с кремнием используется в производстве рельсовой и конструкционной стали, им легируют сплавы на основе алюминия, магния и меди. Силикомарганец - ферросплав, основные компоненты которого железо, кремний и марганец, используется при выплавке стали как раскислитель и легирующая присадка [1].
Известно [2], что сплавы кремния с переходными металлами, в том числе и с марганцем, обладают необычным комплексом магнитных, электрических, механических свойств, а также высоким химическим сопротивлением и поэтому являются перспективными электродными материалами. Однако указанные свойства сильно различаются в зависимости от природы металлического компонента и его содержания в сплаве. Имеющиеся экспериментальные данные об электрохимическом поведении силицидов марганца [3] не охватывают весь возможный ряд силицидов и все возможные среды. Поэтому анализ коррозионно-электрохимического поведения сплавов марганца с кремнием различного состава представляет безусловный интерес. Кроме того, понимание термодинамических аспектов электрохимической устойчивости системы Мп—Si важно для дальнейшего изучения более сложных систем, например, системы Fe-Mn-Si.
Цель данного исследования - с точки зрения термодинамики рассмотреть вопрос электрохимической стойкости марганец-кремниевых сплавов в водных средах различного состава. В ходе решения этой задачи необходимо сначала разобраться с химическими и фазовыми равновесиями в системе Mn-Si и с механизмом окисления марганец-кремниевых сплавов кислородом воздуха.
Химические и фазовые равновесия в системе Mn-Si
Из анализа фазовой диаграммы состояния системы Mn-Si [4] следует, что при температуре 25 °C в системе существует семь интерметаллических фаз: МпцЗцд, MnSi, Mn5Si3, Mn5Si2, Mn3Si и две фазы переменного состава - rfMnySi?) и R(Mn6Si). Кроме того, возможно образование твёрдого раствора кремния в а-марганце с кубической решёткой (a-фаза). Область нестехиометрии r-фазы очень мала, поэтому при термодинамическом моделировании она будет считаться чистым силицидом Mn9Si2. По данным [5], R-фаза в точке, соответствующей равновесию с a-фазой, имеет состав Mno;85Sio,i5.
В литературе [5-9] имеется множество справочных данных об энергиях Гиббса образования силицидов марганца (табл. 1). Эти данные часто противоречивы, а для некоторых соединений они и вовсе отсутствуют. Поэтому появляется необходимость в проведении термодинамической оценки недостающих величин. Такая оценка была проведена с использованием формул Миедемы [8] и Истмена [10], а также с помощью метода Горичева [11]. При этом интерполяционная формула Лагранжа, используемая в этом методе, была модифицирована авторами таким образом, чтобы в качестве исходных данных в ней можно было использовать энергии Гиббса образования нескольких (а не только двух, как в оригинале) соединений. Модифицированный вариант расчётной формулы выглядит следующим образом:
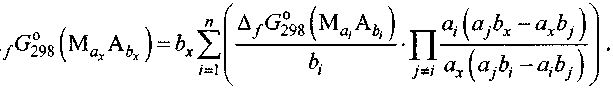
Здесь п - количество энергий Гиббса образования бинарных соединений, принимаемых в качестве достоверных исходных данных; Ма АЛ - формулы этих соединений (М - металл, А - атом более электроотрицательного элемента, а, и <5, - индексы при атомах М и А в соединении, соответственно); М^ А6 - формула соединения, энергию Гиббса образования которого нужно оценить, ах и Ьх - индексы при атомах М и А в нём.
В качестве исходных данных для расчётов по формуле (1) были выбраны энергии Гиббса образования силицидов MnnSii9, MnSi, Mn5Si3 и Mn3Si из [7], как наиболее достоверные, по мнению авторов.
Таблица 1 Стандартные энергии Гиббса образования соединений из элементов
|
Стандартные энергии Гиббса образования соединений ( AyG^g), Дж/моль |
Источник |
|||||||||||||
|
Мпц8119 |
MnSi |
Mn5Si3 |
Mn5Si2 |
Mn3Si |
Mll9Si2 |
Mno^sSio.is |
MnSiO3 |
Mn2SiO4 |
||||||
|
-954 878 |
-77 932 |
-280 518 |
— |
-104 397 |
— |
-1 240 827 |
-1 629 818 -1 671 327 |
[6] |
||||||
|
-892 500 |
-76 701 |
-278 892 |
-107 758 |
— |
— |
-1 240 552 |
-1 632 190 |
[7] |
||||||
|
— |
-59 290 |
-207 480 |
-72 260 |
— |
— |
— |
— |
[8] |
||||||
|
— |
-92 612 |
-343 444 |
-141 997 |
— |
— |
-1 347 490 |
-1 779 298 |
[9] |
||||||
|
-998 905 -965 780 -947 780 -935 780 -758 780 -344 780 -997 960 -979 960 -967 960 -790 960 -376 960 |
-78 200 -76 500 -68 100 -93 900 -74 700 -62 100 -78 280 -95 680 -69 880 -76 480 -63 880 |
-284 920 -273 120 -257 120 -23 0 720 -317 120 -243 520 -280 520 -264 520 -238 120 -324 520 -250 920 |
-103 240 -104 500 -107 300 -134 100 -144 100 -104 380 -107 180 -133 980 -143 980 |
-222 880 |
-16 850 |
[5] |
||||||||
|
-281 944 |
-48 107 |
-158 711 |
-74 502 |
-23 546 |
87 218 |
6 045 |
— |
* |
||||||
|
-892 500 |
-76 701 |
-278 892 |
-207 269 |
-107 758 |
-230 761 |
-17 823 |
— |
— |
** |
|||||
|
-892 500 |
-76 701 |
-343 444 |
-265 000 |
-133 500 |
-240 000 |
-17 850 |
-1 240 552 |
-1 632 190 |
*** |
|||||
|
Стандартные энергии Гиббса образования соединений (AyG298), Дж/моль |
Источник |
|||||||||||||
|
МпО |
Мп3О4 |
M112O3 |
MnO2 |
МП2О7 |
SiO2 |
|||||||||
|
-3 62 770 |
-1 281 955 |
-879 280 |
-465 370 |
-262 940 |
-851 279 |
[6] |
||||||||
|
-363 326 |
-1 282 885 |
-879 865 |
-466 662 |
— |
-854 243 |
[7] |
||||||||
|
— |
— |
— |
— |
— |
-805 067 |
[15] |
||||||||
|
-363 326 |
-1 282 885 |
-879 865 |
-466 662 |
-262 940 |
-805 067 |
*** |
||||||||
* - расчёт по формулам Миедемы [8] и Истмена [10];
** - расчёт по методу Горичева [11] с использованием формулы (1);
*** _ окончательно скорректированные данные, используемые для дальнейших расчётов.
Результаты расчётов с использованием обоих методов также приведены в табл. 1. При этом результаты расчётов по формулам Миедемы и Истмена следует считать недостоверными, поскольку они слишком сильно отличаются от данных других источников.
0,85 Мп (а) + 0,15 Si (а) R (Mn0 85Si0 ] 5 ), (2)
которая может быть получена путём комбинирования следующих реакций:
Физическая химия ________________________________________
0,85 Мп (а) + 0,1581(алмаз) ^> к(.Мп0 g5Si0 15), (3)
Si (алмаз) —> Si (а) . (4)
krG? реакции (3) - это, фактически, величина, равная AyG^Mn0g5Si015). По данным [5], она выражается уравнением AyG" (Мп0 85Si015 ) = -16700 - 0,5 Т, Дж/моль. Однако с учётом того, что по выполненным расчётам AyG298(Mn0g5Si015) = -17823 Дж/моль, это выражение было скорректировано:
ArG£(3) = AyG£(MnO85Sio l5) = -177OO-O,5r, Дж/моль.(5)
^rGy реакции (4) есть энергия Гиббса фазового перехода кремния из кристаллической решётки алмаза в кубическую кристаллическую решётку. В литературе не имеется данных об этой величине, поэтому был предположен линейный характер её зависимости от температуры:
Энергия Гиббса реакции (2) может быть выражена через энергии Гиббса реакций (3) и (4):
AGy (2) = \Gt (3) - 0,15AGy (4) = (-0,5 - 0,15а) Г + (-17700 - 0,156) .(7)
Если принять R-фазу как чистое вещество Mno>85Sio,i5 (ак(мп0!!я„]5) = 1 Xто’ согласно уравнению изотермы химической реакции:
МЗД = -R7’ln^(2) = -ДПп-^-Ц^ = О^ЯПла^ + 0,15R74n aSi(ct).(8)
aMn(a) °Si(a)
Активности компонентов а-фазы рассчитываются в рамках однопараметрического приближения обобщённой теории «регулярных» растворов [12]:
ТгПпампЩ) = ^1птМп(а) + xSi(a) 'йгСО-(9)
7?rinasi(ot) = R74n Хд^ +^Мп(а)012Й) • где х - мольная доля, 5а(7) - энергия смешения компонентов раствора. Авторами предположен линейный характер её зависимости от температуры:
Q^T^cT^d .
После подстановки в уравнение (8) выражений (7), (9), (10)и(11)и учёта того факта, что в твёрдом растворе xMn(a) = 1 - xS1(a), получается окончательное выражение:
0,15аГ + 0,156 + с^0,85х§^а) + 0,15^1 -xSi(a)) ^Г + <7^0,85х^и) + 0,15^1-xSi(a)j ^ +
+17 700 + 0,5Т + 0,85RT In (1 - xS1(a)) + 0,157?Пп xSi(a) = 0 .(12)
Задача сводится к определению неизвестных параметров a, b, с, d уравнения (12). Необходимые для расчёта значения мольных долей кремния в точках, отвечающих равновесию твёрдого раствора с R-фазой, сняты с диаграммы состояния системы Mn-Si [4] и представлены в табл. 2.
Таблица 2
Мольные доли кремния, отвечающие равновесию a-фазы с R-фазой при различных температурах [4]
|
Г, К |
473 |
523 |
573 |
623 |
673 |
723 |
773 |
823 |
873 |
903 |
|
-^Si(a) |
0,0485 |
0,0500 |
0,0510 |
0,0515 |
0,0530 |
0,0550 |
0,0565 |
0,0590 |
0,0610 |
0,0625 |
После подстановки данных табл. 2 в уравнение (12) получена система из 10 уравнений с 4 неизвестными (a, b, с, d). В литературе [8] имеются данные об энергиях Гиббса фазовых переходов кремния из решётки алмаза в решётки г.ц.к., о.ц.к. и г.п.у. В предположении, что при нормальной температуре энергия Гиббса фазового перехода кремния из решётки алмаза в кубическую решётку должна быть сравнимой с этими величинами и составлять приблизительно 40 КДж/моль, в систему было введено дополнительное одиннадцатое уравнение: 298a + b = 40 000, Дж/моль.
С помощью метода наименьших квадратов [13] из полученной системы составлена система нормальных уравнений, содержащая 4 уравнения с 4 неизвестными. Данная система была решена методом Крамера [14]. Получены следующие результаты (Дж/моль): a = -174,66; Ъ = 92 049; с = 211,95; d = -219292. Таким образом, проведена термодинамическая оценка температурных зависимостей энергии смешения компонентов твёрдого раствора Mn-Si и энергии Гиббса фазового перехода кремния из кристаллической решётки алмаза в кубическую решётку:
Д;/Г" (Si (алмаз) Si (а)) = 92 048-174,667, Дж/моль; (13)
g12(Mn-Si) = -219 292 + 211,957, Дж/моль. (14)
Для того, чтобы определить мольную долю кремния в твёрдом растворе, отвечающую равновесию a-фазы с R-фазой, при комнатной температуре, уравнение (12) было решено относительно ^si(a) при известных значениях параметров a, b,c, dn условии 7 = 298 К. Найденный корень уравнения х§ца) =0,0456 . Активности компонентов твёрдого раствора в этой точке рассчитаны по формулам (9) и (10): aMn(a) = 0,832l,aSi(a) = 3,835 • 102S. Таким образом, можно прийти к заключению, что в области низких температур (вплоть до комнатной) кремний практически не растворяется в марганце.
Химическая устойчивость
В соответствии с видом диаграммы состояния системы Мп-О [4] возможно существование следующих оксидов марганца: МпО, МщСД, Мп2Оз, МпО2 и Мп2О7. Кремний образует только один оксид SiO2. Также марганец и кремний могут образовывать смешанные оксиды (силикаты марганца) MnOSiO2 (Мп8Ю3)и 2МпО ■ SiO2 (Mn2SiO4) . Стандартные энергии Гиббса образования вышеперечисленных веществ, имеющиеся в различных источниках [6, 7, 9, 15], представлены в табл. 1. Для оксидов и силикатов марганца авторы считают наиболее достоверными данные из базы [7], для кремнезёма - величину из справоч ника [idj, поскольку именно это значение ^/^298 согласовано с экспериментально измеренным стандартным потенциалом кремниевого электрода (SiO2 + 4Н+ + 4е~ = Si (алмаз) + 2Н2О; Ф298 =-0,857В).
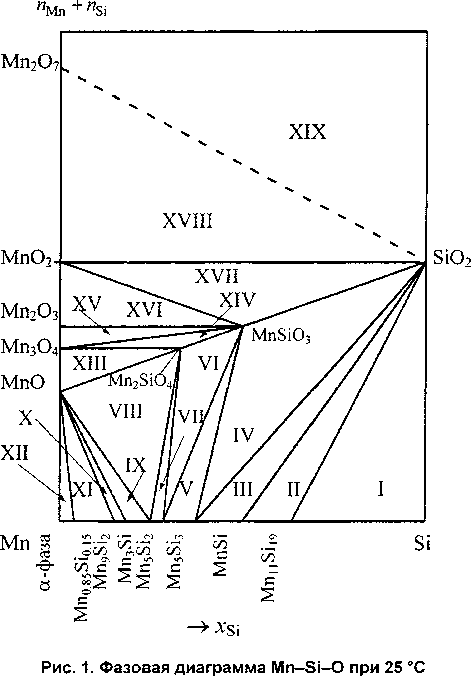
Для того чтобы построить фазовую диаграмму Mn-Si-O, необходимо разобраться с механизмом окисления марганец-кремниевых сплавов и подобрать последовательность равновесий, реализуемых в системе, таким образом, чтобы для каждой следующей реакции равновесное давление кислорода в газовой фазе было больше, чем для предыдущей. Было обнаружено, что полученные из [7] и рассчитанные термодинамические характеристики силицидов марганца не позволяют сделать это корректно. Поэтому было принято решение произвести корректировку энергий Гиббса образования некоторых соединений в пределах доверительных интервалов их возможных справочных значений. Окончательно откорректированные и использованные во всех дальнейших расчётах данные представлены в табл. 1 в строке ***. Фазовая диаграмма Mn-Si-O при 25 °C изображена на рис. 1. Рассчитанные характеристики трёхфазных равновесий системы представлены в табл. 3.
Физическая химия
Таблица 3
Характеристики трёхфазных равновесий системы Mn-Si-O при 25 °C
|
№ области |
Равновесие |
Уравнение реакции |
Po, , атм |
Равновесный состав фаз |
|
I |
81(алмаз)-Мп1i Si^-SiO2 |
81(алмаз) + O2 = SiO2 |
7,70-IO"142 |
xSi = 9 xMnHSi19= 9 xSiO2= 1 |
|
II |
MnnSii9-MnSi-SiO2 |
Мпц8119 + 8O2 = 1 IMnSi + + 8SiO2 |
9,02-IO'14' |
XMn,,Si19= 9 xMnSi = 9 XSiO2= 1 |
|
III |
MnSi-Mn5Si3-SiO2 |
5MnSi + 2O2 = Mn5Si3 + + 2SiO2 |
2,50 -IO"38 |
xMnSi = 9 xMn5Si3= 9 xSiO2= 1 |
|
IV |
Mn5Si3-MnSiO3-SiO2 |
2Mn58i3 + 4SiO2 + 11O2 = = 10MnSiO3 |
3,81 - IO136 |
xMn5Si3= 9 xMnSiO3= 9 ^Юг = 1 |
|
V |
Mn5Si3-Mn5Si2- MnSiO3 |
6Mn5Si3 + 15O2 = 4Mn58i2 + + 10MnSiO3 |
5,36-IO"134 |
xMn5Si3= 9 xMn5Si2= 9 xMnSiO3=1 |
|
VI |
Mn5 S i2-MnS iO3-Mn2SiO4 |
2Mn5Si2 + 2MnSiO3 + 9O2 = = 6Mn2SiO4 |
8,22-IO”133 |
xMn5Si2= 9 xMnSiO3= 9 xMn2SiO4=1 |
|
VII |
Mn5Si2-Mn3Si- Mn2SiO4 |
Mn5Si2 + 2O2 = Mn38i + + Mn2SiO4 |
3,01-IO"132 |
xMn5Si2= 9 xMn3Si = 9 xMn2SiO4=1 |
|
VIII |
Mn3Si-Mn2SiO4-MnO |
2Mn3Si + 5O2 = 2Mn2SiO4 + + 2MnO |
2,81-10431 |
■^Mn3Si — ■X'Mn2SiO4 ^’ хМпО ” |
|
IX |
Mn9Si2-Mn3Si-MnO |
2MngSi2 + 3O2 = 4Mn3Si + + 6MnO |
2,99-10"131 |
XMn9Si2= 9 xMn3Si = 9 xMnO = 1 |
|
X |
Mno gsSiois—MngSi2— MnO |
SOMno^sSiojs + 7O2= = 6Mn9Si2 + 4MnO |
1,70-10428 |
"^Мпд 85Si015 ^’ ^'Mn9Si2 ^MnO = 1 |
|
XI |
a-Mn085Si0i5-MnO |
2Mn(o) + O2 = 2MnO |
3,52-IO"128 |
хМп(«) =0,9544; XMn0 85Si015 =9xMnO=1 |
|
XII |
a-MnO |
|||
|
XIII |
MnO-Mn3O4- Mn2SiO4 |
6MnO + O2 = 2Mn3O4 |
2,36-10"68 |
хмпо = 9 хмп3о4= 9 xMn2SiO4= 1 |
|
XIV |
Mn3O4-Mn2SiO4- MnSiO3 |
6Mn2SiO4 + O2 = 6MnSiO3 + + 2Mn3O4 |
1,41 - IO”38 |
ХМп3О4= 9 xMnSiO3= 9 xMn2SiO4=1 |
|
XV |
Мпз O4—МП2О3— MnSiO3 |
4Mn3O4 + O2 = 6Mn2O3 |
1,32-IO26 |
хМп3О4= 9 хМп2О3= 9 xMnSiO3= 1 |
|
XVI |
Mn2O3-MnO2- MnSiO3 |
2Mn2O3 + O2 = 4MnO2 |
1,82-1 O'9 |
хМп2О3= 9 хМпО2= 9 xMnSiO3=1 |
|
XVII |
MnO2-MnSiO3-SiO2 |
2MnSiO3 + O2 = 2MnO2 + + 2SiO2 |
1,18-10"" |
хМпО, = 9 xMnSiO3= 9 xSiO2= 1 |
|
XVIII |
MnO2-Mn2O7-SiO2 |
4MnO2 + 3O2 = 2Mn2O7 |
2J8-1078 |
хМпО2= 9 хМп2О7= 9 xSiO2= 1 |
|
XIX |
МП2 O7—S i O2" {O2 } |
Электрохимическая устойчивость
Основные химические и электрохимические равновесия в системе Mn-Si-H2O при 25 °C и 1 атм (воздух) представлены в табл. 4. Для расчёта термодинамических характеристик равновесий с участием ионов в растворе использована информация о стандартных электродных потенциалах из справочника [15].
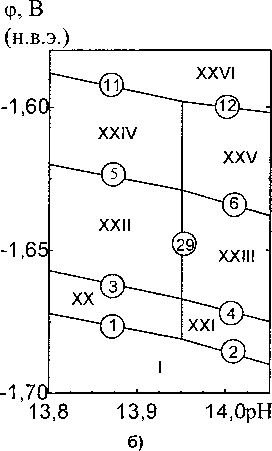
Диаграмма потенциал - pH системы Mn-Si—Н2О при 25 °C, 1 атм (воздух) и активностях ионов в растворе at = 1 моль/л изображена на рис. 2. На рис. 3 в увеличенном масштабе изображены сечения этой диаграммы в областях существования силицидов марганца.
Таблица 4
Основные химические и электрохимические равновесия в системе Mn-Si-H2O при 25 °C и 1 атм (воздух)
|
№ линии |
Электродная реакция |
Равновесный потенциал, В (н. в. э.) или pH раствора |
|
1 |
2 |
3 |
|
a |
2Н+ + 2<Г = Н2; РНг ~ 5 • ИГ7 атм |
0,186-0,0591рН |
|
b |
О2 + 4Н+ + 4е“ = 2Н2О; ^ » 0,21 атм |
1,219-0,0591рН |
|
1 |
SiO2 + 4Н+ + 4е = Si + 2Н2О |
- 0,857 — 0,0591рН |
|
2 |
SiO^" + 6Н+ + 4е~ = Si + ЗН2О |
-0,444 - 0,08865рН + 0,01481g aSjO2_ |
|
3 |
8SiO2 +1 IMnSi + 32Н+ + 32е = МП1 iSi19 + 16Н2О |
-0,841-0,0591 pH |
|
4 |
8SiO^ + HMnSi+ 48Н++32е” =Mn]]Si19 +24Н2О |
-0,429 -0,08865рН + 0,01481gas.o2„ |
|
5 |
2SiO2 + Mn5Si3 + 8H+ + 8e" = 5MnSi + 4H2O |
-0,805-0,059 IpH |
|
6 |
2SiO|~ + Mn5Si3 +12H+ + 8 |
-0,392 - 0,08865pH +0,01481g ц,.^ |
|
7 |
SiO2 + Mn5Si2 + 4H+ + 4e“ = Mn5Si3 + 2H2O |
- 0,653-0,0591pH |
|
8 |
SiO2 + 5Mn3Si + 4H+ + 4e~ = 3Mn5Si2 + 2H2O |
- 0,526-0,0591рН |
|
9 |
SiO2 + Mn9Si2 + 4H+ + 4e" = 3Mn3Si + 2H2O |
-0,441-0,0591рН |
|
10 |
7SiO2 +180Mn0g5Si0]5 + 28H+ +28e" = 17Mn9Si2 + 14H2O |
-0,426-0,0591 pH |
|
11 |
5MnSiO3 + 22H+ + 22e~ = Mn5Si3 + 2SiO2 +11H2O |
- 0,772 -0,0591рН |
|
12 |
5MnSiO3 + 18H+ + 22 |
-0,922 - 0,04835рН - 0,005371g aSi02_ |
|
13 |
5MnSiO3 + 2Mn5Si2 + 30H+ + 30e" = 3Mn5Si3 + 15H2O |
-0,741-0,0591 pH |
|
14 |
MnSiO3 + 3Mn3Si + 6H+ + 6e" =2Mn5Si2 + 3H2O |
- 0,690-0,0591рН |
|
15 |
3MnSiO3 + 2Mn9Si2 +18H+ +18e" = 7Mn3Si + 9H2O |
- 0,652 -0,0591рН |
|
16 |
MnSiO3 + 2OMno 85Si015 + 6H+ + 6e~ = 2Mn9Si2 + 3H2O |
-0,644- 0,059 IpH |
|
17 |
3Mn2SiO4 + 18H+ + 18e“ = Mn5Si2 + MnSiO3 + 9H2O |
- 0,723-0,0591рН |
|
18 |
Mn2SiO4 + Mn3Si + 8H+ + 8e~ = Mn5Si2 + 4H2O |
- 0,715 - 0,0591рН |
|
19 |
3Mn2SiO4 + Mn9Si2 + 24H+ + 24e" = 5Mn3Si +12H2O |
- 0,701-0,0591рН |
|
20 |
7Mn2SiO4 +100Mn0 85Si015 + 56H+ + 56e“ = = 1 lMn9Si2 + 28H2O |
-0,696-0,05 91 pH |
|
21 |
Mn2SiO4+MnO + 10H+ +10e" ^Mn3Si + 5H2O |
- 0,7004-0,0591рН |
|
22 |
3MnO + 2Mn3Si + 6H+ + 6e“ = Mn9Si2 + 3H2O |
- 0,7000-0,0591рН |
|
23 |
7MnO + 3Mn9Si2 +14H+ +14e^ =40Mn085Si015 + 7H2O |
-0,659- 0,0591рН |
|
24 |
MnO + 2H+ + 2^=Mn(a) + H2O; aMn(ct) =0,8321 |
-0,651-0,0591 pH |
|
25 |
Mn2+ +2e- =Mn(a); aMn(a) =0,8321 |
-l,183 + 0,029551gaMn2+ |
|
26 |
MnSiO3 + 2H+ = Mn2+ + SiO2 + H2O |
pH = 2,66 -0,51g a ?+ |
|
27 |
Mn2SiO4 + 2H+ = Mn2+ + MnSiO3 + H2O |
pH = 6,51-0,51gaMn2+ |
|
28 |
MnO + 2H+ = Mn2+ + H2O |
pH = 8,99-0,51gtJMn2+ |
|
29 |
SiO3“ + 2H+=SiO2+H2O |
pH = 13,94 + 0,5 lg«Si0|_ |
Физическая химия
Окончание табл. 4
|
1 |
2 |
3 |
|
30 |
Mn3O4 4 2H+ + 2е" = ЗМпО 4 Н2О |
0,230-0,0591рН |
|
31 |
Мп3О4 4 8Н+ 4 2е~ = ЗМп2+ 4 4Н2О |
1,825 - 0,2364рН - 0,08865 ^^2+ |
|
32 |
Мп3О4 4 3MnSiO3 4 2Н+ 4 2е” = 3Mn2SiO4 4 Н2О |
0,670 -0,0591рН |
|
33 |
ЗМп2О3 4 2Н+ 4 2е“ = 2Мп3О4 4 Н2О |
0,847-0,0591рН |
|
34 |
Мп2О3 4 6Н+ 4 2е^ = 2Мп2+ 4 ЗН2О |
1,499 - 0,1773рН - 0,05911g aMn2+ |
|
35 |
2МпО2 4 2Н+ + 2е“ = Мп2О3 + Н2О |
0,952-0,059 IpH |
|
36 |
МпО2 4 SiO2 4 2Н+ 4 2е" = MnSiO3 4 Н2О |
1,068-0,0591рН |
|
37 |
МпО2 4 SiO2^ 4 4Н+ 4 2е~ = MnSiO3 + 2Н2О |
1,892 - 0,1182рН 4 0,0295 51g ag ю2_ |
|
38 |
МпО2 4 4Н+ 4 2е" = Мп2+ + 2Н2О |
1,226 - 0,1182рН - 0,0295 51g «Мп2+ |
|
39 |
МпО2 4 4Н+ + е" = Мп3+ + 2Н2О |
0,941 - 0,2364рН - 0,029551g «Мпз+ |
|
40 |
Мп3+ 4 = Мп2+ |
1,51040,05911g-^L ЯМп2+ |
|
41 |
МпО4 4 4Н+ 4 Зе^ = МпО2 4 2Н2О |
1,695 - 0,0788рН + 0,01971g a |
|
42 |
МпО4“ 4 4Н+ 4 2е" = МпО2 4 2Н2О |
2,249 - 0,1182рН 4 0,029551g а^. |
|
43 |
МпО^4е-=МпО^ |
0,588 4 0,05911g Mn0" ^MnO^ |
На диаграмме электрохимического равновесия системы Mn-Si-H2O (рис. 2, 3) можно выделить 42 области термодинамической устойчивости различных фаз: I — а-фаза (Мп) + R-фаза (Mno^sSiojs) + г-фаза (Mn9Si2) + Mn3Si + Mn5Si2 + Mn5Si3 + MnSi + MnnSiig + Si; П - Mn'+ 4 + MnOj85Sio,i5 + Mn9Si2 + Mn3Si + Mn5Si2 + Mn5Si3 + MnSi + MnnSi19 + Si; III - Mn2+ + Mno^sSiojs + + Mn9Si2 + Mn3Si + Mn5Si2 + Mn3Si3 + MnSi + MnnSii9 + SiO2; IV - Mn2+ + Mno^sSiojs + Mn9Si2 4 + Mn3Si + Mn5Si2 + Mn5Si3 + MnSi + SiO2; V - Mn2+ + Mno^sSiojs + Mn9Si2 + Mn3Si + Mn5Si2 4 + Mn5Si3 4~ SiO2; VI — Mn 4" Mn9 ssSio 15 4- Mn9Si2 4- Mn3Si 4" Mn3Si2 4- SiO2; VII — Mn + Мпо ssSio 15 4 4- Mn9Si2 4- Mn3Si 4- SiO2; VIII - Mn2+4 Mno^sSiojs 4- Mn9Si2 4- SiO2; IX - Mn2+ 4- Mno^sSiojs 4- SiO2; X - Mn3+ 4- MnossSiois 4- SiO2; XI - Mn2+ 4- MnossSiois 4- Mn9Si2 4- Mn3Si 4- Mn5Si2 4 Mn5Si3 4 4- MnSiO3; XII - Mn2+ + Mno,ssSioj5 4- Mn9Si2 4- Mn3Si 4- Mn5Si2 4 MnSiO3; XIII - Mn2+ 4 Mno,85Sioj5 4 4 Mn9Si2 4 Mn3Si 4 MnSiO3; XIV - Mn2+ 4 Mno ssSio 15 + Mn9Si2 4 MnSiO3; XV - Mn2+ 4 Mn0 ssSio 15 + 4 MnSiO3; XVI - Mn2+ 4 Mno.ssSiojs 4- Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn2SiO4; XVII -’Mn2+ 4 4 Mno^sSiojs + Mn9Si2 4 Mn3Si + Mn2SiO4; XVIII - Mn2+ 4 Mno^sSiojs + Mn9Si2 4 Mn2SiO4; XIX -Mn2+ 4 Mno.ssSiojs + Mn2SiO4; XX - a 4 Mno^sSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn5Si3 4 MnSi 4 4 MnnSi]9 + SiO2; XXI - a 4 Mno.ssSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn5Si3 4 MnSi 4 MnnSii9 4 4 SiO2”; XXII - «4 Mno.ssSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn5Si3 4 MnSi 4 SiO2; XXIII - a 4 + Mno.ssSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn3Si3 + MnSi 4 SiO|” ; XXIV - a 4 Mno.ssSiojs + Mn9Si2 4 4 Mn3Si 4 Mn5Si2 + Mn5Si3 4 SiO2; XXV - a 4 Mno^sSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn5Si3 4 4 SiO2“; XXVI - a 4 Mno.ssSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 Mn5Si3 4 MnSiO3; XXVII - a 4 4 Mno^sSiojs + Mn9Si2 4 Mn3Si 4 Mn5Si2 4 MnSiO3; XXVIII - a 4 Mno^sSiojs + Mn9Si2 4 Mn3Si 4 4 Mn5Si2 4 Mn2SiO4; XXIX - a 4 Mn0 ssSio is + Mn9Si2 4 Mn3Si 4 Mn2SiO4; XXX - a 4 Mn0 8sSi015 + 4 Mn9Si2 4 Mn3Si 4 Mn2SiO4 4 MnO; XXXI - a 4 Mno.ssSiojs + Mn9Si2 4 Mn2SiO4 4 MnO; XXXII -a 4 Mn0 ssSio 15 + Mn2SiO4 4 MnO; XXXIII - Mn0 ssSio 15 + Mn2SiO4 4 MnO; XXXIV - Mn0 ssSi0 is + 4 Mn2SiO4 4’ Mn3O4; XXXV - Mno^sSiojs + MnSiO3 4 Mn3O4; XXXVI - Mno.ssSiojs + MnSi63 4 4 Мп2О3; XXXVII - Mno^sSiojs + MnSiO3 4 MnO2; XXXVIII - Mno.ssSiojs + MnO2 + SiO2; XXXIX -Mno^sSiojs + MnO2 4 SiC)| ; XL - Mno.ssSiojs + SiO2 4 MnO4 ; XLI - Mno.ssSiojs + MnO4”, SK)|- ; XLII - Mno.ssSiojs + MnO4, SiO2" .
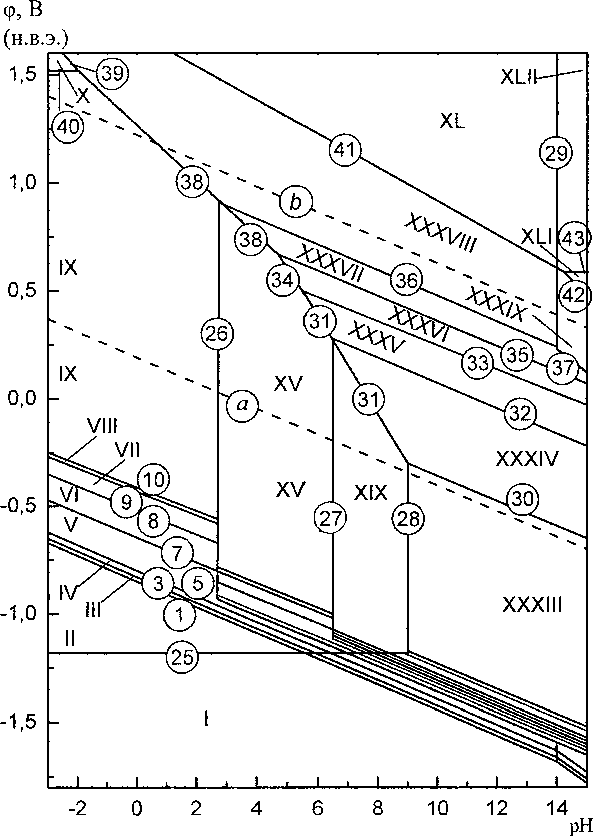
Рис. 2. Диаграмма потенциал - pH системы Mn-Si-H2O при 25 °C, 1 атм (воздух) и я,- = 1 моль/л
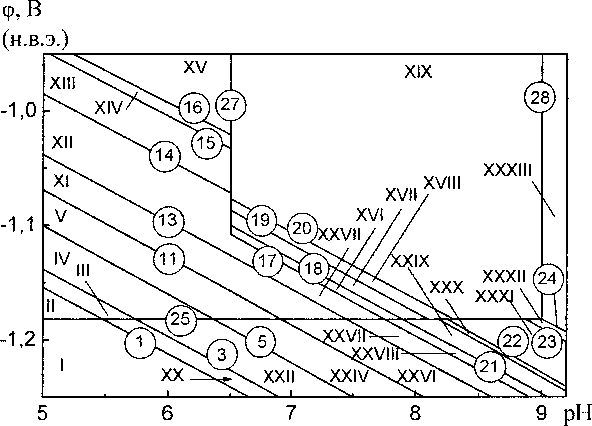
Рис. 3. Сечение диаграммы потенциал - pH системы Mn-Si-H2O при 25 °C, 1 атм (воздух) и я,- = 1 моль/л в области существования: а) силицидов марганца; б) ионов S1O3"
Физическая химия
Обсуждение результатов
Анализируя фазовую диаграмму Mn-Si-O, можно прийти к следующим выводам: окисление марганец-кремниевых сплавов начинается при давлениях кислорода в газовой фазе выше 7,70 -1О142 атм. Поскольку для окисления МпО2 до Мп2О7 необходимо давление кислорода, равное 2,18-Ю78 атм, то окисление на воздухе (Ро^ =0,21 атм) должно завершиться образованием оксидов МпО2 и SiO2. Однако, поскольку в реальных условиях термодинамическое равновесие недостижимо, оксидная плёнка на сплавах может содержать и другие оксиды, а также силикаты марганца. Её конкретный состав будет очень сильно зависеть от содержания кремния в сплаве. Так, если кремния в сплаве не более 25 ат. % (его недостаточно для образования силицида Mn3Si и силицидов с более высоким содержанием кремния), то наиболее вероятными продуктами окисления будут оксиды марганца и Mn2SiO4. При увеличении содержания кремния в сплаве возможно образование в составе оксидной плёнки MnSiO3 и SiO2.
Коррозионно-электрохимическое поведение марганец-кремниевых сплавов будет определяться кислотностью среды и установившимся в ней значением стационарного потенциала. В кислых средах будет наблюдаться селективная коррозия марганца, и переход его в раствор в виде катионов Мп2+ (области II—IX на рис. 2, 3), а кремниевая составляющая сплава будет окисляться до SiO2 (в работе [3] это подтверждено экспериментально). В нейтральных и щелочных средах, в зависимости от содержания кремния в системе и конкретных условий, окисление может заканчиваться образованием силикатов Mn2SiO4 или MnSiO3. Защитная плёнка из этих силикатов является более стойкой в химическом и электрохимическом плане, нежели SiO2, поскольку она не окисляется до SiO2-.
Наличие множества различных справочных данных и необходимость оценивания и корректировки некоторых термодинамических величин не позволяют говорить о том, что предложенная авторами работы картина окисления марганец-кремниевых сплавов является окончательной и безусловно верной. Теория не даёт однозначного ответа по поводу некоторых конкретных равновесий, особенно в областях существования низших силицидов марганца. Несмотря на это общие закономерности коррозионно-электрохимического поведения системы Mn-Si выявлены, показано, что химическая и электрохимическая устойчивость марганец-кремниевых сплавов выше, чем таковая для чистых марганца и кремния, и что конкретный состав продуктов окисления определяется содержанием обоих компонентов в сплаве.
Выводы
-
1. Рассмотрены химические и фазовые равновесия в системе Mn-Si при 25 °C. Проведено согласование и прогнозирование термодинамических свойств компонентов системы, проведена оценка предельной растворимости кремния в марганце при комнатной температуре.
-
2. Построена фазовая диаграмма Mn-Si-O при 25 °C. Рассчитаны характеристики трёхфазных равновесий системы, показано, что химическая устойчивость сплавов системы Mn-Si определяется содержанием в сплаве обоих компонентов.
-
3. Построена диаграмма потенциал-pH системы Mn-Si-H2O при 25 °C, 1 атм (воздух) и а, = 1 моль/л. Показано, что в кислых средах первичная пассивационная плёнка на сплавах Mn-Si представляет собой чистый кремнезём. В нейтральных и щелочных средах она в зависимости от содержания кремния в сплавах может состоять как из чистых оксидов марганца и кремния, так и из силикатов марганца.
Список литературы Термодинамика химической и электрохимической устойчивости сплавов системы Mn-Si
- Силикомарганец: Большая Советская энциклопедия. -http://slovari.yandex.ru/dict/bse/article/00070/96500.htm
- Гельд, П.В. Силициды переходных металлов четвёртого периода/П.В. Гельд, Ф.А. Сидоренко. -М.: Металлургия, 1971. -582 с.
- Шеин, А.Б. Электрохимическое поведение силицидов марганца в растворе серной кислоты/А.Б. Шеин, Е.Н. Зубова//Защита металлов. -2005. -Т. 41, № 3. -С. 258-266.
- Диаграммы состояния двойных металлических систем: справ./под ред. Н. П. Лякишева. -М.: Машиностроение, 2000. -Т. 3. -Кн. 1. -С. 361, 383, 698.
- Физическая химия неорганических материалов: в 3 т. Т. 1. Термодинамика интерметалли-дов и фазовые равновесия в металлических системах/В.Н. Ерёменко [и др.]. -Киев: Наукова думка, 1988.-365 с.
- Рузинов, Л.П. Равновесные превращения металлургических реакций/Л.П. Рузинов, B.C. Гу-ляницкий. -М.: Металлургия, 1975. -416 с.
- Термические константы веществ: база данных/руководители проекта B.C. Иориш, B.C. Юнгман. -http://www.chem.msu.su/cgi-bin/tkv.pl?show=welcome.html
- Термодинамика сплавов железа/Б.М. Могутнов, И.А. Томилин, Л.А. Шварцман. -М.: Металлургия, 1984. -208 с.
- Температурные зависимости приведённой энергии Гиббса некоторых неорганических веществ: альтернативный банк данных ASTRA. OWN/Г.К. Моисеев, Н.А. Ватолин, Л.А. Маршук, Н.И. Ильиных. -Екатеринбург: УрОРАН, 1997. -230 с.
- Тюрин, А.Г. Термодинамический анализ образования фаз в процессах электролитического осаждения титана из водных растворов//Электрохимия. -1990. -Вып. 26. -№ 12. -С. 1599-1605.
- Жук, Н.П. Курс теории коррозии и защиты металлов: учеб. пособие для вузов -2-е изд., стереотип, (перепеч. с изд. 1976 г.). -М: ООО ТИД «Альянс», 2006. -472 с.
- Тюрин, А.Г. Термодинамика химической и электрохимической устойчивости сплавов: учеб. пособие. Ч. 1. Общие принципы. Высокотемпературное окисление. -Челябинск: Изд-во Челяб. гос. ун-та, 2004. -86 с.
- Метод наименьших квадратов: энциклопедический проект «Наука». -http://ru.science.wikiа.соm/wiki/Метод_наименьших_квадратов
- Метод Крамера: математическая энциклопедия. -http://dic.academic.ru/dic.nsf/rawiki/149541
- Справочник по электрохимии/под ред. A.M. Сухотина. -Л.: Химия, 1981. -488 с.


