Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr-Mn-O-C
Автор: Михайлов Г.Г., Чернова Л.А.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (50), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156491
IDR: 147156491 | УДК: 669.017.3+669.26+669.29536.75
Текст обзорной статьи Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr-Mn-O-C
Ванадий - элемент, существенно улучшающий эксплуатационные и технологические свойства сталей. Он используется при производстве стали различного назначения: от низкоуглеродистых конструкционных до быстрорежущих и жаропрочных. В основной сортамент машиностроительных, строительных инструментальных, теплоустойчивых и нержавеющих сталей ванадий вводится на десятые доли процента. В настоящей работе проведен термодинамический анализа процессов образования неметаллических фаз с ванадием в процессе выплавки и легирования ванадийсодержащих сталей.
На основании изучения бинарных и тройных диаграмм состояния выполнен термодинамический анализ процессов взаимодействия кислорода, хрома, ванадия, марганца и углерода жидком железе. Установлено, что в равновесии с жидким металлом могут находиться следующие оксидные фазы: оксидный расплав, содержащий FeO, Сг2О3, V2O3, МпО, СЮ, VO (О.р.), твердые растворы оксидов |Cr2O3, V2O3| (Тв.р.ок.1) и |FeO, МпО| (Тв.р.ок.2), твердые растворы шпинелей |FeV2O4, FeCr2O4, MnV2O4, МпСг2О4| (Тв.р.шп.), а также твердые VO и Сг3О4. В присутствии углерода возможно образование газовой фазы, состоящей из СО, СО2. Химические реакции образования этих фаз и соответствующие константы равновесия имеют вид: (FeO) = [Fe] + [О], К. = [FeJajo]/a(FeO), (1) (Сг2О3) = 2[Сг] + 3[О], Х2 = Ц[-с^^о]/а(сг2Оз) > (2)
(V2o3) = 2[V] + 3[О], Х3 = af^/a^), (3)
(МпО) = [Мп] + [О], К4 = а[Мп]а[о] /а(МпО) - (4) (СЮ) = [Ст] + [О], К5 = а[сг]а[о]/а(Сго) ’ (5) (VO) = [V] + [О], x6 = a[v]a[o]/a(vo), (6)
iCr2°3L.p = 2[Cr] + 3[O], K7 = ^СД/^ , (1) |V2O3|mp = 2[V] + 3(0], K8 = ^уД/^Оз!, (8) Мтар= ^e] + [О], K9 = ^pej^oj/^FeOj > (9)
|Cr3O4| = 3[Cr] + 4[O], Ku = ^^,
|VO| =[V] + [O], X12=a[v]a[0?(12)
{CO} = [С] + [O], XI3 = ^fcj^fo] //’{co} >(15)
{CO2} = [C] + 2[O], X14 = ^o]/^}.(14)
Температурные зависимости констант равновесия приведены в табл. 1.
Активности компонентов твердого раствора оксидов |Сг2О3, V2O3| рассчитывали по теории регулярных растворов (g12 = 16740 Дж/моль). Ак тивности компонентов твердых растворов оксидов |FeO, МпО| и шпинелей приравнивали их мольным долям. Активности компонентов оксидного расплава (FeO, Сг2О3, V2O3, МпО) рассчитывали по теории субрегулярных ионных растворов. Общая формула для расчета активности компонента s в оксидном расплаве имеет вид [1]:
7?Ttoa, =vs
5-1
^Ьх5 *y^QHs +2^х^ +3х/х2йв$)+
. 1=1
т
5L Y^sXjQsssj '^'^‘^s^jQssjj ^XjQsjij)”
j=sVl m-1 m
~5E E (x, XjQUiJ + x,. Xj QH1J + x^jQ^ )+
,=i j=m
$-2 $-1
"*"E E (^ xjQiijs ^xixjQiJjs *^'XixjxsQijss) + i=l j-i+1
s-1 m
+E E (Xj x^Qjisk ■v'2.XjXsXjcQjSSjc + xixkQiskk j + i=l k=s+l m-1 m y^XxXjX^Q,^^ л-XjX^Qgjy^ ^'XjX^QSj^j^
j^s-vlk-s+2
m-2 m-1 m
—^S ^ ^ yXjXjX^Q^A-x^XjX^Qjjj^-vXjXjX^Qyj^A- /=1 _/=z+14=r+2
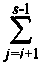
m s-1 m-1m
E X.XjXlQysl^H. E E xixkxlQisH + k=s+l /=1 ^=5+1/=Л+1
m-2 m-1m
+ E E E XjXkX^jH -
/=s+l k=j+l l=k+l
1Мп01тв.р = W + [°b ^10 = ^Mnj^Oj/^MnO] ’ 0°)
m-3 m-2 m-1 m
E E E E XkXlQijH
M j=i+l k=j+l l=k+A
Работа выполнена при финансовой поддержке РФФИ (проект № р2004урчел04-0396068).
Зависимость констант равновесия от температуры
Таблица 1
Условные обозначения:
( ) - оксидный расплав; [ ] - жидкая металлическая фаза;
| | - кристаллическое состояние; { } - газовая фаза.
|
Реакция |
lgK=-A/T+B |
|
|
A |
В |
|
|
(FeO) = [Fe] + [О] |
6320 |
4,734 |
|
(Сг2О3) = 2[Сг] + 3[О] |
33460 |
14,85 |
|
(V2O3) = 2[V] + 3[О] |
39303 |
15,90 |
|
(МпО) = [Мп] + [О] |
12175 |
5,45 |
|
(СгО) = [Сг] + [О] |
8203 |
4,51 |
|
(VO) = [V] + [O] |
11760 |
5,06 |
|
! FeO | = [Fe] +[О] |
8069 |
5,80 |
|
| МпО | = [Мп] + [О] |
15017 |
6,77 |
|
I FeVA I = [Fe] + 2[V] + 4[O] |
58522 |
26,48 |
|
I MnV2O41 = [Mn] + 2[V] + 4[O] |
66087 |
27,76 |
|
I FeCrA I = [Fe] +2[Cr] + 4[O] |
51870 |
24,48 |
|
I MnCrA I = [Mn] +2[Cr] +4[O] |
55600 |
. 24,19 |
|
|Cr2O3| =2[Cr]+3[O] |
40014 |
17,37 |
|
JvaI =2[V] + 3[O] |
45430 |
18,617 |
|
|Cr3O4| =3[Cr]+4[O] |
53352 |
23,51 |
|
IVOl =[V] + [O] |
15040 |
6,453 |
|
{CO} = [C] + [O] |
1168 |
-2,07 |
|
{CO2} = [C] + 2[O] |
9616 |
2,51 ' |
Здесь X, — ионные доли катионов компонентов шлакового расплава; Qykl - энергетические параметры теории.
Подобранные энергетические параметры теории субрегулярных ионных растворов оксидного расплава FeO- V2O3 - Cr2O3 -МпО приведены для в табл. 2.
В связи с отсутствием надежных литературных данных по диаграммам состояния с СЮ и VO их активности приравнивали ионным долям (по теории совершенных ионных растворов).
Активности компонентов металлического расплава рассчитывали по теории Вагнера с использованием параметров взаимодействия, численные значения которых приведены в табл. 3.
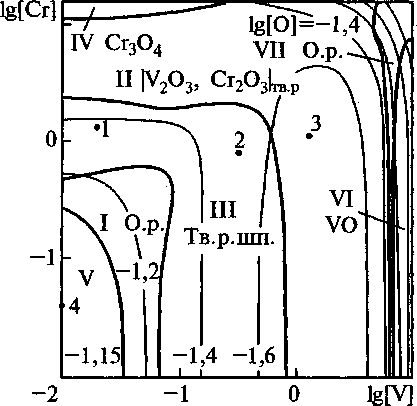
Построены поверхности растворимости компонентов в жидком металле (ПРКМ) системы Fe-V-Cr-Mn-O. Изучено влияние температуры, содержания углерода и марганца на строение ПРКМ. На рис. 1-3 приведены изотермические изосостав-ные сечения ПРКМ системы Fe-V-Cr-Mn-O-C. В областях I и VII заданы составы жидкого металла, равновесного с оксидным расплавом, в области II -
Таблица 2
Энергетические параметры теории субрегулярных ионных растворов для оксидного расплава FeO-V2O3-Cr2O3-MnO
|
Система |
QijH > Дж/моль |
||
|
FeO-V2O3 |
Йш= 14650 |
21122 25100 |
' 0222 = 23000 |
|
FeO-Cr2O3 |
21113 = 4360 |
2изз = 26700 |
21333 = 5400 |
|
FeO- MnO |
21114 =° |
21144 =0 |
21444 = 0 |
|
V2O3-Cr2O3 |
22223 = 17150 |
2г23з = 34300 |
2гззз = 17150 |
|
V2O3-MnO |
22224 = 0 ■ |
22244 =0 |
22444 = 0 |
|
Cr2O3 - MnO |
2з334 = 0 |
2з344 = 0 |
23444 = 0 |
|
FeO- V2O3 - Cr2O3 |
Й123 =62800 |
21223 = 79500 |
21233 = 77600 |
|
FeO-V2O3-MnO |
21124 =0 |
21224 = 0 |
21244 = 0 |
|
FeO- Cr2O3 - MnO |
21134 ~° |
21334 = 0 |
21344 =0 |
|
V2O3 - Cr2O3 -MnO |
22234 = 0 |
2гзз4 = 0 |
22344 = 0 |
Михайлов Г.Г., Чернова Л.А.
Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr-Mn-0-C
Таблица 3
Параметры взаимодействия компонентов е/ в жидком металле при 7=1873 К
На рис. 1 б приведены экспериментальные данные работы [4]. Авторы этой работы исследо-
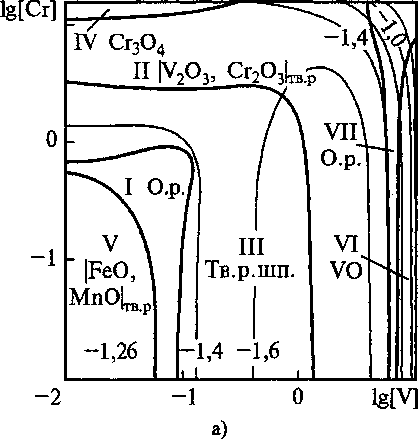
Рис. 1. Сечение ПРКМ системы Fe-V-Cr-Mn-О при Т = 1600 °C а) [Мп] = 1 мае. %; 6) [Мп] = 0,7 мае. %
б)
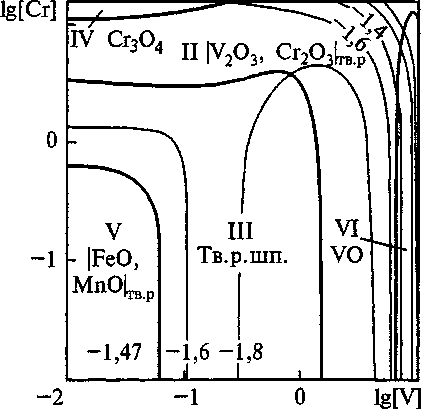
Рис. 2. Сечение ПРКМ системы Fe-V-Cr-Mn-0 при Т = 1550 °C, [Мп] = 1 мае. %
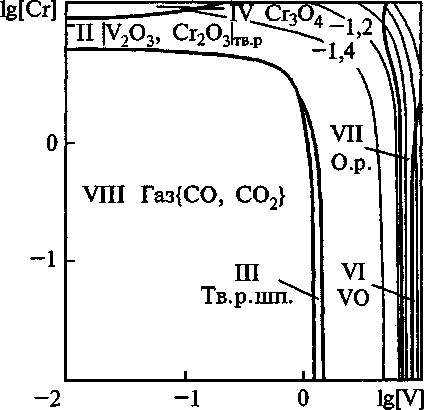
Рис. 3. Сечение ПРКМ системы Fe-V-Cr-Mn-O-C при Т= 1600 °C, [Мп] = 1 мае. %, [q = 0,2 мае. %, Робщ = 1 атм
вали образование неметаллических включений в стали, легированной ванадием, хромом и марганцем. Для составов, заданных т. 1 и 2 они установили в качестве равновесных образование шпинельных твердых Растворов. Для составов, обозначенных т. 3, было установлено образование твердых растворов V2O3-Cr2O3. Для т. 4 характерно образование твердых растворов FeO-MnO. Данные работы [4] соответствуют результатам нашего расчета.
Ванадий вводят в сталь обычно на десятые доли процента, марганец - около 1 мае. %, а хрома во многих конструкционных марках стали содержится около 1,5 мае. %. При этих концентрациях наиболее вероятно образование в равновесии с жидким металлом твердого раствора шпинелей. При содержании хрома в жидком металле выше 10 мае. % возможно образование СГ3О4, а при содержании ванадия в металле выше 8 мае. % - VO.
Предложенный в работе метод анализа равновесий жидкого металла с неметаллическими фазами позволяет проектировать процессы рафинирования жидких металлов от кислорода и моделировать технологически необходимые фазовые равновесия. ■
Выводы
Методом термодинамического моделирования построена диаграмма растворимости компонентов в жидком металле системы Fe-V-Cr-Mn-0-C. Результаты расчетов сопоставлены с результатами экспериментальных данных, приведенных в литературе. Получено удовлетворительное соответствие расчетных и экспериментальных данных.
Список литературы Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr-Mn-O-C
- Вильгельм Е.М., Михайлов Г.Г. К термодинамике ионных растворов//Физико-химические исследования металлургических процессов: Сб. науч. тр. (УПИ). Свердловск: Изд-во УПИ, 1978. -С. 63-69.
- Михайлов Г.Г., Чернова Л.А. Термодинамический анализ процессов раскисления коррозионно-стойкой стали XI8Н1ОТ кальцием и барием//Изв. вузов. Черная металлургия. -1991. -№ 12. -С. 37-40.
- Михайлов ГГ., Чернова Л.А. Термодинамическое моделирование диаграмм состояния двойных и тройных оксидных систем, содержащих V2Oз//Компьютерное моделирование физико-химических свойств стекол и расплавов: Труды VII Российского семинара. -Курган: Изд-во Курганского гос. ун-та, 2004. -С. 1-43.
- Лопатко H.H., Михайлов Г.Г. Фазовые равновесия в расплавах на основе железа при взаимодействии кислорода с марганцем, ванадием и хромом//Известия АН. Металлы. -1991. -№ 2. -С. 11-15.


