Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr (Mn)-Si-0-C
Автор: Чернова Л.А., Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 (43), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156513
IDR: 147156513 | УДК: 669.046.558+541.1
Текст статьи Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr (Mn)-Si-0-C
В настоящее время в научной литературе содержится значительный экспериментальный материал по процессам взаимодействия кислорода, растворенного в жидком металле, с компонентами металлических расплавов. Представляется возможным на основе накопленного материала решить задачу систематизации экспериментальных данных по проблеме взаимодействия между компонентами жидких сплавов, приводящего к образованию неметаллических фаз. В качестве основного метода решения задачи выбран разработанный метод построения особых диаграмм состояния. Применение метода позволяет установить связь между составом жидкого металла и возможностью существования различных типов равновесных с ним неметаллических фаз, а также соответствующее изменение фазовых равновесий при изменении внешних условий, либо состава металлического расплава. Причем изменение состава жидкого металла на тысячные доли процента может привести к радикальным изменениям природы равновесия. Состав равновесного жидкого металла определяется на некоторой сложной концентрационной поверхности растворимости компонентов в металле (ПРКМ), а состав сопряженных равновесных неметаллических фаз на другой поверхности, которая соответствует диаграммам состояния оксидных и прочих неметаллических фаз, устойчивых при исследуемых температурах. Границы областей составов металла, равновесного с различными неметаллическими фазами постоянного и переменного состава, устанавливают, решая совместно уравнения их констант равновесия реакций, протекание которых возможно в данной системе.
На основании изучения бинарных и тройных диаграмм состояния выполнен термодинамический анализ процессов взаимодействия кислорода, хрома, ванадия, кремния и углерода жидком железе. Установлено, что в равновесии с жидким металлом могут находиться следующие оксидные фазы: оксидные расплавы 1 (высокожелезистый) и 2 (высококремнеземистый), содержащие FeO, Cr2O3, V2O3, SiO2, CrO, VO, твердый раствор оксидов |Cr2O3, V2O3|, твердые SiO2, VO и Сг3О4. В присутствии углерода возможно образование газовой фазы, состоящей из СО, СО2. Химические реакции образования этих фаз и соответствующие константы равновесия имеют следующий вид.
|
(FeO) = [Fe] + [О], |
^№30]. a(FeO) |
(1) |
|
(Сг2О3) = 2[Сг] + 3[О], |
Я(Сг2Оз) |
(2) |
|
(VA)=2[V] + 3[O], |
2 °(v2o3) |
(3) |
|
(SiO2) = [Si] + 2[О], |
a(SiO2) |
(4) |
|
(CrO) = [Сг] + [О], |
a(CrO) |
(5) |
|
(VO) = [V] + [О], |
a(vo) |
(6) |
|
|Cr2O3| = 2[Cr] + 3[O], |
^Cr2O3| |
(7) |
|
|V2O3| = 2[V] + 3[O], |
a|v2o3| |
(8) |
|
SiO2| = [Si] + 2[O], |
K9 = ^si]^2©]; |
(9) |
|
|VO| =[V] + [O], |
^io = a[v]a[o]; |
(10) |
|
|Cr3O4| = 3[Cr] + 4[O], |
3 4 . = а[Сг]а[О] ’ |
(H) |
|
{CO} = [С] + [O], |
_5c№. Л12 ~ = /’{CO} |
(12) |
|
{CO2} = [C] + 2[O], |
_5сД Ai3 - . |
(13) |
^{со,}
Температурные зависимости констант равно весия приведены в табл. 1.
Таблица 1 Зависимость констант равновесия от температуры
|
Реакция |
\^K = -A/T+B |
|
|
A |
В |
|
|
(FeO) = [Fe] + [О] |
6320 |
4,734 |
|
(SiO2) = [Si] + 2[О] |
30225 |
11,56 |
|
(Cr2O3) = 2[Cr] + 3[О] |
33460 |
14,85 |
|
(V2O3) = 2[V] + 3[O] |
39303 |
15,90 |
|
(MnO) = [Mn] + [0] |
12175 |
5,45 |
|
(CrO) = [Cr] + [0] |
8203 |
4,51 |
|
(VO) = [V] + [0] |
11760 |
5,06 |
|
I FeO | = [Fe] + [0] |
8069 |
5,80 |
|
I MnO | = [Mn] + [0] |
15017 |
6,77 |
|
I FeV2O41 = [Fe] + 2[A1] + 4[0] |
58522 |
26,48 |
|
I MnV2O41 = [Mn] + 2[A1] + 4[O] |
660878 |
27,76 |
|
I FeCr2O41 = [Fe] +2[Cr] + 4[O] |
51870 |
24,48 |
|
I MnCr2O41 = [Mn] +2[Cr] +4[0] |
55600 |
24,19 |
|
I SiO21 =[Si]+2[0] |
31100 |
12,00 |
|
|Cr2O31 =2[Cr] +3[O] |
40014 |
17,37 |
|
IV2O31 = 2[V] + 3[O] |
45430 |
18,617 |
|
1 Cr3O41 =3[Cr] + 4[O] |
53352 |
23,51 |
|
{CO] = [C] + [O] |
1168 |
-2,07 |
|
{C02} = [C] + 2[0] |
9616 |
2,51 |
Активности компонентов твердого раствора оксидов |Cr2O3, V2O3| рассчитывали по теории регулярных растворов (Q2= 16 740 Дж/моль). Активности компонентов оксидного расплава (FeO, Сг2О3, V2O3, SiO2) рассчитывали по теории субрегулярных ионных растворов. Общая формула для расчета активности компонента s в оксидном расплаве имеет вид [1]:
7?71па, = vs [ЯПп xs +
5-1
+У + 2х^х„Оц„ +Зх,х^О;„Л +
/^ ^^s^Qsssj ^XsXjQssjj XjQsjjj^~ 7=5+1
”3^ ^ (X' XjQiij + Xi Xj Qiw + XiXjQwJ )
/=1 j=j+1
5-2 5-1
+У V I x7x + Xjx 2 QHi. + 2xx iXsQn„ I +
/=1 7=,+i
"^^ /^ ^/ XkQnsk ^^i^s^kQissk X'i^kQiskk ) /=1 ^=5+1
+ ^ ^u ^'■^s-^j^kQssjk "^"-^jxkQsjjk "^* ^j^kQsjkk^" 7=5+1 k=s+2
-3£ E E ^xjxkQiijk+X,X^XkQjjjk+XiXJX^Qij1dc^ + i=l j=H-\k=t*2
5-3 5-2 5-1
+E E E XjXjXkQyks +
(=1 j=i+lk=j+l з-2 5-1 т 5-1 т-1 т
ЕXiXjXiQijsl +ЕЕ Е^i^k^lQiskl -^ /-1 j^i J^-^-l /=1 £=5+lZ=£+l т-2 т-1
+ Е Е Е XjXkxiQsj1d -
7=5-4 k-j-\ l=k+l т-3 т-2 т-1
+Е Е Е Е XjXjXkXiQyH .
/=1 7^/-1 Л=у+1 l=k-vl.
Здесь х, - ионные доли катионов компонентов оксидного расплава; Qijkl - энергетические параметры теории. При расчетах используется часть общей формулы, где количество компонентов в индексе параметра Qjjkl не превышает трех.
Подобранные энергетические параметры теории субрегулярных ионных растворов для оксидного расплава FeO- V2O3 - Cr2O3 - SiO2 приведены в табл. 2.
В связи с отсутствием надежных литературных данных по диаграммам состояния с СгО и VO их активности приравнивали ионным долям (по теории совершенных ионных растворов).
Активности компонентов металлического расплава рассчитывали по теории Вагнера с использованием параметров взаимодействия, численные значения которых приведены в табл. 3.
Таблица 2 Энергетические параметры теории субрегулярных ионных растворов для оксидного расплава
РеО-УгОэ-СггОз-ЗЮг-МпО
|
Система |
Qjkl , Дж/моль |
||
|
FeO-V2O3 |
14 650 |
25 100 |
23 000 |
|
FeO- Cr2O3 |
4 360 |
26 700 |
5 400 |
|
FeO-SiO2 |
960 |
-34 100 |
50 500 |
|
FeO-MnO |
0 |
0 |
0 |
|
V2O3-Cr2O3 |
17 150 |
34 300 |
17 150 |
|
V2O3-SiO2 |
71 150 |
142 300 |
71 150 |
|
V2O3-MnO |
0 |
0 |
0 |
|
Cr2O3-SiO2 |
49 950 |
83 500 |
64 200 |
|
Cr2O3 - MnO |
0 |
0 |
0 |
|
FeO- V2O3 - Cr2O3 |
62 800 |
79 500 |
77 600 |
|
FeO-V2O3-SiO2 |
230 200 |
418 500 |
376 650 |
|
FeO- V2O3 -MnO |
0 |
0 |
0 |
|
FeO- Cr2O3 - SiO2 |
50 200 |
113 000 |
146 500 |
|
FeO- Cr2O3 - MnO |
0 |
0 |
0 |
|
FeO- SiO2 -MnO |
83 700 |
125 550 |
104 650 |
|
V2O3 - Cr2O3 - SiO2 |
0 |
0 |
376 650 |
|
V2O3-Cr2O3-MnO |
0 |
0 |
0 |
|
V2O3-SiO2-MnO |
209 250 |
-418 500 |
334 800 |
|
Cr2O3 - SiO2 -MnO |
0 |
0 |
0 |
Таблица 3
Параметры взаимодействия компонентов е/ в жидком металле при Т = 1873 К
|
Элемент г |
Элемент/ |
|||||
|
Si |
Мп |
V |
Сг |
О |
С |
|
|
Si |
0,14 |
0,03 |
0,025 |
-0,0003 . |
-0,176 |
0,187 |
|
Мп |
0,06 |
0 |
0,0057 |
0,0039 |
-0,072 |
-0,055 |
|
V |
0,0425 |
0,0053 |
0,015 |
0 |
-0,534 |
-0,327 |
|
Сг |
-0,0006 |
0,0037 |
0 |
-0,0003 |
-0,133 |
-0,104 |
|
О |
-0,1 |
-0,021 |
-0,168 |
-0,041 |
-0,2 |
-0,45 |
|
С |
0,08 |
-0,012 |
-0,077 |
-0,024 |
-0,34 |
0,14 |
Построены поверхности растворимости компонентов в жидком металле (ПРКМ) системы Fe-V-Cr-Si-O. Изучено влияние температуры, содержания углерода и хрома или ванадия на строение ПРКМ. На рис. 1-3 приведены изотермические изосоставные сечения ПРКМ системы Fe-V- тов твердых
образование Сг3О4, а при содержании ванадия в металле выше 8 мае. % - VO.
Также было изучено влияние температуры и состава жидкого металла на образование неметаллических включений в системе Fe-V-Mn-Si-O. На рис. 4, 5 приведены изотермические изосоставные сечения ПРКМ системы Fe-V-Mn-Si-О для различных содержаний марганца. Исходные данные для расчетов ПРКМ представлены в табл. 1-3. Активности компонен-растворов оксидов |FeO, МпО| и шпинелей |FeV2O4, MnV2O4| приравнивали их мольным долям (по теории совершенных ионных растворов).
Cr-Si-O-C при Т = 1600 °C. В области I заданы составы жидкого металла, равновесного с кремнеземом, в области II - с твердыми растворами ванадия и хрома трехвалентных, в области Ш - с высокожелезистым оксидным расплавом, в области IV-с высококремнеземистым оксидным расплавом, в области V - с газовой фазой, состоящей из СО и СО2. Тонкими линиями нанесены изокислородные сечения ПРКМ.
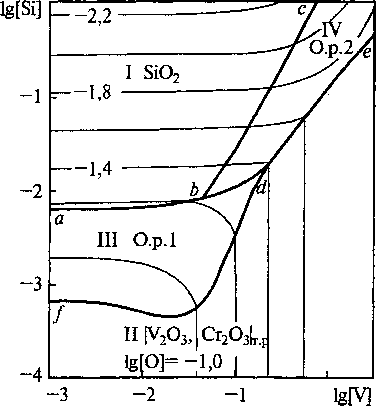
Рис. 1. Сечение ПРКМ системы Fe-V-Cr-Si-0-C при Т = 1600 °C и [Сг] = 0,25 мае.%
Ванадий вводят в сталь обычно на десятые доли процента, а хрома во многих конструкционных марках стали содержится около 1,5 мае. %. При этих концентрациях наиболее вероятно образование в равновесии с жидким металлом твердого раствора оксидов ванадия и хрома трехвалентных и практически чистого жидкого SiO2. Твердый SiO2 может образовываться только при концентрации ванадия не более 0,3 мае. %, если содержание хрома в металле 1,5 мае. %. При содержании хрома в жидком металле выше 10 мае. % возможно
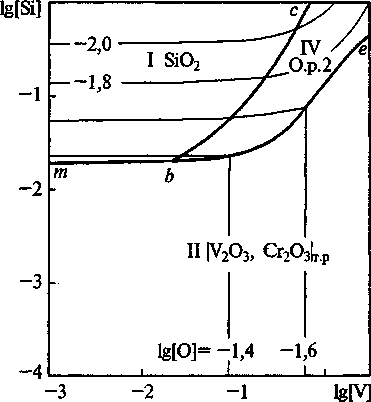
Рис. 2. Сечение ПРКМ системы Fe-V-Cr-Si-0-C при Г = 1600 °C и [Ст] = 1,5 мас.%
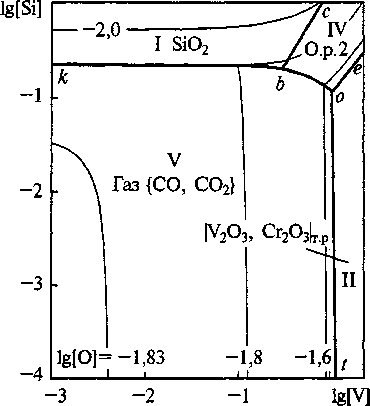
Рис. 3. Сечение ПРКМ системы Fe-V-Cr-Si-0-C при Г = 1600 °C, [Сг] = 1,5 мас.%, [С] = 0,2 мас.%, Р„6щ = 1 атм
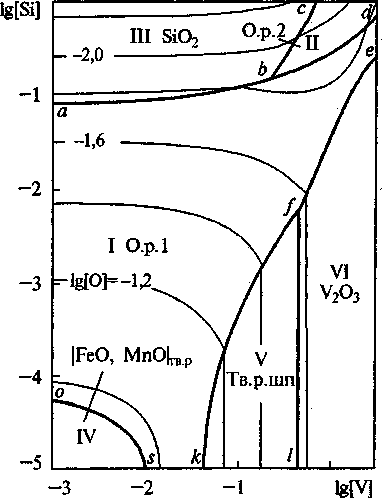
Рис. 4. Сечение ПРКМ системы Fe-V-Mn-Si-0-C при Г = 1600 °C и [Мп] = 0,4 мас.%. Тв. р. шп - |FeV2O4, Мп V2O4|
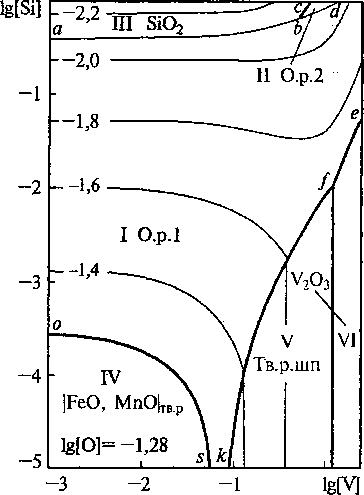
Рис. 5. Сечение ПРКМ системы Fe-V-Mn-Si-0-C при Т = 1600 °C и [Мп] = 1 мас.%
Марганец в ванадийсодержащий металл вводят на 0,4-1 мас.%, а кремний - на десятые доли процента. При таких концентрациях наиболее вероятно образование жидких неметаллических включений и оксида ванадия трехвалентного (при пониженном содержании марганца). Та же картина наблюдается и в присутствии углерода, если его концентрация не более 0,2 мас.%.
Полученные диаграммы позволяют объяснить многообразный фазовый состав неметаллических включений в сталях, легированных хромом, ванадием и раскисленных кремнием и марганцем.
Список литературы Термодинамика процессов взаимодействия кислорода с металлическими расплавами систем Fe-V-Cr (Mn)-Si-0-C
- Вильгельм Е.М., Михайлов Г.Г. К термодинамике ионных растворов//Физико-химические исследования металлургических процессов: Сб. науч. тр. (УПИ). -Свердловск: Изд-во УПИ, 1978. С. 63-69.


