Термодинамика процессов взаимодействия магния, алюминия, углерода и иттрия с кислородом в расплаве на основе железа
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Смирнов Леонид Андреевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.16, 2016 года.
Бесплатный доступ
Создание системы управления качеством металла, во многом определяемой организацией финишных процессов рафинирования стали, рациональным микролегированием стали, модифицированием структуры металла и неметаллических включений, может быть возможным при установлении роли каждой составляющей комплексных сплавов, лигатуры, смесевых модификаторов. При решении такой задачи может помочь термодинамическое моделирование процессов взаимодействия компонентов металла с неметаллическими примесями, в частности, с кислородом. Выходным продуктом такого моделирования могут быть особые диаграммы состояния, поверхности растворимости компонентов в жидком металле (ПРКМ). В публикуемой работе подобран комплекс термодинамических параметров и разработана методика построения ПРКМ для системы Fe-Mg-Al-Y-O-C. Впервые построена путем термодинамических расчетов диаграмма состояний оксидной системы MgO-Al2O3-Y2O3, что позволило с учетом предварительно полученных данных для оксидных систем FeO-Al2O3-Y2O3, FeO-Al2O3-MgO, FeO-MgO-Y2O3 создать термодинамическую модель процесса глубокого раскисления стали алюминием, магнием, иттрием с возможностью расширения проведения расчетов для более сложных систем.
Термодинамика, фазовые равновесия, диаграммы состояния, иттрий, алюминий, магний
Короткий адрес: https://sciup.org/147157043
IDR: 147157043 | УДК: 669.017 | DOI: 10.14529/met160301
Текст научной статьи Термодинамика процессов взаимодействия магния, алюминия, углерода и иттрия с кислородом в расплаве на основе железа
В металлургической литературе активно обсуждается вопрос о повышении качества углеродистых и малолегированных конструкционных трубных и литейных марок сталей. Быстротечность современного сталеплавильного процесса требует четкого обеспечения технологического режима плавки, оптимизации процессов внепеч-ного рафинирования стали, процедур доведения стали до марки, а также организации процессов микролегирования и модифицирования неметаллических включений стали [1]. Микролегирование на финишных этапах внепечной обработки стали сопровождается сложными физико-химическими процессами взаимодействия между всеми составляющими жидкой стали и рафинирующего шлака, преследует цель очистить межзеренные границы от неметаллических включений и легкоплавких интерметалидных образований, измельчить и глобулизировать оставшиеся неметаллические включения, снизить показатели анизотропии и повысить технологические и эксплуатационные свойства стали [2]. Для построения системы рекомендаций микролегирования углеродистых конструкционных марок сталей с использованием высокоактивных щелочноземельных элементов и редко- земельных элементов необходимо разработать термодинамическую модель сложных фазовых равновесий, имеющих место на завершающих стадиях рафинирования стали. Вначале это необходимо делать для сравнительно несложных систем [3]. В круг редкоземельных элементов часто включают и иттрий, хотя он просто находится в одной группе с лантаном, и поэтому по многим химическим свойствам он подобен редкоземельным металлам [4], но выделяется относительно бóльшим сродством к кислороду при его введении в жидкий металл [5]. Как правило, РЗМ вводят в сталь на финише рафинирования, т. е. в последнюю очередь. Если глубокое раскисление стали проводилось в ковше алюминием и кальцием, то на финише рафинирования, т. е. в момент введения РЗМ, кальций практически весь удалился из металла и в ощутимых, но малых, концентрациях в стали останется в основном алюминий [7]. Процессы, влияющие при этом на химический состав и морфологию неметаллических оксидных включений могут быть рассмотрены посредством термодинамического моделирования. Ранее была изучена система Fe–Y–Al–O–C [9]. Но при глубоком раскислении из рафинировочного шлака и огнеупоров металлопроводки в результате восстановления периклаза в металле появляется некоторое количество магния. Этот фактор необходимо учесть при моделировании взаимодействия алюминия, иттрия и магния с кислородом в жидком железе. Диаграмма состояний системы MgO–Y2O3–Al2O3 в литературе отсутствует. Но параметры расплавов оксидов системы (MgO, Al2O3, Y2O3, FeO) и термодинамические характеристики некоторых реакций, не построив диаграмму MgO–Y2O3–Al2O3, установить невозможно. На рис. 1 впервые представлена полученная расчетным путем диаграмма состояний системы MgO–Y2O3–Al2O3. Следует отметить, что для каждой точки этой поверхности ликвидус установлен состав и температура равновесного оксидного расплава. В табл. 1 приведены характерные точки этой оксидной диаграммы.
В табл. 2 приведены энергетические параметры теории субрегулярных ионных растворов, впервые подобранные для системы MgO–Y2O3–Al2O3.
Фактически оксиды, составляющие диаграмму состояний системы MgO–Y2O3–Al2O3, определяют основные реакции раскисления жидкого железа магнием, алюминием и иттрием. При раскислении углеродистого металла магнием, алюминием и иттрием могут протекать следующие химические реакции:
(FeO) = [Fe] + [O],(1)
(Y2O3) = 2[Y] + 3[O],(2)
(Al2O3) = 2[Al] + 3[O],(3)
(MgO) = [Mg] + [O],(4)
|Al2O3| = 2[Al] + 3[O],(5)
|Y2O3| = 2[Y] + 3[O],(6)
|FeO·Al2O3|= [Fe] + 2[Al] + 4[O],(7)
|MgO·Al2O3|= [Mg] + 2[Al] + 4[O],(8)
|FeO| = [Fe] + [O],(9)
|MgO| = [Mg] + [O],(10)
|2Y2O3·Al2O3|= 4[Y] + 2[Al] + 9[O],(11)
|Y2O3·Al2O3|= 2[Y] + 2[Al] + 6[O],(12)
|3Y2O3·5Al2O3|= 6[Y] + 10[Al] + 24[O].(13)
В присутствии углерода возможно так же протекание реакций окисления углерода:
{CO} = [C] +[O],(14)
{CO2} = [C] +2[O].(15)
Необходимо также учесть и испарения магния: {Mg} = [Mg].(16)
Прямыми скобками выделены компоненты в твердых фазах, квадратными – растворенные в жидком металле, круглыми – в жидких фазах, фигурными – компоненты газовой фазы.
Значения используемых констант равновесий заимствованы из многочисленной специальной ли-
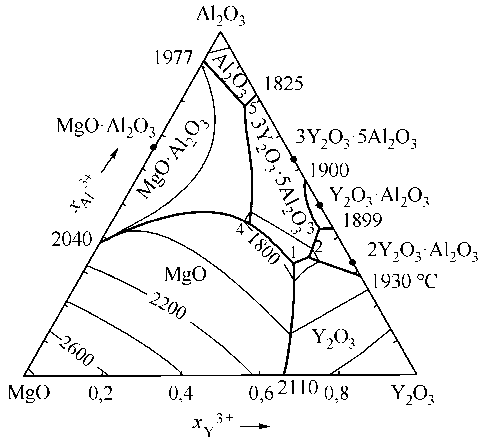
Рис. 1. Расчетная диаграмма состояний MgO–Y 2 O 3 –Al 2 O 3
Таблица 1
Координаты узловых точек диаграммы состояния системы MgO–Y 2 O 3 – Al 2 O 3 и состав равновесных оксидных фаз в ионных долях
|
Точка |
Т , °С |
x Mg2 + |
x Y 3 + |
x Al3 + |
Равновесие |
|
1 |
1743 |
0,15 |
0,52 |
0,33 |
Ж – Y 2 O 3 – MgO – 3Y 2 O 3 ·5Al 2 O 3 |
|
2 |
1769 |
0,10 |
0,55 |
0,35 |
Ж – Y 2 O 3 – 2Y 2 O 3 ·Al 2 O 3 – 3Y 2 O 3 ·5Al 2 O 3 |
|
3 |
1849 |
0,03 |
0,54 |
0,43 |
Ж – Y 2 O 3 ·Al 2 O 3 – 2Y 2 O 3 ·Al 2 O 3 – 3Y 2 O 3 ·5Al 2 O 3 |
|
4 |
1789 |
0,20 |
0,35 |
0,45 |
Ж – MgO –MgO·Al 2 O 3 – 3Y 2 O 3 ·5Al 2 O 3 |
|
5 |
1795 |
0,05 |
0,17 |
0,78 |
Ж – Al 2 O 3 – MgO·Al 2 O 3 – 3Y 2 O 3 ·5Al 2 O 3 |
Михайлов Г.Г., Макровец Л.А., Смирнов Л.А.
Термодинамика процессов взаимодействия магния, алюминия, углерода и иттрия с кислородом в расплаве на основе железа
Таблица 2
Энергетические параметры теории субрегулярных ионных растворов MgO–Y 2 O 3 –Al 2 O 3
На рис. 2 представлена поверхность растворимости компонентов в стали (система Fe–Y–Al– Mg–O) при температуре 1600 °С и давлении 1 атм, построенная на основании представленных выше данных. В области I заданы составы металла, равновесного с корундом, в области II – с твердыми растворами |FeO·Al2O3, MgO·Al2O3|, в области III – с соединением 3Y2O3·5Al2O3, в области IV – с оксидом иттрия, в области V – с парами магния, в области VI – с твердыми растворами оксидов железа и магния. Система оксидов MgO–Y2O3–Al2O3 относится к высокотемпературным системам. Это отражается на строении ПРКМ, координаты которой отнесены к температуре 1600 °С. При этой температуре в равновесии с жидким металлом могут находиться только твердые фазы. С повышением температуры вид ПРКМ может в корне измениться. На рис. 3 представлены ПРКМ системы lg[Mg]
-3
-5
/V {Mg}
t / s VI реОД
II |FeAl2O4, MgAl2O4|
a
I A12O3 lg[O]=-3,02
-5
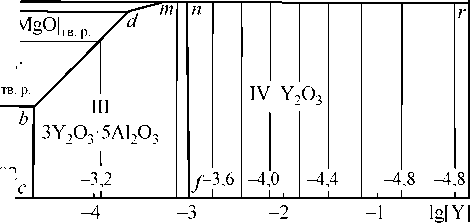
Рис. 2. ПРКМ системыFe–Y–Al–Mg–O, Т = 1600 °С, P общ = 1 атм, [Al] = 0,005 мас. %
II |FeAl2O4, MgAl2O4|
а)
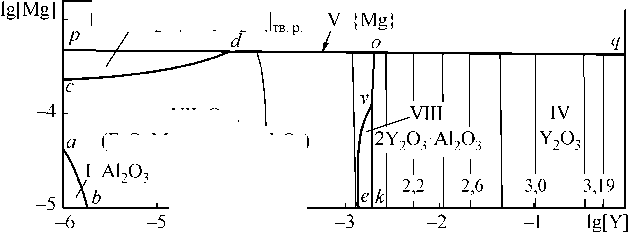
VII O p.
(FeO, MgO, Y2O3, A12O3)
lg[O] =-1,6
б)
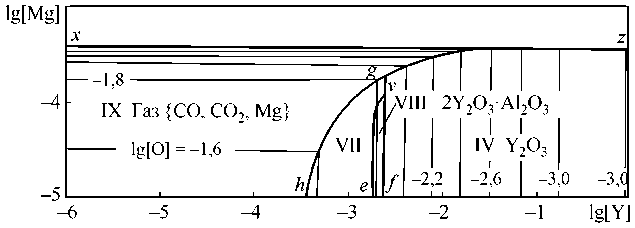
Рис. 3. ПРКМ системыFe–Y–Al–Mg–O, Т = 1890 °С, P общ = 1 атм, [Al] = 0,005 мас. %: а) [C] = 0, б) [C] = 0,1 мас. %
Fe–Y–Al–Mg–O при температуре 1890 °С. В случае отсутствия углерода (рис. 3, а) видно проявление в равновесии с металлом жидкой оксидной фазы (область VII). В области VIII заданы составы металла, равновесного с соединением 2Y2O3·Al2O3. Обозначение остальных областей соответствует рис. 2. По линии pdoq заданы составы металла, равновесного с соответствующими оксидными фазами и парами магния. На рис. 3, б в металл добавлен углерод (0,1 мас. %). В области IX при этих условиях задан состав металла, равновесного с газовой фазой {CO, CO 2 , Mg}, в области VII – с расплавом оксидов и в области VIII – с фазой 2Y2O3·Al2O3. При проведении расчетов диаграмм растворимости компонентов в жидком железе (ПРКМ) использовались данные по удельным параметрам взаимодействия первого порядка, приведенные в обзорах [13, 14], их зависимости от температуры, пропорциональны 1/ Т . Энергетические параметры теории субрегулярных растворов представлены в работе [9].
Заключение
-
1. На основании имеющихся в литературе сведений и авторских анализов и расчетов проведено термодинамическое моделирование фазовых равновесий, устанавливающихся при взаимодействии магния, алюминия и иттрия с кислородом в жидком железе.
-
2. Для проведения термодинамических расчетов подготовлена база данных по энергетическим параметрам субрегулярных ионных растворов, температурным зависимостям констант равновесия основных реакций раскисления для исследуемой системы и параметрам взаимодействия первого порядка, чем создан основательный фундамент для изучения более сложных систем. Впервые построена диаграмма состояний системы MgO–Y2O3–Al2O3 в приближении субрегулярных ионных растворов.
-
3. Впервые построены поверхности растворимости компонентов в жидком железе для системы Fe–Y–Al–Mg–O при температуре сталеварения (1600 °С) и более высоких температурах (1890 °С). Из вида ПРКМ следует, что при температурах сталеварения большая часть оксидных включений будет представлять собой твердые оксидные, скорее всего, спекшиеся оксидные конгломераты в основном малых размеров (1–3 мкм), при этом может быть достигнута очень большая глубина раскисление ([O] = 10–5 мас. %).
Список литературы Термодинамика процессов взаимодействия магния, алюминия, углерода и иттрия с кислородом в расплаве на основе железа
- Голубцов, В.А. Модифицирование стали для отливок/В.А. Голубцов, В.В. Лунев. -Челябинск; Запорожье: ЗНТУ, 2009. -356 с.
- Рябчиков, И.В. Модификаторы и технологии внепечной обработки железоуглеродистых сплавов. -М.: ЭКОМЕТ, 2008. -400 с.
- Обработка конструкционной стали РЗМ и SiCa с целью повышения ее качества/В.П. Харчевников, И.Л. Бродецкий, А.И. Троцан, Б.Ф. Белов//Труды III Конгресса сталеплавильщиков. Москва, 1995 г. -М., 1996. -С. 364-367.
- Химия. Справочное руководство/пер. с нем. под ред. Ф.Г. Гаврюченкова, М. И. Курочкиной, А. А. Потехина, В. А. Рабиновича. -Л.: Химия, 1975. -576 с.
- Тарасюк, Л.И. Формирование неметаллических включений в сталях, модифицированных иттрием/Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков//Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». -2011. -№ 2 (23). -С. 27-33.
- Тарасюк, Л.И. Термодинамика раскисления железа иттрием/Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков//Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». -2011. -№ 2 (23). -С. 33-39.
- Совершенствование литейных жаростойких хромоалюминиевых сталей микролегированием и модифицированием/М.М. Ямшинский, Г.Е. Федоров, Е.А. Платонов и др.; Национальный технический университет Украины «КПИ», Киев. -http://science-bsea.narod.ru/2009/mashin_ 2009/jamshinsky_sov.htm
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов -М.: Издат. Дом МИСиС. -2009. -519 с.
- Михайлов, Г.Г. Термодинамика процессов взаимодействия иттрия, кальция, магния и алюминия с кислородом в жидкой стали/Г.Г. Михайлов, Л.А. Макровец, Л.А. Смирнов//Вестник ЮУрГУ. Серия «Металлургия». -2016. -Т. 16, № 2. -С. 5-13 DOI: 10.14529/met160201
- Михайлов, Г.Г. Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y2O3/Г.Г. Михайлов, Л.А. Макровец//Вестник ЮУрГУ. Серия «Металлургия». -2014. -Т. 14, № 4. -С. 5-10. DOI: 10.14529/met150401
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Диаграммы состояния силикатных систем. Справочник. Выпуск первый. Двойные системы/Н.А. Торопов, В.П. Барзаковский, В.В. Лапин, Н.Н. Курцева. -Л.: Наука, Ленинград. отд-ние, 1969. -822 с.
- Steel making data sourcebook revised edition by The Japan society for the science. The 19th committee on steelmaking. 1988 by Gordon and Breach Science Publishers S.A., Post office box 161 1820 Montreux 2, Switzerland. -325 p.
- Bůžek, Z. Vliv přechodných kovú na aktivitu a rozpustnost kysliku v železe při 1600 °C/Z. Bůžek, M. Macoszek, J. Szlauer//Hutnické listy. -1972. -vol. 27, no. 8. -P. 547-557.


