Термодинамика процессов взаимодействия в системе Cu-Ni-O
Автор: Михайлов Г.Г., Самойлова О.В., Трофимов Е.А., Сидоренко А.Ю., Пашкеев И.Ю.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 9 (109), 2008 года.
Бесплатный доступ
Работа проведена при поддержке гранта РФФИ (проект № 07-08-00365).
Короткий адрес: https://sciup.org/147156603
IDR: 147156603 | УДК: 669.33
Текст научной статьи Термодинамика процессов взаимодействия в системе Cu-Ni-O
В настоящее время рафинировочные предприятия перерабатывают значительные объемы черновой меди с повышенным содержанием никеля. При рафинировании меди от никеля возникают определенные трудности. Существенную их часть можно объяснить тем, что медь и никель характеризуются сравнительно небольшим различием в сродстве к кислороду [1].
Для лучшего понимания сути фазовых равновесий, реализующихся в системе Cu-Ni-O, полезно построить поверхность растворимости кислорода в металле (ПРКМ) для этой системы. Такая диаграмма отражает связь содержания кислорода и никеля в жидкой меди, находящейся в равновесии с различными оксидными фазами этой системы и, в частности, показывает, при каких условиях возможна реализация равновесия жидкий металл -твёрдый NiO — оксидный расплав.
Для построения ПРКМ необходимо описать фазовые равновесия, реализующиеся в оксидной системе Cu2O-NiO. Данных по диаграмме состояния системы Cu2O-NiO в литературе очень мало. В справочнике [2] сообщается, что это диаграмма эвтектического типа с координатами точки эвтектики: Т= 1218 °C (1491 К); 96,1 мас.% Си2О; 3,89 мас.% NiO (рис. 1).
Для расчета активностей компонентов оксидного расплава в настоящей работе использовалось приближение теории субрегулярных ионных растворов, согласно которой lgtii=yilgx,+ г^Зх^бпг+XjX2(2 3X])Q122 +^(1 3^)21222 J
+ 2.3RT
; (1)
lg а2 =v2lgX2 + v2^ (1-3^)6ц2 +л^х2(2-Зх2)й122 + 3x12x2Q222]
+ 2,3RT
Здесь x - катионная доля компонента (обозначим Cu2O в шлаке индексом 1, NiO - индексом 2); v — стехиометрический коэффициент (для Cu2O v = 2, для NiO v = 1); Г - температура, К; R - универсальная газовая постоянная (7? = 8,314 Дж/(моль-К)); QijH - энергетические параметры теории, Дж/моль.
Опираясь на известную информацию о системе Cu2O-NiO, были подобраны значения 5уИ:
Qnn = 26 123 Дж/моль;
61122 = 28 429 Дж/моль;
61222 = 28 177 Дж/моль.
При расчете использовались следующие значения температур и теплот плавления для компонентов:
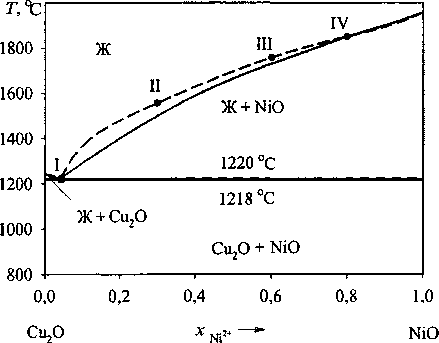
Рис. 1. Диаграмма состояния системы Cu2O-NiO: сплошные линии - справочные данные [2]; штриховые линии - результаты расчета. Точками обозначены равновесия, используемые при расчете
Си2О: 7^ = 1242 °C; АтЯ°0 = 64 300 Дж/моль [3];
NiO: Т“ = 1957 °C; ^mH°0 = 50 660 Дж/моль [4].
Далее, используя параметры Qyki, были рассчитаны координаты линий ликвидус для диаграммы состояния Cu2O-NiO (см. рис. 1).
Точка эвтектики расчетной диаграммы несколько отличается по составу от литературных данных. Координаты расчетной точки эвтектики: 4,59 мас.% NiO, Т= 1220 °C.
Процесс образования оксидных фаз для системы Cu-Ni-O можно описать следующим образом:
(Си2О) = 2 [Си] + [О];(3)
(NiO) = [Ni] + [О];(4)
,Cu2O| = 2 [Си] + [О];(5)
|NiO| = [Ni] + [О].(6)
Для реакций (3)—(6) можно записать следующие выражения для констант равновесия:
_ a[Cu] ‘ a[O] _ [Cu]2 ‘ /[O] ' [°] .
A(Cu2O) ~ “ 2 2’
W) X(cu+) Г(Си+)
_ ^[Ni] ' «[O] _ /[Ni] ' I™] • /[O] ‘ [°] . л(№о)-— :> w
“(NiO) X(№2H Г(м2+1
^|Cu2O| “ a[Cu] " °[O] ~ [Cu] " ^O] ' M ’^
^|NiO| = °[Ni] " ^[O] = /[Ni] ' D^]' /[О] И 1 ПФ Коэффициенты y^Nij и ^oj можно выразить через параметры взаимодействия первого порядка:
MNi]=^[%Ni] + e°-[%0];(11)
^^[о] = ^ -[%О]+^ .[%Ni].(12)
При расчете ПРКМ системы Cu-Ni-O использовались следующие температурные зависимости констант равновесия:
-
а) для чистых твердых компонентов [5]:
lg^|cu2o| =-^ + 4,468;(13)
lg^M=~—+6,365;(14)
-
б) для компонентов шлакового расплава были получены следующие зависимости:
lg^(cu2o)=-—+ 2,251;(15)
Ig^(Nio)=-—+5,178.(16)
Значения параметров взаимодействия е^ и ед заимствованы из литературных источников [6, 7]:
eNi “+у ’О
^о= -^ + 0,327.(18)
Значение параметра взаимодействия ед1 в ходе расчетов необходимо было уточнить. Использование литературных данных при расчёте приводит к тому, что изотермы растворимости кислорода в металле при равновесии металла с чистым твердым NiO становятся численно неоднозначны. При одном и том же содержании никеля равновесие реализуется при двух значениях содержания кислорода, что не имеет физического смысла. Снижение абсолютного значения ед1 позволяет этого избежать (рис. 2).
В ходе работ по уточнению значения этого параметра, от литературного значения ед1 =-0,0335 [1] при 1200 °C (температурная за-
Ni 49,35
висимость ео =--——) параметр пришлось из менить до ед1 =-0,0250 при 1200 °C (температур-
Ni 36,83 ная зависимость е0 =---—
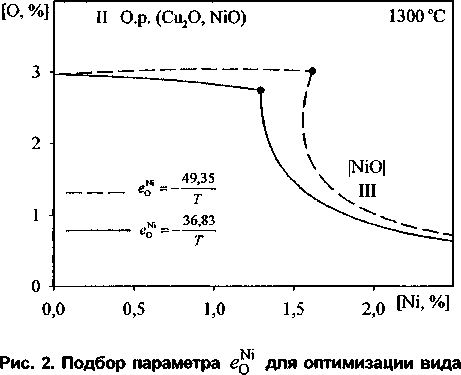
кривой изотермы растворимости кислорода в металле при равновесии с твёрдым NiO
Таким образом, при расчете ПРКМ системы Cu-Ni-O использовали следующие значения параметров, характеризующих взаимодействие никеля с кислородом в жидкой меди:
Ni 36,83
ео =--, (19)
о 135,10
eNi ” т
ПРКМ системы Cu-Ni-O представлена на рис. 3.

Рис. 3. ПРКМ системы Cu-Ni-O: ▲ - литературные данные [8]
Линия а-b соответствует тройному равновесию металл - твёрдый Си2О - оксидный расплав (Cu2O, NiO). С увеличением температуры эта линия уходит в сторону малых содержаний никеля. Линия b-с соответствует тройному равновесию металл - твёрдый NiO - оксидный расплав (Си2О, NiO). С увеличением температуры она уходит в сторону больших концентраций никеля. Линия b-d соответствует тройному равновесию металл -твёрдый Си2О - твёрдый NiO (без участия оксидного расплава, так как эта линия проходит ниже температуры эвтектического равновесия в системе Cu2O-NiO). С увеличением температуры линия b-d уходит в сторону больших концентраций никеля.
Михайлов Г.Г., Самойлова О.В., Трофимов Е.А., Сидоренко А.Ю., Пашкеев И.Ю.
Точка b соответствует равновесию металл -твёрдый Си2О - твёрдый NiO - оксидный расплав. Координаты этой точки: Т = 1220,12 °C, [Ni, %] = 0,7124, [О, %] = 2,1874.
В области I (равновесие металла с чистым твердым Си2О) с увеличением концентрации никеля растет концентрация растворенного в меди кислорода. В области II (равновесие металла с оксидным расплавом) и в области III (равновесие металла с чистым твердым NiO) концентрация растворенного в меди кислорода уменьшается с увеличением содержания никеля.
Положение линий b-d и b-с подтверждается данными исследователей, изучавших эту систему. Согласно обобщившим эти результаты авторам работы [8], минимальная концентрация никеля, при которой образуется оксид никеля, составляет 0,4...0,5 % при 1150 °C, 0,6...0,7 % при 1200 °C, 0,9... 1,0 % при 1250 °C (см. рис. 3).
В ходе настоящей работы получены экспериментальные данные, подтверждающие, что при содержании никеля в медном расплаве 1 мас.% образуются включения оксида никеля NiO (рис. 4).

Рис. 4. Микрофотография поверхности шлифа образца меди с содержанием растворенного в ней никеля - 1 мас.%: 1 - включение оксида никеля
В ходе эксперимента в медно-никелевый расплав вводили оксид меди Си2О (в трубке из медной фольги). Исследование шлифа образца проводили с помощью растрового электронного микроскопа JEOL JSM-6460LV, оснащенного спектрометром энергетической дисперсии для проведения количественного рентгеноспектрального микроанализа.
Выводы
-
1. Рассчитана диаграмма состояния системы Cu2O-NiO.
-
2. Посредством термодинамических расчётов построена ПРКМ системы Cu-Ni-O. Имеющиеся литературные данные сопоставлены с положением линий расчетной ПРКМ.
-
3. Проведен эксперимент, демонстрирующий, что уже при концентрации никеля в меди ~ 1 мас.%, при окислении металлического расплава образуется оксид никеля.
Список литературы Термодинамика процессов взаимодействия в системе Cu-Ni-O
- Вольхин А.И. Анодная и катодная медь/А.И. Вольхин, Е.И. Елисеев, В.П. Жуков. Челябинск: Южно-Уральское книжное издательство, 2001. 431 с.
- Фром Е. Газы и углерод в металлах/Е. Фром, Е. Гебхард. М.: Металлургия, 1980. 712 с.
- Глушко В.П. Термические константы веществ. База данных/В.П. Глушко//http:/www.chem.msu.su
- Физико-химические свойства окислов. Справочник/под ред. Г.В. Самсонова. 2-е изд., перераб. и доп. М.: Металлургия, 1978. 471 с.
- Куликов И.С. Раскисление металлов/И.С. Куликов. М.: Металлургия, 1975. 504 с.
- Трофимов Е.А. Взаимодействие никеля с кислородом в жидкой меди/Е.А. Трофимов, Г.Г. Михайлов//Известия ВУЗов. Цветная металлургия. 2002. № 2. С. 10-13.
- Линчевский Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами/Б.В. Линчевский. М.: Металлургия, 1986. 222 с.
- Козлов В.А. Рафинирование меди/В.А. Козлов, С.С. Набойченко, Б.Н. Смирнов. М.: Металлургия, 1992. 268 с.


