Термодинамика восстановления никеля и кобальта из кислородных и сульфидных соединений
Автор: Чекушин Владимир С., Олейникова Наталья В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 1 т.1, 2008 года.
Бесплатный доступ
Рассмотрена термодинамика восстановления никеля и кобальта из кислородных и сульфидных соединений в температурном интервале 298-1273 К с применением углерод- и серосодержащих восстановителей. Установлено, что элементная сера в условиях высоких температур (более 1000 К) является эффективным восстановителем никеля и кобальта из оксидов. Использование электронодонорных свойств серы, входящей в состав сульфидов никеля и железа для восстановления никеля из оксидов, приводит к образованию соединения Ni3S2. Исследована возможность восстановления никеля и кобальта из сульфидных соединений с использованием электронодонорных свойств собственной сульфидной серы. Определены условия осуществления процесса.
Никель, кобальт, термодинамика восстановления, углеродсодержащие восстановители, серосодержащие восстановители
Короткий адрес: https://sciup.org/146114452
IDR: 146114452 | УДК: 669.017:536
Текст научной статьи Термодинамика восстановления никеля и кобальта из кислородных и сульфидных соединений
В работе обобщены сведения по термодинамике восстановления никеля и кобальта из соединений с применением общеизвестных и «нетрадиционных» восстановителей. В выполненных нами расчетах используется методика, приведенная в [1], обеспечивающая определение изменения свободной энергии реакций восстановления в широком температурном интервале, по разработанной нами программе с привлечением банка данных, сконцентрированных в [1–5].
К основным кислородным соединениям никеля промышленного значениия в первую очередь относятся его силикаты, имеющие примерный состав (Ni,Mg)6[Si4O10][OH]8 (непуит) или (Mg,Ni)4[Si4O10][OH]8·4H2O (гарниерит), где никель присутствует в форме закиси. Основными сульфидными минералами никеля являются пентландит (Fe,Ni)9S8 и миллерит NiS. Кобальт в окисленных рудах представлен ассоциацией с никелем, марганцем и мышьяком типа m(Co,Ni) O·MnO2·nH2O (асболан), Co3[AsO4]2·8H2O (эритрин) и др. В сульфидных никелевых концентратах содержатся СoS (джайпурит), CoS2 (каттьерит), (Co, Fe)AsS (глаукодот), CoAsS (кобальтин), Co3S4 (линнеит) [6].
В условиях высокотемпературных металлургических превращений (более 1400 ºС), в присутствии флюсов, особенно окиси кальция, происходит деструкция сложных оксидов никеля и кобальта с образованием простых оксидов. В сульфидных никелевых концентратах при об
разовании штейнов происходит разложение сложных природных сульфидов никеля и кобальта с образованием моносульфида никеля (аналог миллерита) и сульфидов кобальта. При конвертировании никелевых штейнов происходит изменение вещественного состава с накапливанием малосернистых сульфидов типа Ni3S2 и CoS. Никелевые продукты разделения файнштейна подвергают обжигу «намертво» с накапливанием кислородных соединений, прежде всего оксидов, в меньшей степени ферритов и сульфатов.
Независимо от минералогического состава природного никель-кобальтового сырья (окисленное, сульфидное) определяющей операцией получения никеля является восстановление его из кислородных соединений совместно с кобальтом. Широко применяемые в последние десятилетия в производстве меди автогенные процессы, обусловленные использованием в качестве восстановителя собственной сульфидной серы, не реализованы в металлургии никеля и кобальта [7].
В табл. 1 приведены значения ∆G0298,15 образования кислородных соединений никеля и кобальта и ∆G0298,15 восстановления металлов из указанных соединений углеродом и моноокисью углерода. Из таблицы следует, что в порядке убывания химической активности соединения никеля и кобальта можно расположить в последовательностях:
NiO·Al2O3→NiO·Fe2O3→NiSO4→2NiO·SiO2→NiO;
CoO∙Al2O3→CoO·Fe2O3→CoSO4→2CoO∙SiO2→Co3O4.
Для кислородных соединений независимо от состава (алюминаты, ферриты, силикаты) характерным является участие в восстановительных процессах оксидов никеля и кобальта в соответствии с уравнениями реакций:
MeO + C = Me + CO, (1) 2MeO + C = 2Me + CO2, (2) MeO + CO = Me + CO2, (3)
где Ме – Ni и Co.
Независимо от состава никель- и кобальтсодержащих соединений восстановительная способность углеродсодержащих реагентов (298,15 К) возрастает при переходе от твердого углеро-
Таблица 1. Значения ΔG образования исходных кислородных соединений никеля и кобальта и ΔG реакций восстановления металлов углеродом и окисью углерода при 298 К, кДж/г-атом Ме
Представляет несомненный интерес возможность восстановления никеля и кобальта из кислородных соединений серосодержащими реагентами, в частности сероводородом, элементной серой, диоксидом серы. Химизм процессов описывается схемами реакций:
3MeO + H2S = 3Me + H2O + SO2, (4)
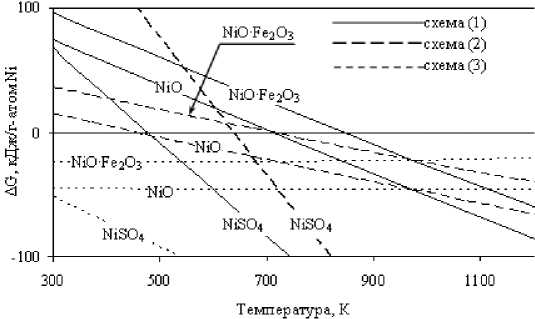
Рис. 1. Зависимости ∆G реакций восстановления никеля из кислородных соединений углеродом и моноокисью углерода от температуры
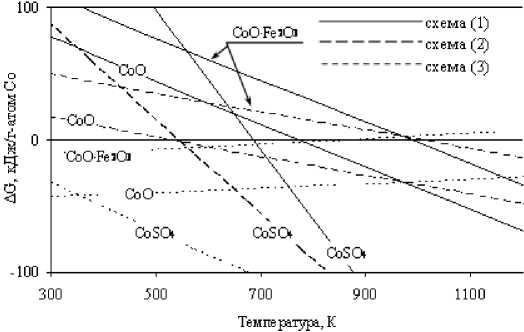
Рис. 2. Зависимости ∆G реакций восстановления кобальта из кислородных соединений углеродом и моноокисью углерода от температуры
4MeO + H2S = 4Me + H2O + SO3,(5)
2MeO + S = Me + SO2,(6)
3MeO + S = 3Me + SO3,(7)
MeO+SO2=Me+SO3.(8)
Применение сероводорода и сернистого газа в интервале температур 298–1273 ºС для металлизации никеля и кобальта не перспективно (рис. 3). При использовании элементной серы восстановление никеля возможно лишь при температуре более 1050 К, а кобальта – более 1200 К. Во всех случаях предпочтительнее получение в качестве продукта окисления диоксида серы (4), (6). Осуществление процесса с образованием в качестве продукта окисления S6+ снижает вероятность металлизации никеля. Последнее подтверждается чрезвычайно низкой восстановительной способностью диоксида серы при реализации процесса по схеме (8).
В современных процессах получения металлического никеля из окисленных руд и сульфидных концентратов образующуюся сульфидную фазу (штейн) подвергают окислительной обработке (кислородом) с целью дальнейшего обогащения. В условиях осуществления операции 1350–1400 ºС в системе сосуществуют две фазы – NiS и NiO, которые должны взаимодействовать между собой. Например, при конвертировании медных штейнов в аналогичной ситуации происходит восстановление меди [7, 8]:
Cu2S + 2Cu2O = 6Cu + SO2.(9)
Проанализирована возможность восстановления никеля в системе NiO – MeS с участием сульфидов никеля и железа в соответствии со следующими уравнениями реакций:
2NiO + NiS = 3Ni + SO2,(10)
4NiO + Ni3S2 = 7Ni + 2SO2,(11)
3NiO + FeS = 3Ni + FeO + SO2,(12)
Температура, К
Рис. 3. Зависимости ΔG (кДж/г-атом Ме) реакций восстановления никеля и кобальта (4)–(8) серосодержащими восстановителями от температуры (К)
5NiO + FeS2 = 5Ni + FeO + 2SO2,(13)
2NiO + 7NiS = 3Ni3S2 + SO2,(14)
9NiO + 7FeS = 3Ni3S2 + 7FeO + SO2,(15)
3,75NiO + 1,75FeS2 = 1,25Ni3S2 + 1,75FeO + SO2.(16)
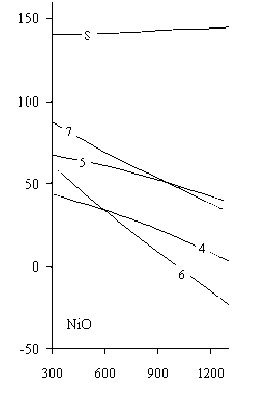
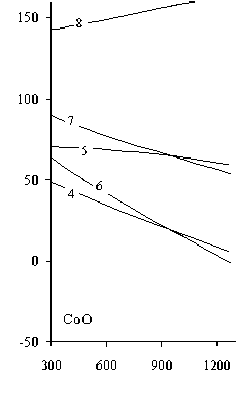
На рис. 4 приведены зависимости ∆G реакций восстановления никеля из его закиси сульфидами никеля и железа от температуры, свидетельствующие о том, что металлизация никеля с участием данных реагентов практически не происходит в исследуемом температурном интервале. Исключение составляет применение пирита, когда появляется возможность образования металлического никеля при температуре более 1150 К (13). Это можно объяснить диссоциацией пирита с образованием элементной серы, которая ответственна за металлизацию никеля в указанных температурных условиях.
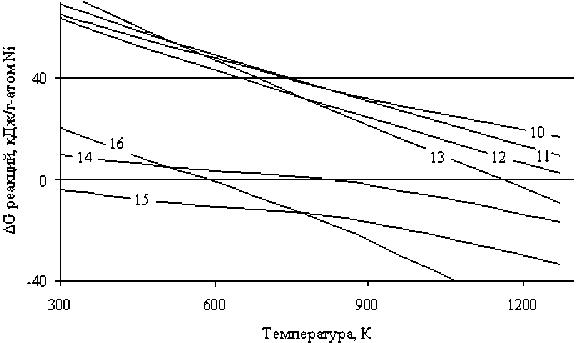
Рис. 4. Зависимости ∆G реакций восстановления никеля из закиси никеля серой сульфидов никеля и железа (10)–(16) от температуры
Термодинамическими расчетами подтвержден известный факт частичного восстановления никеля из его оксида сульфидами никеля и железа с образованием ассоциации Ni3S2 (Ni·2NiS). Это соединение образуется при участии всех исследуемых сульфидов, из которых наиболее эффективен FeS, обеспечивающий образование Ni3S2 начиная с температуры 298 К, далее пирит – при температуре более 500 К, и, наконец, NiS – около 850 К. В табл. 2 приведены зависимости ∆G реакций (10)–(16) от температуры.
Следует отметить, что термодинамическая устойчивость сульфидных соединений никеля и кобальта ниже, чем их кислородных аналогов, при незначительном влиянии вещественного состава (табл. 1 и 3).
Проанализирована вероятность восстановления металлов из сульфидов углеродсодержащими реагентами в предположении о реализации процессов в соответствии с уравнениями
MeS + C = Me + CS,
MeS + C = Me + CS2,
MeS + CO = Me + COS,
Таблица 2. Зависимости ∆G реакций (10)–(16) от температуры
|
№ реакции |
Уравнение AG = f(T) |
|
10 |
A G T = - 4 - 10 - 9T 3 + 2 - 10 - 5T2 - 0,0781T + 91,366 ; R2 = 1 |
|
11 |
A G T = 6 - 10 - 9T3 - 10 - 6T2 - 0,0612T + 83,51 ; R2 = 0,99 |
|
12 |
A G T = - 8 - 10 - 9T3 + 3 - 10 - 5T2 - 0,0854T + 86,939 ; R2 = 1 |
|
13 |
A G T =- 4 - 10 - 9T3 + 10 - 5T2 - 0,0981T + 102,38 ; R2 = 1 |
|
14 |
A G T =- 2 - 10 - 8T3 + 4 - 10 - 5T2 - 0,0395T + 18,71 ; R2 = 0,99 |
|
15 |
A G T =- 3 - 10 - 8T3 + 6 - 10 - 5T2 - 0,057T + 8,38 ; R2 = 0,99 |
|
16 |
A G T =- 2 - 10 - 8T3 + 3 - 10 - 5T2 - 0,0853T + 43,78 ; R2 = 0,99 |
Таблица 3. Значения ΔG образования исходных сульфидных соединений никеля и кобальта и ΔG реакций восстановления металлов углеродом и окисью углерода при 298 К
|
Соединение |
ΔG0 298,15 |
ΔG0298,15 реакций восстановления по схемам |
||||||||
|
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
||
|
NiS |
-103,67 |
313,49 |
118,53 |
53,49 |
--- |
--- |
--- |
--- |
--- |
--- |
|
NiS 2 |
-152,83 |
--- |
--- |
--- |
353,1 |
158,13 |
93,1 |
--- |
--- |
--- |
|
Ni3S2 |
-85,41 |
--- |
--- |
--- |
--- |
--- |
--- |
146,1 |
80,44 |
59,52 |
|
CoS |
-115,29 |
325,05 |
130,08 |
65,05 |
--- |
--- |
--- |
--- |
--- |
--- |
|
CoS 2 |
-173,72 |
--- |
--- |
--- |
373,91 |
178,94 |
113,91 |
--- |
--- |
--- |
MeS2 + C = Me + CS + Sº, (20) 2MeS2 + C = 2Me + CS2 + 2Sº, (21) MeS2 + CO =Me + COS + Sº, (22) Me3S2 + 2C = 3Me + 2CS + Sº, (23) Me3S2 + C = 3Me + CS2 + Sº, (24)
Me3S2 + 2CO = 3Me + 2COS + Sº. (25)
Как следует из табл. 3, углерод и моноокись углерода не могут обеспечить восстановление металлов при температуре 298 К. Нами сделано предположение о том, что последнее обусловлено трудностями образования углеродсодержащих продуктов восстановительных процессов. Выполнены расчеты ∆G0 образования карбонилсульфида, дисульфида и моносульфида углерода в интервале температур 298 – 1273 К (рис. 5), которые позволили заключить, что моносульфид углерода не образуется при температуре ниже 1173 К, дисульфид углерода может образоваться при температуре выше 500 К; в свою очередь, образование карбонилсульфида вероятно в исследуемом температурном интервале. Термодинамический анализ восстановления никеля и кобальта из их сульфидов углеродными восстановителями в интервале температур 298–1273 К позволил cделать заключение о невозможности протекания восстановительных реакций по схемам (17)–(25) с участием как углерода, так и его моноокиси.
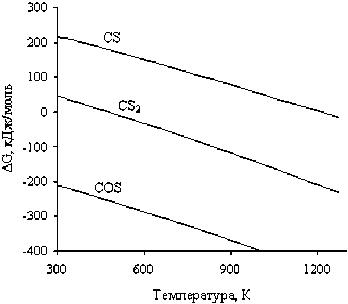
Рис. 5. Зависимости ∆G образования продуктов реакций (4)–(12) от температуры
В работах [9–14] нами предложено осуществление процесса прямого восстановления тяжелых цветных металлов из сульфидных соединений с использованием в качестве восстановителя собственной сульфидной серы. Однако термодинамические расчеты показывают, что восстановление никеля и кобальта непосредственно из сульфидов с использованием электронодонорных свойств собственной сульфидной серы не является вероятным. Величины ΔG0298,15 для реакций
NiS = Ni + S, (26)
CoS = Co + S, (27)
составляют 85,22 и 96,78 кДж/моль, соответственно, при незначительном влиянии температуры на их изменение (при температуре 1273 К – 70,3 и 80,97 кДж/моль).
Нами было высказано предположение о решающей роли среды, в которой происходят окислительно-восстановительные реакции (26) и (27), определяющим свойством которой служит способность эффективного связывания (ассимиляции) продукта окисления сульфидной серы – в данном случае серы элементной [9, 10]. В результате в качестве реакционной среды для таких превращений предложена щелочь, обладающая как сольватационной, так и реакционной способностью по отношению к ряду серосодержащих соединений, в том числе элементной сере и индифферентной по отношению к вновь образующейся металлической фазе.
Как указывалось в [10–12], в щелочной среде элементная сера диспропорционирует с накапливанием соответствующих продуктов – сульфидов, тиосульфатов, сульфитов и сульфатов натрия. Из термодинамического анализа следует, что вероятность различных вариантов диспропорционирования очевидна, однако наиболее предпочтителен вариант с получением в качестве продуктов сульфидной и сульфатной серы [12–14]. Процесс описывается уравнением
2NaOH + S = 0,75Na2S + 0,25Na2SO4 + H2O. (28)
ΔG реакции (28) при температурах 298 и 1273 К составляет –58,4 и –124,4 кДж/моль, соответственно.
Химизм восстановления никеля и кобальта из сульфидов собственной сульфидной серой в щелочной среде описывается уравнениями:
NiS + 2NaOH = Ni + 0,75 Na2S + 0,25Na2SO4 + H2O, (29)
NiS2 + 4NaOH = Ni + 1,5Na2S + 0,5Na2SO4 + 2H2O, (30)
2Ni3S2 + 8NaOH = 6Ni + 3Na2S + Na2SO4 + 4H2O, (31) CoS + 2NaOH = Co + 0,75Na2S + 0,25Na2SO4 + H2O, (32) CoS2 + 4NaOH = Co + 1,5Na2S + 0,5Na2SO4 + 2H2O. (33)
В результате термодинамических расчетов получены зависимости ∆G восстановления от температуры, приведенные на рис. 6. В табл. 4 даны математические зависимости ∆G = f(T) для рассматриваемых процессов.
Таблица 4. Уравнения зависимостей ∆G реакций (29)–(33) от температуры
|
№ реакции |
Уравнение AG = f(T) |
|
29 |
A G T = - 8 - 10 - 8T 3 + 3 - 10 - 4 T 2 - 0,2911T + 98,939 ; R2 = 0,99 |
|
30 |
A G T = - 2 - 10 - 7T3 + 5 - 10 - 4T2 - 0,5636T + 149,2 ; R2 = 0,99 |
|
31 |
A G T =- 3 - 10 - 8T3 + 10 - 4T2 - 0,1804T + 77,187 ; R2 = 0,99 |
|
32 |
A G T =- 8 - 10 - 8T3 + 2 - 10 - 4T2 - 0,2783T + 107,37 ; R2 = 0,99 |
|
33 |
A G T =- 2 - 10 - 7T3 + 5 - 10 - 4T2 - 0,5697T + 171,46 ; R2 = 0,99 |
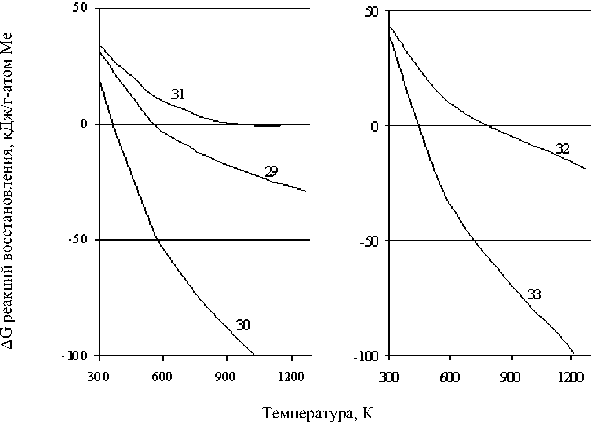
Рис. 6. Зависимости ΔG (кДж/г-атом Ме) реакций восстановления никеля и кобальта (29)–(33) в щелочной среде от температуры (К)
Из рис. 6 следует, что вероятность восстановления возрастает с увеличением содержания серы в составе исходного соединения. В случае восстановления никеля из дисульфида процесс вероятен уже при температуре более 350 К, из моносульфида – более 570 К, а из Ni3S2 – более 970 К. В случае восстановления кобальта образование металлической фазы возможно из дисульфида при температуре более 460 К, а из моносульфида – более 860 К.
Выводы
-
1. Рассмотрены термодинамические закономерности восстановления никеля и кобальта из кислородных и сульфидных соединений с использованием углерод- и серосодержащих восстановителей в температурном интервале 298–1273 К.
-
2. Подтверждена восстановительная способность элементной серы по отношению к никелю и кобальту в оксидах.
-
3. Подтверждена термодинамическая вероятность восстановления никеля из оксидов серой сульфидов никеля и железа с образованием, в конечном счете, соединения Ni3S2.
-
4. Доказана термодинамическая вероятность восстановления никеля и кобальта непосредственно из сульфидов собственной сульфидной серой в условиях эффективного связывания продукта ее окисления – элементной серы в щелочной среде.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ.


