Термодинамика восстановления железа из кислородных и сульфидных соединений
Автор: Чекушин Владимир С., Олейникова Наталья В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 2 т.1, 2008 года.
Бесплатный доступ
В статье представлены результаты термодинамической оценки возможности восстановления железа из кислородных и сульфидных соединений посредством различных восстановителей, в том числе содержащих серу с различной степенью окисления. Установлено, что наиболее предпочтительный восстановитель железа из оксидов - моноокись углерода. Из серосодержащих восстановителей наиболее активна элементарная сера, однако металлизация возможна при температуре выше 1000 °C. Предложено несколько вариантов взаимодействия сульфидов железа, пирита и пирротинов со щелочью для получения металлического железа, его гидроксидов и оксидов.
Восстановление железа, кислородные и сульфидные соединения, углеродсодержащие и серосодержащие восстановители
Короткий адрес: https://sciup.org/146114457
IDR: 146114457 | УДК: 669.017:536
Текст научной статьи Термодинамика восстановления железа из кислородных и сульфидных соединений
Природное сырье для производства тяжелых цветных металлов (меди, никеля, кобальта, свинца, а также золота и серебра) представлено кислородными и серосодержащими минеральными формами, характеризующимися высоким содержанием многообразных соединений железа. Обогатительные и металлургические процессы, связанные, в конечном счете, с получением металлических фаз меди, никеля, кобальта, свинца, имеют своей целью последовательное выделение в отвальные или шлаковые продукты железосодержащих составляющих руд и концентратов, обеспечивая тем самым повышение содержания в промпродуктах целевого или целевых извлекаемых компонентов [1, 2]. В этой связи поведение исходных оксидных и сульфидных железоминеральных форм в металлургических, прежде всего в восстановительных, процессах, связанных с металлизацией целевых компонентов, представляется весьма важным с точки зрения количественного выхода материальных масс финишных продуктов, а также организации технологии рафинирования извлекаемого металла.
К основным природным кислородным соединениям железа относятся вюстит, гематит, магнетит, сидерит, фаялит и др. [3]. В свою очередь, к наиболее распространенным сульфидным минералам относятся пирит, пирротины [4]. Все указанные соединения отличаются различной химической активностью, в том числе к участию в восстановительных процессах.
В нашей работе приводятся результаты термодинамических исследований восстановления железа из соединений различного вещественного состава с использованием как общеизвестных углеродсодержащих, так и «нетрадиционных» серосодержащих восстановителей. Термодинамические расчеты выполнены по методике, отраженной в работе [4] и реализованной в собственной программе, с использованием банка данных в [4–6]. Подтверждением надежности используемой методики являются данные, приведенные в [7].
В табл. 1 можно увидеть данные о стандартных значениях изменения энергии Гиббса образования кислородных и сульфидных соединений железа, а также ΔG0298 реакций восстановления металла из кислородных и сульфидных соединений углеродом и моноокисью углерода. Химическая активность кислородных соединений железа увеличивается в ряду: FeO·SiO2→2FeO·SiO2→ Fe2O3→Fe3O4→FeO, а для сульфидов – в ряду: FeS2→Fe2S3→Fe7S8→FeS. В свою очередь, вероятность восстановления железа из кислородных соединений моноокисью углерода при температуре 298 К увеличивается в последовательности: 2FeO·SiO2→ Fe3O4→ FeO→Fe2O3 →FeO·SiO2. Последнее свидетельствует об отсутствии корреляции между величиной химической активности исходных соединений, участвующих в восстановлении железа, и вероятностью осуществления восстановления металла. Аналогично кислородным соединениям, отсутствует связь между указанными характеристиками у сульфидных соединений железа (табл. 1).
В табл. 2 приведены данные о ∆ G восстановления железа из соответствующих оксидов углеродом и моноокисью углерода в интервале температур 298–1273 К. Из таблицы следует, что моноокись углерода является более предпочтительным восстановителем железа, чем твердый углерод. При этом вероятность восстановления железа из гематита углеродом возможна при температуре 970 К и выше. В свою очередь, магнетит и вюстит активно участвуют в восстановительном процессе начиная с температуры 1070 К. Зависимости ∆ G восстановления железа из FeO, Fe2O3 и Fe3O4 углеродом и моноокисью углерода в указанном интервале температур приведены на рис. 1 и описываются следующими уравнениями (табл. 3).
Таблица 1. ∆ G0298 образования кислородных и сульфидных соединений железа, а также восстановления железа углеродом и моноокисью углерода, кДж/г-атом Fe
|
Соединение |
∆G 0 298 образования [4–6] |
Восстановитель |
|
|
Углерод |
Моноокись углерода |
||
|
FeO |
-284,44 |
108,55 |
-11,46 |
|
Fe2O3 |
-424,53 |
164,75 |
-15,25 |
|
Fe3O4 |
-387,32 |
155,17 |
-4,8 |
|
FeO*SiO2 |
-1180,86 |
81,74 |
-38,26 |
|
2FeO*SiO2 |
-762,07 |
124,56 |
4,56 |
|
FeS |
-119,56 |
330,23 |
70,23 |
|
FeS2 |
-186,08 |
615,37 |
95,37 |
|
Fe 2 S 3 |
-162,71 |
482,64 |
92,63 |
|
Fe 7 S 8 |
-125,89 |
367,87 |
70,69 |
Таблица 2. Изменения энергии Гиббса ( ∆ G 0 ) реакций восстановления железа из кислородных соединений, кДж/г-атом Fe
|
Температура, К |
Восстановитель |
|||||
|
Углерод |
Моноокись углерода |
|||||
|
FeO |
Fe 2 O 3 |
Fe 3 O 4 |
FeO |
Fe 2 O 3 |
Fe 3 O 4 |
|
|
298,15 |
108,55 |
164,75 |
155,17 |
-11,46 |
-15,25 |
-4,79 |
|
373,15 |
96,47 |
144,39 |
137,60 |
-10,26 |
-15,70 |
-4,66 |
|
473,15 |
80,52 |
117,35 |
114,34 |
-8,34 |
-15,94 |
-4,11 |
|
573,15 |
64,75 |
90,55 |
91,33 |
-6,20 |
-15,88 |
-3,25 |
|
673,15 |
49,15 |
64,03 |
68,63 |
-3,94 |
-15,59 |
-2,13 |
|
773,15 |
33,67 |
37,79 |
46,28 |
-1,63 |
-15,15 |
-0,77 |
|
873,15 |
18,28 |
11,82 |
24,32 |
0,69 |
-14,56 |
0,88 |
|
973,15 |
2,92 |
-13,90 |
2,61 |
2,94 |
-13,88 |
2,63 |
|
1073,15 |
-12,47 |
-39,52 |
-19,06 |
5,05 |
-13,23 |
4,30 |
|
1173,15 |
-27,88 |
-65,09 |
-40,71 |
7,07 |
-12,68 |
5,87 |
|
1273,15 |
-43,28 |
-90,63 |
-62,34 |
8,99 |
-12,23 |
7,34 |
Таблица 3. Зависимости ∆ G восстановления железа из FeO, Fe2O3 и Fe3O4 углеродом и моноокисью углерода
|
Соединение |
Восстановитель |
|||
|
Углерод |
Моноокись углерода |
|||
|
Уравнение |
R2 |
Уравнение |
R2 |
|
|
FeO |
∆GT = –0,153T + 152,3 |
0,99 |
∆GT = 0,022T – 18,2 |
0,99 |
|
Fe2O3 |
∆GT = –0,258T + 238,5 |
0,99 |
∆GT = 0,0036T – 17,3 |
0,8 |
|
Fe 3 O 4 |
∆GT = –0,219T + 217,1 |
0,99 |
∆GT = 0,013T – 9,91 |
0,97 |
Следует отметить, что наши расчетные данные о ∆ G восстановления железа из вюстита и магнетита моноокисью углерода при температуре 298 К находятся в удовлетворительном согласии с величинами, приведенными в работе [8].
Высокая вероятность восстановления железа моноокисью углерода подтверждается экспериментальными исследованиями различных авторов [3], а также практикой осуществления металлургических процессов, в том числе переработки окисленных никелевых руд, когда продуктом восстановительного процесса является железо-никелевый сплав – ферроникель [9]. При этом содержания железа и никеля в указанном сплаве могут изменяться в широких пределах.
Помимо углерода (при температурах более 1073 К), отмечается высокая восстановительная способность по отношению к железу водорода [10] и производных углеводородов. Важное значение имеет использование в качестве восстановителя элементарного кремния [9].
Особый интерес представляет исследование возможности восстановления железа из его оксидов (FeO, Fe2O3, Fe3O4) серосодержащими реагентами. В качестве восстановителей рассматривали серу в различных степенях окисления: (-2, 0, +4). При этом сульфидная сера представлена соединениями FeS и H2S; смесь сульфидной и элементной серы – пиритом (FeS2), и, наконец,
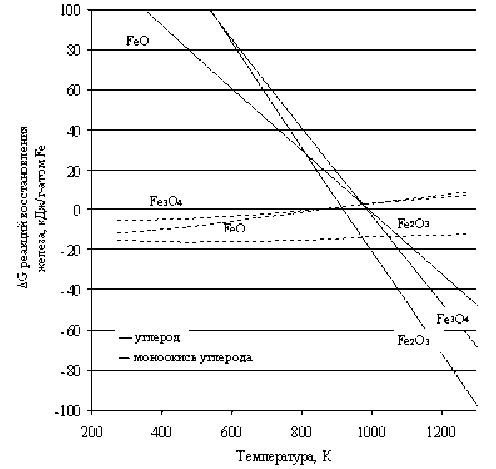
Рис. 1. Зависимости изменений энергии Гиббса реакций восстановления железа углеродом и его моноокисью от температуры
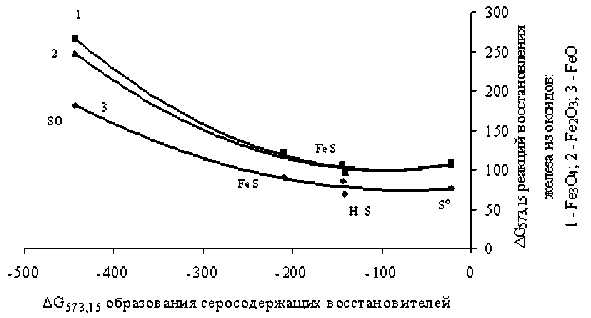
Рис. 2. Зависимость ΔG реакций восстановления железа из кислородных соединений серосодержащими восстановителями от ΔGТ образования восстановителей сера в состоянии окисления +4 – моноокисью SO2. На рис. 2 приведены зависимости ΔG реакций восстановления оксидов железа (при температуре 573 К) от ΔG образования серосодержащих восстановителей при данной температуре. Как следует из графиков, имеет место симбатное увеличение вероятности восстановления с увеличением химической активности серосодержащего восстановителя. Однако при данной температуре (573 К) отсутствует вероятность протекания восстановительных реакций с участием данных реагентов. Как следует из рис. 3, повышение температуры более чем до 573 К способствует некоторому ослаблению ΔG реакций. Однако можно заключить, что сероводород, сера и сульфиды железа не представляются перспективными реагентами-восстановителями в условиях температур, достигающих 1500 К.
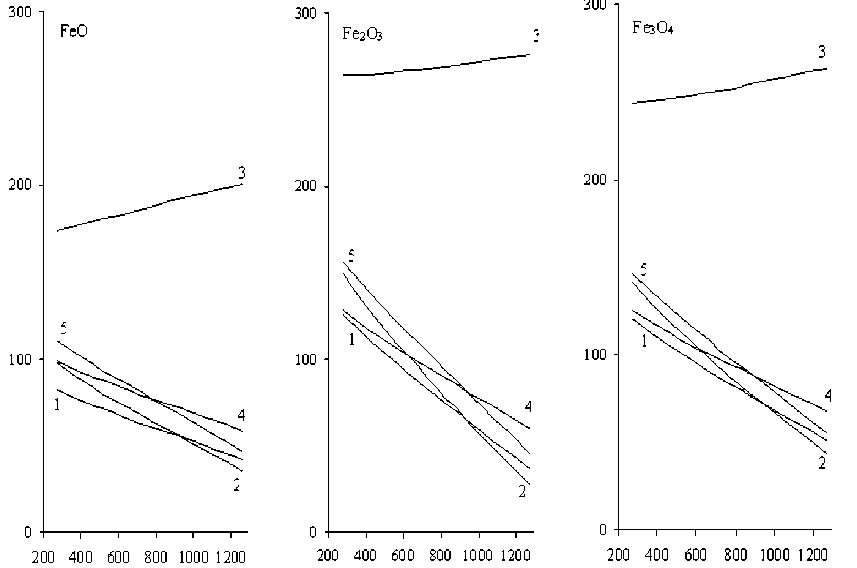
Восстановители: 1 – H2S; 2 – Sº; 3 – SO2; 4 – FeS; 5 – FeS2
Рис. 3. Зависимости изменений энергии Гиббса (кДж/г-атом Fe) реакций восстановления железа из его оксидов серой в различных степенях окисления от температуры
Несомненный интерес представляют исследования, связанные с восстановлением железа непосредственно из сульфидных соединений с использованием в качестве восстановителей углерода, производных углеводородов, водорода. По данным различных авторов, железо лишь частично может восстанавливаться из сульфидов в атмосфере водорода при температуре 950 °С. По данным [11], в указанных условиях из пирротина может восстановиться не более 70 % железа. Однако следует отметить, что процесс очень растянут во времени и не завершается полным восстановлением металла. Практически все исследователи отмечают тот факт, что наиболее заметным процесс восстановления становится в присутствии в системе металлического никеля, который связывается с восстановившимся железом с образованием ферроникеля [11, 12]. Осуществление восстановительного процесса в атмосфере СО [11] и производных углеводородов [13] к металлизации не приводит.
В соответствии с работами [14, 7] нами исследована возможность прямого восстановления железа из сульфидных соединений собственной сульфидной серой, когда в качестве исследуемых соединений выступали FeS и FeS2:
FeS→Fe + S, (1)
FeS2→Fe + 2S. (2)
Для FeS ΔG восстановления железа по реакции (1) составляет 102–104 кДж/г-атом Fe в интервале температур 298–1273 К. В свою очередь, восстановление железа из пирита, в соот- ветствии с уравнением (2), в исследуемом температурном интервале также маловероятно. При температуре 1273 К ΔG восстановления составляет около 90 кДж/г-атом Fe.
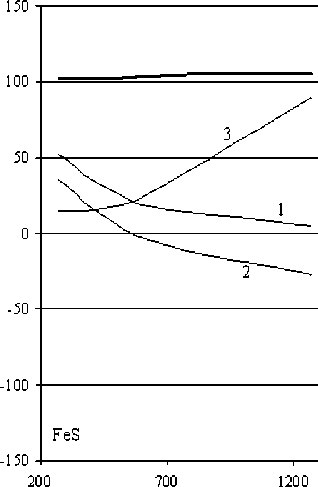
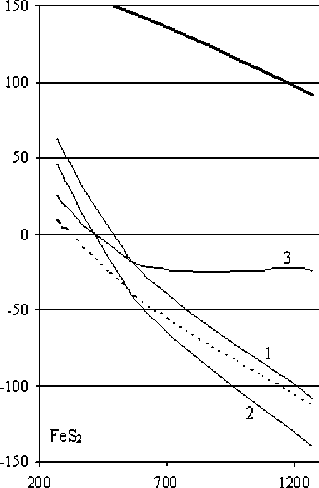
Высказанное нами предположение о том, что восстановительный процесс с участием в качестве реагента собственной сульфидной серы может быть реализован в соответствующей среде [15], обеспечивающей связывание или конверсию элементной серы, привело к необходимости изучения металлизации железа из сульфидных соединений в щелочной среде. Как следует из рис. 4б (кривая 1), восстановление железа из пирита сульфидной серой должно протекать весьма энергично начиная с температуры 550 К. В свою очередь, восстановление металла из соединения FeS (рис. 4а, кривая 1) возможно в условиях температур более 1300 К.
Процессы взаимодействий сульфидов железа со щелочью можно представить как восстановление металла собственной сульфидной серой, сопровождающееся образованием элементной серы с параллельным ее диспропорционированием и получением сульфида и сульфата натрия (схема 1, реакции (3) и (4), рис. 4а, 4б, кривые 1). Можно также предположить, что реакции взаимодействия указанных сульфидов со щелочью могут завершаться образованием гидроксидов (схема 2, реакции (5) и (6), рис. 4а, 4б, кривые 3) и оксидов (схема 3, реакции (7) и (8), рис. 4а, 4б, кривые 2) металла.
Схема 1
FeS + 2NaOH = Fe + 0,75Na2S + 0,25Na2SO4 + H2O. (3)
FeS2 + 4NaOH = Fe + 1,5Na2S + 0,5Na2SO4 + 2H2O. (4)
а б
Рис. 4. Зависимость ΔG (кДж/г-атом Fe) реакций восстановления железа из сульфидов в щелочной среде от температуры. Жирной чертой выделены зависимости ΔG реакций (1) – а и (2) – б: 1 – получение металлического железа, 2 – получение оксида железа; 3 – получение гидроксида железа
Таблица 4. ∆ G 0 реакций взаимодействия сульфидов железа со щелочью, кДж/г-атом Fe
|
Реакция |
Температура, К |
|||||||
|
298 |
373 |
573 |
673 |
773 |
973 |
1173 |
1273 |
|
|
FeS+2NaOH=Fe+0,75Na2S+0,25Na2SO4+H2O |
49,2 |
39,2 |
20,5 |
16,7 |
14,2 |
10,5 |
7,19 |
4,8 |
|
FeS+2NaOH=FeO+Na2S+H2O |
32,3 |
20,9 |
-1,8 |
-7,3 |
-11,5 |
-18,3 |
-23,9 |
-26,9 |
|
FeS+2NaOH= Fe(OH)2+Na2S |
15,2 |
15,1 |
21,6 |
30,3 |
39,8 |
59,8 |
80,0 |
89,7 |
|
FeS2+4NaOH=Fe+1,5Na2S+0,5Na2SO4+2H2O |
53,3 |
30,0 |
-20,7 |
-36,3 |
-49,6 |
-73,5 |
-96,2 |
-108,9 |
|
FeS2+4NaOH=FeO+1,75Na2S+0,25Na2SO4+2H2O |
36,4 |
11,7 |
-43,0 |
-60,3 |
-75,3 |
-102,4 |
-127,4 |
-140,6 |
|
FeS2+4NaOH=Fe(OH)2+1,75Na2S+0,25Na2SO4+H2O |
19,3 |
5,9 |
-19,6 |
-22,7 |
-23,9 |
-24,2 |
-23,4 |
-24,0 |
Схема 2
FeS + 2NaOH = Fe(OH)2 + Na2S.(5)
FeS2 + 4NaOH = Fe(OH)2 + 1,75Na2S + 0,25Na2SO4 + H2O.(6)
Схема 3
FeS + 2NaOH = FeO + Na2S +H2O.(7)
FeS2 + 4NaOH = FeO + 1,75Na2S + 0,25Na2SO4 + 2H2O.(8)
Из термодинамических расчетов (табл. 4) следует, что при обменном взаимодействии со щелочью пирротина наиболее вероятно образование оксида железа, а для пирита – всех трех предполагаемых веществ с преимущественной вероятностью образования оксида. В ходе осуществления экспериментальной проверки вероятности образования различных форм железа при взаимодействии его сульфидов со щелочью установлено, что металлического железа не образуется. Было высказано предположение о том, что первой стадией взаимодействия пирита со щелочью является его диссоциация с образованием пирротина и серы, которая диспропорцио-нирует в щелочной среде.
При изучении вопросов взаимодействия минералов железа, преимущественно пирротина и пирита, присутствующих в различных типах золоторудного сырья со щелочью, нами установлено, что металлическое железо не накапливается в качестве продукта реакций. В основном образуются гидроксиды и, реже, оксиды железа. В свою очередь, при контакте со щелочью в условиях температур 500–650 °С материалов, содержащих сульфидные соединения меди, никеля и железа, когда концентрационные соотношения никель – железо составляют 1,5–15, образуются никелево-железные сплавы различного состава.
Выводы
-
1. Термодинамическими расчетами реакций восстановления железа из кислородных и сульфидных соединений углеродом и СО установлено отсутствие корреляции между величинами химических активностей исходных соединений металла и вероятностью осуществления восстановительных процессов.
-
2. Наиболее предпочтительным восстановителем железа из оксидов является моноокись углерода, а из сульфидных – элементная сера. Однако осуществление восстановительных реакций возможно в условиях температур более 1000 °С.
-
3. Рассмотрены варианты реакций взаимодействия сульфидов железа со щелочью. Установлено, что в щелочной среде имеет место вероятность восстановления железа из пирита. Из экспериментальных данных следует, что в присутствии металлического никеля процесс металлизации железа завершается образованием ферроникеля.


