Термохимический реактор восстановительных атмосфер с окислением части продуктов паровой конверсии метана
Автор: Дубинин Алексей Михайлович, Черепанова Екатерина Владимировна, Тупоногов Владимир Геннадьевич, Грицук Светлана Александровна, Емельянова Анастасия Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Энергетика @vestnik-susu-power
Рубрика: Теплоэнергетика
Статья в выпуске: 1 т.18, 2018 года.
Бесплатный доступ
Разработана конструкция термохимического реактора для бескислородной паровой конверсии метана с частичным окислением продуктов конверсии с целью обеспечения автотермичности процесса. Реактор разделен на нижнюю зону слоя с каталитической насадкой, в которой происходит конверсия метана, и верхнюю, где организован отвод из реактора части продуктов конверсии и окисление оставшейся части для обеспечения необходимой температуры слоя. Представлены результаты экспериментальных исследований реактора, включающие определение вертикальной эффективной теплопроводности псевдоожиженного слоя электрокорунда, заторможенного алюмо-никелевой каталитической насадкой КСН-2, температуры и состава продуктов конверсии. Разработана стационарная одномерная модель паровой конверсии метана в однородном псевдоожиженном слое, заторможенном каталитической насадкой. Расчетный и экспериментальный составы продуктов конверсии метана при соотношении CH4:H2O=1:1 и температуре на выходе из слоя около 1000 °С удовлетворительно совпадают. Продукты конверсии могут применяться в качестве восстановительных атмосфер, например, при переделе железорудного сырья.
Метан, водяной пар, псевдоожиженный слой, электрокорунд, катализатор, распределение температуры в слое, эффективная теплопроводность слоя
Короткий адрес: https://sciup.org/147232661
IDR: 147232661 | УДК: 621.785.062 | DOI: 10.14529/power180102
Текст научной статьи Термохимический реактор восстановительных атмосфер с окислением части продуктов паровой конверсии метана
Восстановительные газы получают в крупнотоннажных реакторах шахтного типа, производя конверсию природного газа (метана) водяным паром, добавляя кислород к исходной смеси, который расходуется на полное окисление определенной части метана, что позволяет осуществлять процесс авто-термично, без подвода теплоты извне [1, с. 23, 27]. Однако добавление кислорода к исходной смеси не только приводит к существенному удорожанию получаемого газа, но и ухудшает его состав продуктами полного сгорания метана, что требует для восстановительных процессов очистки газа от CO2 и H2O дорогостоящими способами. Добавление к исходной смеси CH4: H2O = 1:1 кислорода в количестве 0,6 объема на один объем исходного метана, как требуют условия теплового баланса автотермического процесса для поддержания в реакционном объеме температуры 1000 °C, снижает восстановительный потенциал (H2 + CO)/(CO2 + H2O) в 20 раз. Содержание окисляющих компонентов (CO2 + H2O) > 10 % и CH4 >5 % в горячем газе не позволяет использовать его для прямого восстановления железорудных окатышей. Осушка газа охлаждением в скрубберах несколько улучшает состав атмосферы, но требует дополнительной затраты теплоты на его последующий подогрев до 1000 °C перед вводом в агрегат для восстановления железорудных окатышей. Энергоэффективные аппараты для конверсии метана предложены в [2, 3] и проходят исследовательскую стадию.
В работе [4] разработана достаточно сложная конструкция реактора с горячими байпасами и двумя слоями крупнокускового катализатора, что позволяет обеспечить наибольший выход водорода на единицу сырья.
Для увеличения температуры на катализаторе в реторте трубчатой печи предлагается использовать несколько последовательно чередующихся слоев ингибитор-катализатор [5]. При понижении температуры на катализаторе до уровня, при котором возможно выпадение сажи, конверсия прерывается, а неравновесные продукты поступают выше для нагрева в слой ингибитора. Чередование слоев позволяет предотвратить выпадение сажи и разрушение катализатора.
Для выравнивания температуры в объеме реактора предлагается [6] применение гидродинамической интенсификации газового потока, например, в режиме псевдоожижения гранул катализатора, что требует существенного усложнения конструкции реактора.
В работе [7] значения максимальной степени конверсии метана дымовыми газами, полученные теоретически, подтверждаются экспериментальными значениями.
Для построения кинетической модели предлагается [8, 9] механизм реакции паровой конверсии метана, состоящий из одиннадцати стадий. Мольное отношение H2O/CH4 равно двум. Построенная модель адекватно отображает экспериментальные данные.
Скорость подъема пузырей в кипящем слое, размещенном над каталитической насадкой, рассчитывается по методике [10]. Она зависит от рабочей, минимальной скорости псевдоожижения и избыточной порозности псевдоожиженного слоя для прохода пузырей. Пузыри играют определяющую роль в процессе окисления части продуктов конверсии воздухом для увеличения температуры в слое.
В публикации [11] предлагается процесс низкотемпературного производства водорода с одновременным уменьшением выхода диоксида углерода. Представлена экспериментальная установка. В работе [12] моделируется процесс парокислородной конверсии метана, который сравнивается с паровой конверсией метана. Делается вывод о меньшем расходе метана на единицу продукции.
Паровая конверсия метана при отношении CH4:H2O=1:1 рассматривается в работе [13]. Показано, что наибольший выход Н2 получается в адиабатном реакторе. Приведены испытания паровой конверсии метана, полученного из биомассы, с целью производства синтез-газа с высокой теплотой сгорания [14].
В данной публикации исследуется работа реактора с псевдоожиженным слоем упрощенной конструкции, в котором за счет особенностей псевдоожиженного слоя: интенсивного перемешивания твердой фазы и менее интенсивного перемешивания газа, – осуществляется процесс автотермической паровой конверсии метана [15].
Экспериментальные исследования на модели реактора
В разработанной конструкции реактора процессы конверсии и частичное окисление продуктов происходят позонно в реторте реактора, как показано на рис. 1 экспериментальной модели реактора. В реторте 17 с внутренним диаметром 0,18 м помещена кассета из катализатора 5 КСН-2 высотой 0,7 м, в межкусковых объемах которой циркулируют частицы мелкодисперсного электрокорунда размером 0,32 мм, являющегося промежуточным теплоносителем. В псевдоожиженный над насадкой слой частиц 7 погружена фурма, состоящая из трубы 9 диаметром 82 мм, «рубашки» 10 с перфорациями 8. Под газораспределительную решётку 2 подводится водяной пар с метаном. Часть х = 0,25 продуктов конверсии, образующихся в катализаторе в результате стехиометрической эндотермической реакции
^i
CH4 + H2O — CO + 3H2, (1) отводится по трубе 9 для использования, а другая часть (1 — х) = 0,75 расходуется на окисление воздухом с целью обеспечения теплотой реакции конверсии метана, подогрев продуктов этой же реакции и тепловые потери. Теплота переносится в объем каталитической насадки разогретыми частицами мелкодисперсного материала. Воздух для протекания экзотермической реакции окисления части (1 — х) продуктов паровой конверсии метана, описываемой стехиометрическим уравнением
CO + 3H2 + 2(O2 + 3,76N2) =
= CO2 + 3H2O + 7,52N2, (2) подводится через перфорации 8 . Продукты окисления отводятся из реактора через камеру 11 . С целью предотвращения загрязнения продуктов конверсии метана продуктами из камеры окисления части синтез-газа нисходящим потоком газа (CO2, H2O и N2) [16, с. 221], расстояние между отверстиями для выхода воздуха 8 (см. рис. 1) и нижним торцом трубы 9 для отвода продуктов паровой конверсии метана принималось 300 мм [17, с. 20].
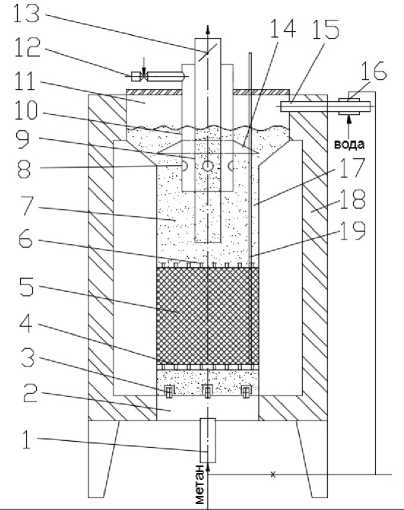
Рис. 1. Схема экспериментального термохимического реактора: 1 – штуцер для ввода парометановой смеси; 2 – газораспределительная беспровальная камера; 3 – беспровальные колпачки; 4 – решетка; 5 – каталитическая насадка КСН-2; 6 – решетка; 7 – псевдоожиженный слой; 8 – перфорации; 9 – внутренняя труба для отвода продуктов паровой конверсии метана; 10 – рубашка; 11 – сборная камера; 12 – штуцер для ввода воздуха; 13 – клапан; 14 – усеченный конус; 15 – штуцер для отвода продуктов сгорания; 16 – теплообменник; 17 – реторта; 18 – тепловая изоляция;
19 – чехол для термопары
Водяной пар получается в теплообменнике 16 или поступает от другого источника. Усеченный конус 14 способствует лучшему перемешиванию продуктов конверсии с воздухом и, как следствие, более полному окислению [18]. Для замера температуры по высоте катализатора использован чехол 19 из тонкостенной легированной трубки, заваренной с нижнего торца, внутри которого перемещалась Х-A термопара (погрешность измерений – 1,5 %). Клапан 13 предназначен для перераспределения долей х и (1-х) между камерами в процессе эксперимента. Расход природного газа с Qh = 35 590 кДж/м3 (объем воздуха и продуктов сгорания при а _ 1: vh = 9,44; vh Г = 10,59 м3/м3) равнялся 3,5 м3/ч, водяного пара - 2,8 кг/ч, воздуха -30 м3/ч. Расходы воздуха и природного газа определялись по ротаметру с относительной погрешностью 2,5 %, водяного пара – дроссельной шайбой с погрешностью 3 %. Соотношение объемных расходов H2O: CH4 = 1:1 на входе в реактор контро- лировалось по составу продуктов конверсии на выходе трубы 9 по балансовому выражению
Гп+гсо+2гсо а = -, гм+гсо+гсо2
а сажевыделение, моль С/моль М, – по составу продуктов паровой конверсии метана из баланса по углероду:
д С _ ^—г н^ +г со +г со^ +г м ) l-r H? .
Состав продуктов конверсии и окисления
многократно определялся на хроматографе с погрешностью 4 %. Влажность продуктов конверсии определяли измерителем влажности по температуре точки росы.
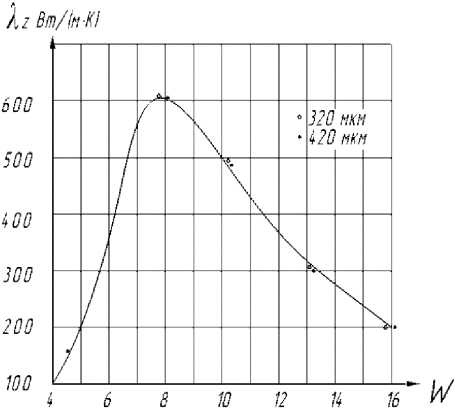
Рис. 2. Зависимость вертикальной составляющей коэффициента теплопроводности заторможенного катализатором КСН-2 псевдоожиженного слоя от числа псевдоожижения. 320 мкм и 420 мкм – размеры частиц электрокорунда
Экспериментальное поле температуры, представленное на рис. 2, показывает существенную неравномерность температуры по высоте катализатора: на нижнем торце камеры с катализатором – 575 °C, а на верхнем – 1000 °C. Полученные в экспериментах продукты паровой конверсии метана на выходе имели следующий состав:
Гп _ 1,76; гС02 _ 1,398; Гн? _ 72,043;
гм _ 2,449; гсо _ 22,35 (% объёмные), а продукты сгорания:
Гсо2 _ 7,8; Го2 _ 0,26; г^ _ 64,24;
гп _ 25,7; гсо _ 2,0 (% объёмные).
Химический недожог q3 составлял 7 %. Восстановительный потенциал
( Гн2 + Гсо )/( Г п + Гсо2 ) _
_ (72,043 + 22,35)/(1,76 + 1,398) _ 29,9;
гм < 5 %; гС02 + гп _ 3,158 < 10 %.
Такой газ можно использовать в качестве восстановительной атмосферы.
Моделирование реактора
Процесс паровой конверсии метана по реакции (1) сопровождается прямой _ к
CO + H2O + 3H2 - CO2 + 4H2
и обратной реакцией водяного газа
к
CO2+4H2-CO + H2O + 3H2, где K2 и K3 - константы скоростей соответствующих реакций. Поэтому в равновесных продуктах паровой конверсии метана при отношении CH4:H2O_ 1:1 всегда присутствует диоксид углерода от 7 % при температуре 500 °C до 0,1 % при 1000 °C [19].
Эндотермический эффект реакции (1) qzl _ _ 12 912 кДж на 1 кг метана, поступившего в реакцию. Теплота, необходимая для протекания ре- акции и компенсации тепловых потерь, выделяется при окислении в кольцевом зазоре между ретортой 17 и «рубашкой» 10 части (1 — х) продуктов конверсии в потоке воздуха, выходящего из перфораций 8 по реакции (2) с экзотермическим эффектом qx2 _ 63 056 кДж на 1 кг метана, поданного в реакцию (1), и переносится в объем каталитической насадки посредством эффективного коэффициента теплопроводности Az Вт/(м^К).
При полном перемешивании мелкодисперсных частиц по сечению реторты стационарную задачу о распределении температуры и концентрации метана вдоль оси z в каталитической насадке можно считать одномерной и описать следующей системой нелинейных уравнений:
d2t
Яz ^z? _ 9xl • Kl • 5 • Гм • Рм • Е +
+т • Спк • CnK(t) ^z;
г м dw + w dr M _ —К5Г , е dz е dz
где плотность метана
Рм _ РМ н.у -273 • Р/(273 + t)Po скорость продуктов конверсии w _ ^пк/рПК;
плотность продуктов конверсии
Р пк = Р . (1 ■ -Р. ■••"■• ... ; ■ (7)
константа скорости реакции (1)
Ki = 87,5 exp[—65 500/(8,31Г)]
взята из [20].
Левая часть уравнения (5) выражает приход мощности за счет вертикальной составляющей эффективной теплопроводности заторможенного насадкой псевдоожиженного слоя мелкодисперсных частиц в объем каталитической насадки. Правая часть уравнения – расход мощности на эндотермическую реакцию и подогрев продуктов этой реакции.
Уравнение (6) представляет собой баланс массы между конвективным притоком реагирующей массы метана в левой части и убылью ее в результате химических превращений в правой части уравнения. Диффузионным потоком массы ввиду его малости по сравнению с конвективным пренебрегаем. Порядок реакции по концентрации метана равен единице. Уравнение (7) выражает зависимость плотности продуктов конверсии не только от температуры и давления, а также от увеличения объема продуктов конверсии в два раза при уменьшении концентрации метана в продуктах конверсии от 0,5 до 0.
Граничные условия к уравнениям (5) и (6): при z = 0:
концентрация метана на входе гм = гм . исх = 0,5; d£l
Л^ ^|х-0 + ^М + ^П = = m • Спк ' CnK(t|z=o) ' t|z=o;
при z = Н:
[9 x2 (1 — 9 з — 9 s)](1 - х) =
— „ (1 ГМ.кон 1 + 2гМ.ИсхА I = Qr! 1----) + ^ ^М.исх !+2^М.кон'
-
+ [ C nC( t| z=H ) ' (1 — х) + х ' GlK^z^// ) 1 ' t| z=H .
Граничное условие на входе в насадку (z = 0) представляет собой уравнение баланса мощности, поступающей через 1 м2 сечения реторты эффективной теплопроводностью с нижнего торца кассеты с катализатором, а также с поступающими под насадку метаном и водяным паром и расходуемой на нагрев продуктов конверсии до температуры на нижнем торце насадки. Истинные теплоемкости продуктов конверсии CnK(t) и окисления Cnc(t) определялись из уравнений (1) и (2) с использованием [21].
На верхнем торце насадки (z = Н) граничное условие устанавливает равенство между теплотой, выделяющейся при окислении части (1 — х) продуктов конверсии (с учетом химического недожога и тепловой потери в окружающую среду), а также подводимой с воздухом в левой части и теплотой, расходуемой на эндотермическую реакцию (1), подогрев продуктов этой реакции и продуктов сгорания до температуры на верхнем торце насадки в правой части уравнения.
Множитель f 1 — г М.кон • 1+2г М.исх А — фактиче- х ^ М.исх 1+2^ М.кон'
ская степень конверсии метана, где множитель 1+2гМ.исх компенсирует эффект разбавления кон-1+2^М.кон центрации метана Гм.кон в процессе реагирования за счет увеличения объема продуктов реакции (1) в два раза. Все величины, входящие в приведенные уравнения, отнесены к 1 кг метана, вводимого в реактор по уравнению (1).
В расчетах принимались следующие значения параметров: гм . исх = 0,5; давление в реакторе р = р0 = 0,1 МПа (р0 - атмосферное); теплота, вносимая в реактор с водяным паром Qn = 551, метаном - qm = 44 и воздухом - qb = 391 кДж на 1 кг метана, вводимого в реактор; удельные потери с химическим недожогом q = 0,07 (7 %), в окружающую среду Q = 0,18 (18 %); удельная площадь поверхности катализатора 5 = 258 м2/м3, его порозность е = 0,345; доля продуктов конверсии, отводимых на полезное использование х = 0,25; высота кассеты с катализатором Н = 0,7 м; диаметр реторты 0,18 м; внутренний диаметр трубы для отвода продуктов конверсии 82 мм; размер частиц электрокорунда 0,32 мм; размер цилиндрических частиц алюмо-никелевого катализатора КСН-2 18 х 18 х 4 мм с отверстием 4 мм; массовая скорость продуктов конверсии СПК, отнесенная к площади сечения пустой реторты, равна 0,06 кг/(м 2 • с). Число псевдоожижения W = 9.
Необходимая масса метана для образования 1 кг продуктов конверсии m = 0,47 кг/кг. При возврате физической теплоты продуктов окисления и конверсии в реактор через производство пара, подогрев воздуха и метана, доля x существенно возрастает.
Для решения уравнения (5) предварительно определялась зависимость эффективного коэффициента теплопроводности в продольном направлении Zz заторможенного каталитической насадкой КСН-2 псевдоожиженного слоя от числа псевдоожижения (отношения рабочей к минимальной скорости псевдоожижения). Для этого в реакторе была проведена серия экспериментов при подаче в реактор только воздуха. В межкусковых объёмах промышленного катализатора КСН-2 ожижались частицы электрокорунда размером 0,32 мм или 0,42 мм. Температура стенки реторты составляла 850 °С, высота слоя катализатора – 0,7 м, число псевдоожижения воздуха - Ж = 4 - 18. Величина xz определялась путем наложения на поле экспериментальной зависимости t(z) с рассчитанной из уравнения (5) t * (z) при различных значениях Zz и одинаковых значениях W . При максимальном совпадении температур t(z) и t * (z) значение Xz принималось таким же, какое соответствовало расчетной температуре t * (z) при одном и том же числе псевдоожижения. Результаты представлены на рис. 2, из которого видно, что Xz от числа W проходит через максимальное значение 600 Вт/(м·К) при числе W = 8. С увеличением W частицы корунда выносятся из насадки и Zz уменьшается.
Ре з у л ьта ты ра с че тов з а в исим ос ти те м пе ра тур ы и кон центра ц и и м ета на от в ыс оты ка та лит ичес кой на са д ки по у ра в нен ия м (5) и (6) с у пом ян утыми граничными условиями и A z = 400, 500, 600, 700 и 1000 Вт/(м∙К) при числе W = 9 представлены на рис. 3. Вид н а с и л ьная н е ра в ном е рнос ть те м пер а т уры в ос е в ом напра вл е н ии. Че м в ыше Az, тем неравномерность те м пе ра т уры по в ыс оте м еньше . Н а рис . 3 на не с е ны и экс перим е нтал ьно полу че нные з на чени я те м пе ра т у ры по в ыс оте на с адк и пр и W — 9 , которые ук л а ды в а ются м е ж д у те мпе ра т урами, вычисленными при Xz — 500 и 600 Вт/(м^К) (т. е. Az = 550 Вт/(м<К ) ), что у д ов л е творительно согл а суе тся с данными, пре дста в л ен ным и на рис. 2, где Az = 550 Вт/(м^К) та к ж е с оотв е тс тву е т числу псевдоожижения W = 9.
К онцентраци и ос та л ь ных ком пон ен тов в проду к та х ко нв е рс и и на в ы х од е из ре а к тора опре дел ял и сь из ура вне н ия м а те р иа л ь ного ба л анса реакции (1) по концентрации гМ . кон, и з кот орого в идно, что на 1 моль CH4 р а с х од уетс я 1 м ол ь H2O, а из 1 моля CH4 получа е тс я 1 м ол ь CO и 3 моля H2. Ч и сл о м ол ей прод у ктов кон в е рс ии п ри кон ц е н тр ации метана на выходе гМ . кон — 4/(1 + 2гМ . кон), число молей метана на выходе
ММ.коН — 4 • гм.кон/(1 + 2 ^ М. к о н ).
Фактическое число молей прореагировавшего метана равно 1 — ММ . кон.
Число молей оксида углерода:
МСО = 1 - ММ кон .
Число молей водорода:
М н2 = 3(1 — М м^он ).
Число молей водяного пара:
МН2О — ММ.кон .
Общее число молей смеси на выходе:
М — Е М1 — МСО + МН2+ МН2О + ММ.кон .
Объемные доли компонентов смеси, м 3 /м 3 :
Г ео — МСО/М ; ГН2— МН2/М ; ГН2О — МН2О/М ;
Г м — М м.кон /М.
Концентрация диоксида углерода:
ГСО 2
К Р^СО^Н 2 О
,
Г Н
где КР - константа равновесия реакции водяного газа, находится из [17, с. 20].
Расчетный состав продукта конверсии близок к экспериментальному при температуре 1000 °С на верхнем торце кассеты с катализатором (см. таблицу). Расчетный состав продуктов паровой кон- версии метана удовлетворительно совпадает с экспериментальным. Наибольшие расхождения по диоксиду углерода и воде. Загрязнение продуктов конверсии продуктами полного сгорания не про-
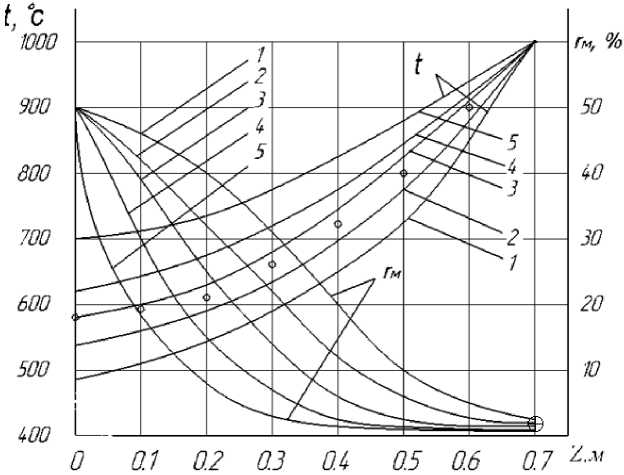
Рис. 3. Распределение температуры и концентрации метана по высоте реактора при W = 9. Кривые 1, 2, 3, 4, 5 соответствуют λ z = 400, 500, 600, 700 и 1000 Вт/(м∙К). Точки ○ – экспериментально замеренная температура. г М - концентрация метана (% объемные). Точка ® - экспериментально замеренная концентрация метана на выходе из реактора
Сравнение экспериментально полученного состава продуктов паровой конверсии метана с расчетным при температуре 1000 °С
|
Компоненты смеси на выходе |
Г м |
ГН 2 |
Гсо |
ГСО 2 |
Гн2о |
|
Эксперимент, % объемн. |
2,449 |
72,043 |
22,35 |
1,398 |
1,76 |
|
Расчет, % объемн. |
2,44 |
70,935 |
23,66 |
0,495 |
2,47 |
исходило. Состав получаемого газа удовлетворяет требованиям, предъявляемым к восстановительным атмосферам. Хотя реактор конструктивно прост, но имеет недостаток из-за добавления в продукты сгорания 1 моля водяного пара на 1 моль метана, поскольку окисляется не метан, а продукты паровой конверсии метана, что увеличивает потерю с уходящими продуктами сгорания.
Заключение
Эффективность работы реактора в значительной степени определяется коэффициентом переноса теплоты Az. Чем больше величина Az, тем выше средняя температура, а следовательно, и скорость реакций. Обратное влияние на распределение температур и концентраций оказывает увеличение массовой скорости продуктов конверсии.
Значения Az достаточны для переноса теплоты из верхних слоев аппарата в нижние и поддержания там температуры на высоком уровне 600–1000 °C.
В продуктах, выводимых из камеры сгорания, имеется водяной пар, уменьшающий термический КПД аппарата на 5,5 %.
Исключено проникновение продуктов полного сгорания в камеру отвода продуктов конверсии за счет нисходящего потока газа в плотной фазе в камере сгорания. Метан появляется в продуктах газификации из-за реакции гидрогенизации углерода. Хорошо проходит только под высоким давлением 2–20 МПа.
Перемешивание твердой фазы и связанный с ним перенос теплоты носят диффузионный характер, поэтому система описана дифференциальным уравнением второго порядка конвективного теплопере-носа со стоками теплоты. Присутствие в продуктах CO2 и H2O в небольших количествах связано с тем, что реакции не успевают дойти до равновесия.
Разработана конструкция термохимического реактора паровой конверсии метана с заторможенным катализатором псевдоожиженным слоем для получения восстановительных атмосфер.
Экспериментально показано, что эффективный коэффициент осевой теплопроводности заторможенного насадкой слоя электрокорунда, ожижаемого продуктами конверсии и воздухом, практически совпадают при одинаковых числах псевдоожижения. При Ж = 9 значение Az составляет около 550 Вт/(м∙К).
Состав продуктов конверсии:
Н2 = 72,043; CO = 22,35; гСО2 = 1,398;
CH4 = 2,449; H2O = 1,76 (% объёмные)
пригоден для процессов восстановления железорудных окатышей, так как (СО2 + H2O) < 10 %, (H2 + СО)/(СО2 + H2O) > 10, а CH4 < 5 %.
Разработана расчетная модель реактора, удовлетворительно описывающая экспериментальные данные, при помощи которой рассчитываются все параметры, необходимые для проектирования реакторов промышленного назначения.
Список литературы Термохимический реактор восстановительных атмосфер с окислением части продуктов паровой конверсии метана
- Производство технологического газа для синтеза аммиака и метанола из углеводородных газов / под ред. А.Г. Лейбуш. - М.: Химия. - 1971. - 286 с.
- Оптимальные параметры реактора с заторможенным насадкой циркуляционным псевдоожиженным слоем для паровой конверсии метана / А.М. Дубинин, С.Е. Щеклеин, В.Г. Тупоногов и др. // Международный научный журнал «Альтернативная энергетика и экология». - 2015. - № 13-14 (177-178). - С. 103-108. DOI: 10.15518/isjaee.2015.13-14.010
- Писаренко, Е.В. Энерго- и ресурсосберегающий процесс получения синтез-газа из природного газа в производстве метанола / Е.В. Писаренко, В.Н. Писаренко // Теоретические основы химической технологии. - 2011. - Т. 45, № 1. - С. 371-377.
- Мещеряков, Г.В. Конверсия природного газа для совместных производств метанол-водород, метанол-аммиак / Г.В. Мещеряков, Ю.А. Комиссаров // Вестник МИТХТ. - 2011. - Т. 6, № 4. - С. 72-76.
- Igumnov, V.S. Technical and technological methods of realization of steam catalytic conversion of natural gas with a methane-watr proportion close to stoichiometric ratio / V.S. Igumnov // Hydrogen Material Science and Chemistry of Carbon Nanomaterials / T.V. Veziglu et al. (eds). - Springer, 2007. - P. 555-561. DOI: 10.1007/978-1-4020-5514-0_70
- Oxidative coupling of methane: Process design, development and operation in mini-plant scale / S. Stünkel, H. Trivedi, H.-R. Godini et al. // Chemie Ingenieur Technik. - 2012. - No. 11. - P. 1989-1996.
- DOI: 10.1002/cite.201200052
- Hoang, D.L. Kinetic and modeling study of methane steam reforming over sulfide nickel catalyst on a gamma alumina support / D.L. Hoang, S.H. Chan, O.L. Ding // Chemical Engineering Journal. - 2005. - Vol. 112. - P. 1-11.
- DOI: 10.1016/j.cej.2005.06.004
- Xu, J. Methane steam reforming, methanation and water gas shift: I. Intrinsic Kinetics / Xu J., Froment G.F. // AIChE J. - 1989. - Vol. 35, no. 1. - P. 88-96.
- DOI: 10.1002/aic.690350109
- Xu, J. Methane steam reforming: II. Diffusional limitations and reactor / J. Xu, G.F. Froment // The journal of the American Institute of Chemical Engineers (AlChE). - 1989. - Vol. 35, no. 1. - P. 97-103.
- DOI: 10.1002/aic.690350110
- Kehoe, P.W. Pressure fluctuation in sluggins fluidized beds / P.W. Kehoe, J.F. Davidcon // The journal of the American Institute of Chemical Engineers (AlChE). - 1973. - Vol. 69, no. 128. - P. 34-40.
- Progress in low temperature hydrogen production with simulaneous CO2 abatement / H. Chen, Y. Ding, N.T. Cong et al. // Chemical Engineering Research and Design. - 2011. - Vol. 89, iss. 9. - P. 1774-1782.
- DOI: 10.1016/j.cherd.2010.06.008
- Integrated auto-thermal oxidate coupling and steam reforming of methane. Part 1: Design of dual-function catalyst particle / T.P. Tiemersma, A.S. Chaudhari, F. Gallucci et al. // Chemical Engineering Science. - 2012. - Vol. 82. - P. 200-214.
- DOI: 10.1016/j.ces.2012.07.048
- Fernandez, J.R. Modeling of sorption enhanced steam methane reforming in an adiabatic fixed bed reactor] / J.R. Fernandez, J.C. Abanades, R. Murillo // Chemical Engineering Science. - 2012. - Vol. 84. - P. 1-11.
- DOI: 10.1016/j.ces.2012.07.039
- Hiblot, H. Steam reforming of methane in a synthesis gas from biomass gasification / H. Hiblot // International Journal of Hydrogen Energy, 2016. - Vol. 41. - P. 18329-18338.
- DOI: 10.1016/j.ijhydene.2016.07.226
- А.С. 992079 СССР. Генератор эндотермических атмосфер / А.М. Дубинин, А.П. Баскаков, В.Б. Шойбонов. - № 3260865/22-02; заявл. 06.01.81; опубл. 30.01.83, Бюл. № 4.
- Кунии, Д. Промышленное псевдоожижение. США, 1969 / Д. Кунии, О. Левеншпиль; пер. с англ. под ред. М.Г. Слинько и Г.С. Яблонского. - М.: Химия, 1976. - 448 с.


