Термолучевая терапия в комбинированном лечении местнораспространённого рака гортани и гортаноглотки
Автор: Спивакова И.О., Чойнзонов Е.Л., Мухамедов М.Р., Старцева Ж.А., Васильев Н.В., Грибова О.В.
Рубрика: Научные статьи
Статья в выпуске: 4 т.24, 2015 года.
Бесплатный доступ
В статье представлены результаты комбинированного лечения больных местнораспространённым раком гортани и гортаноглотки с III-IV (Т3N0-2M0) стадиями заболевания. В зависимости от методики предоперационного лечения пациенты были разделены на 2 группы: 25 больных с термолучевой (1-ая, исследуемая группа), 30 - с лучевой (2-ая, контрольная группа) терапией. Вторым этапом выполнялось хирургическое лечение. Срок наблюдения за пациентами составил 6-24 месяца. После завершения предоперационного лечения частичная регрессия опухоли была диагностирована у 21 (84%) больного, а стабилизация процесса - у 4 (16%) пациентов первой группы, во 2-ой группе больных - 18 (60%) и 12 (40%) соответственно. Локальный и регионарный рецидив заболевания в исследуемой группе развился у 1 (4%) пациента на 1-ом году наблюдения, в контрольной - у 11: 7 на первом году и 4 - на 2-ом году наблюдения. Двухлетняя общая выживаемость в 1-ой группе составила 100%, во второй - 76,7±10,1%, безрецидивная - 96,6±3,5% и 63,3±13,9% соответственно.
Рак гортани, рак гортаноглотки, неоадъювантная лучевая терапия, термолучевая терапия, органосохраняющие операции, лечебный патоморфоз, эффективность лечения, выживаемость, рецидивы, комбинированное лечение
Короткий адрес: https://sciup.org/170170227
IDR: 170170227
Текст научной статьи Термолучевая терапия в комбинированном лечении местнораспространённого рака гортани и гортаноглотки
Рак гортани и гортаноглотки – социально обусловленное заболевание и находится в непосредственной связи с табакокурением, употреблением алкоголя, профессиональными вредностями и хроническими воспалительными процессами [1, 2] . В России, в структуре общей заболеваемости злокачественными опухолями рак гортани, в зависимости от региона, составляет 1-4%, среди рака верхних дыхательных путей – 65-70% [3, 4]. При этом преобладает удельный вес больных с местнораспространённым опухолевым процессом. В 2014 г. в России среди больных раком гортани, с первично установленным диагнозом, I-II ст. выявлены в 36,5% случаях, III – в 18,7%, IV – в 43,2% [3]. Общепринятым методом лечения пациентов с местнораспространённым раком гортани является комбинированный метод, состоящий из лучевого и хирургического компонентов и представляющий лучшие результаты, чем каждый из них, применяемый в качестве самостоятельного варианта лечения [5-8]. Однако, данный метод, особенно после расширенных операций, вызывает существенные физические дефекты, которые влияют на основные жизненно важные функции, т.е. снижает качество жизни пациентов [9]. Кроме того, несмотря на агрессивное лечение, 5-летняя безрецидивная выживаемость остаётся невысокой и колеблется в пределах 60-85%, т.е. у 15-40% больных имеют место локальные или регионарные рецидивы [10-13].
Все вышеизложенное обосновывает актуальность совершенствования существующих методов лечения местнораспространённого рака гортани. В последние годы высокие результаты лучевого и химиолучевого лечения злокачественных опухолей различных локализаций достигнуты при дополнительном использовании гипертермического метода воздействия [14-19], в том числе и у больных раком гортани и гортаноглотки [20-23]. Это связано не только с общеиз-
Спивакова И.О.* – аспирант; Чойнзонов Е.Л. – директор, д.м.н., академик РАН; Мухамедов М.Р. – вед. научн. сотр., д.м.н.; Старцева Ж.А. – рук. отд., д.м.н.; Васильев Н.В. – ст. научн. сотр., к.м.н.; Грибова О.В. – научн. сотр., к.м.н. Томский НИИ онкологии.
вестными радио- и химиосенсибилизирующим действиями гипертермии, но и иммуногенным эффектом, а также способностью нивелировать множественную лекарственную устойчивость опухолевых клеток [24-26].
Целью исследования являлся сравнительный анализ эффективности предоперационной лучевой и термолучевой терапии больных местнораспространённым раком гортани и гортаног-лотки.
Материалы и методы
В исследование включено 55 больных плоскоклеточным раком гортани и гортаноглотки III-IV стадий (T3N0-2M0), получавших лечение в отделении опухолей головы и шеи Томского НИИ онкологии за период с 2012 по 2014 гг. Сроки наблюдения за больными составили от 6 до 24 месяцев, в среднем 12,4±4,6 мес. В зависимости от методики предоперационного лечения пациенты были разделены на 2 группы (табл. 1). В 1-ой группе (исследуемая) проведена термолучевая терапия (n=25), во 2-ой (контрольная) – лучевая терапия (ЛТ).
Таблица 1
Характеристика больных и опухоли
|
Показатель |
Группа № 1 абс. (%), (n=25) |
Группа № 2 абс. (%), (n=30) |
|
|
Пол |
м ж |
23 (92) 2 (8) |
27 (90) 3 (10) |
|
Локализация |
Гортань Гортаноглотка |
19 (76) 6 (24) |
23 (76,7) 7 (23,3) |
|
TNM |
Т3N0M0 T3N1-2M0 |
23 (92) 2 (8) |
28 (93,3) 2 (6,7) |
|
Стадия |
III IV |
18 (72) 7 (28) |
21(70) 9 (30) |
|
Степень дифференцировки |
Высокая Умеренная Низкая |
2 (8) 18 (72) 5 (20) |
3 (10) 22 (73,3) 5 (16,7) |
На 2-ом этапе, через 4-10 дней после лучевой терапии (ЛТ) или термолучевой терапии (ТЛТ), выполнялось хирургическое лечение в различном объёме. Все больные обследованы в динамике: до начала лечения, на этапах комбинированного лечения и в различные сроки после лечения. Критерием включения в исследование являлся местнораспространённый рак гортани и гортаноглотки. Критерии исключения: стеноз гортани 3-4 степени, хондроперихондрит и деструкция хрящей гортани.
До начала лечения всем больным проводили полное клиническое обследование в следующем объёме: общий анализ крови, мочи, биохимическое исследование крови, оценка состояния свертывающей системы, непрямая ларингоскопия, видеоларингоскопия с биопсией, спиральная компьютерная томография с контрастированием (СКТ), рентгенография лёгких, ЭКГ, ультразвуковое исследование (УЗИ) шеи, щитовидной железы и органов брюшной полости, цитологическое и гистологическое исследование биопсийного материала. Всем пациентам осуществляли неоадъювантный курс лучевой терапии в стандартном режиме фракционирования дозы (РОД – 2,0 Гр, 5 фракций в неделю) в СОД 40 Гр. Локальное нагревание опухоли осуществляли с помощью радиочастотного (РЧ) излучения (13,56 МГц) в специально оборудован- ном кабинете на установке Celsius TCS. Воздействие проводили емкостным способом, при выходной мощности 500 Вт, 2 раза в неделю с продолжительностью 60 мин в количестве 8 сеансов. К сожалению, из-за технических трудностей прямое измерение температуры в опухоли не проводили. Однако, считаем, что теоретически при использованных мощностях РЧ-излучения в опухоли может создаваться гипертермический режим (локальная гипертермия).
ЛТ осуществлялась непосредственно после воздействия РЧ-излучением. План облучения разрабатывали в зависимости от лечебного объёма индивидуально с помощью программы дозиметрического планирования (рис. 1).
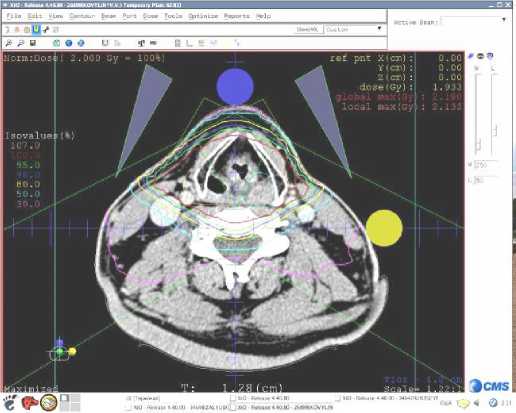
Рис. 1 . Дозиметрическое планирование облучения.
У всех больных выполняли эндоскопическое исследование гортани с видеозаписью. Использование эндоскопических видеосистем позволило записывать цифровое изображение видеоларингоскопии, что дало возможность многократного просмотра и широкого коллегиального обсуждения ВЛС на этапах лечения. При оценке эффекта во время выполнения видеоларингоскопии учитывалась динамика размера экзофитного компонента, площадь распространения опухоли, границы инфильтрации, количество вовлечённых в опухолевый процесс структур. На втором этапе лечения выполняли оперативные вмешательства на гортани, гортаноглотке и регионарных лимфоузлах.
Результаты лечения оценивали по интенсивности и частоте развития лучевых реакций нормальных тканей гортани, общетоксического эффекта и непосредственного ответа опухоли после завершения 1-го этапа лечения. Непосредственный эффект предоперационной терапии оценивали согласно критериям RECIST [27]. Отдалённые результаты лечения изучали по общей и безрецидивной выживаемости. Расчет кривых выживаемости проводили методом Kaplan-Meier [28].
После хирургического лечения в операционном материале оценивали степень терапевтического патоморфоза по Г.А. Лавниковой [29].
Результаты исследования
При анализе непосредственных результатов лечения (табл. 2) выявлено, что частота случаев частичной регрессии была выше в группе с применением локальной гипертермии – 84%. Частота случаев стабилизации опухоли была выше в контрольной группе – 40%, по сравнению с аналогичными показателями в исследуемой группе – 16%.
Таблица 2
Непосредственная эффективность неоадъювантного курса лечения в группах
|
Группа больных (число больных) |
Частичная регрессия, абс. (%) |
Стабилизация, абс. (%) |
|
Исследуемая (25) |
21 (84) |
4 (16) |
|
Контрольная (30) |
18 (60) |
12 (40) |
В период проведения ТЛТ все пациенты удовлетворительно переносили назначенный курс лечения. Дополнительное воздействие РЧ-полем не приводило к развитию выраженных местных или общетоксических реакций. Также не наблюдалось гематологических реакций, потребовавших прекращения проводимого лечения. Наличие наложенной ранее превентивной трахеостомы у 2-х (3,7%) больных (T3N0-1M0) не препятствовало проведению сеансов локальной гипертермии. При возникновении лучевого эпителиита назначалась терапия, в том числе магнитолазерная терапия, направленная на купирование и ослабление субъективных симптомов, уменьшение воспаления, профилактику инфекционных осложнений. Таким образом, анализ результатов сочетанного с локальной гипертермией неоадъювантного курса ЛТ не показал негативных реакций у пациентов по сравнению с одной лучевой терапией.
На втором этапе лечения больным выполнено хирургическое вмешательство в различном объёме (табл. 3).
Таблица 3
Виды операции в группах после неоадъювантного лечения
|
Группа больных (число больных) |
Виды операции по группам, абс. (%) |
|
|
Органосохраняющие, абс. (%) |
Органоуносящие, абс. (%) |
|
|
Исследуемая (25) |
10 (40) |
15 (60) |
|
Контрольная (30) |
9 (30) |
21 (70) |
Из 25 больных исследуемой группы 10 (40%) осуществлены органосохраняющие операции: 5 – фронтолатеральные резекции гортани, 4 – гемиларингэктомии, одной больной с T3N0M0 выполнено органосохраняющее лечение в объёме трахеостомии, лимфодиссекции шеи справа, резекции гортаноглотки справа, пластики лучевым лоскутом на микрососудистых анастомозах. Остальным 15 (60%) пациентам выполнены радикальные операции: 2-м – комбинированные ларингэктомии с лимфодиссекцией шеи, 13-ти – без регионарных метастазов – ларингэктомии с установкой голосового протеза «Provox» в 3-х случаях и в двух случаях выполнено формирование трахеоглоточного шунта. В контрольной группе (n=30) органосохраняющие операции выполнены у 9 (30%) пациентов, преимущественно фронтолатеральные резекции – у 6 больных; у 3-х больных удалось выполнить гемиларингэктомию. У 21 (70%) пациента были осуществлены радикальные операции: ларингэктомия у 18-ти и комбинированная ларингэктомия – у 3-х больных. Лимфодиссекцию шеи проводили в 2-х случаях; 1-му больному выполнено формирование трахеоглоточного шунта. По результатам гистологического исследования операционного материала в группе с локальной гипертермией, I степень лечебного патоморфоза диагностирована в 2 случаях (8%), II-я степень – в 4 (16%); III степень – в 11 (44%) и IV степень – в 8 (32%). В группе контроля выявлены только I и II степени терапевтического патоморфоза, 48% и 52% соответственно. На контрольных точках динамического наблюдения в исследуемой группе рецидив заболевания наблюдали у 1 (4%) больного, на первом году, в группе контроля – на первом году у 7 (23%) и на втором году – у 4 (17,39%). Анализ безрецидивной выживаемости выявил следующие результаты: в группе исследования безрецидивная выживаемость в наблюдаемые сроки составила 96±4,1%; в группе контроля – 63,3±13,9%. Различия статистически значимы (p=0,005), рис. 2.
4- 96%
4- 63%
--- Исследуемая группа ---- Контрольная группа
О 6 12 18 24
Время, месяцы
Рис. 2. Показатели 2-летней безрецидивной выживаемости у больных раком гортани и гортаноглотки в группах.
В течение наблюдаемого срока в исследуемой группе все больные живы, в контрольной – отмечены 7 случаев летальных исходов. Таким образом, общая 2-летняя выживаемость в первой группе составила 100%, во второй – 76,7±10,1%.
Клинический пример. Больная Б., 39 лет с диагнозом: Рак гортаноглотки T3N0M0. Гистология № 32555-59 от 10.12.2013 г. – плоскоклеточный рак низкой степени дифференцировки.
Анамнез: обратилась с жалобами на комок в горле при глотании в ноябре 2014 г. Из анамнеза выяснено, что дискомфорт беспокоит с сентября 2014 г. При обращении к ЛОР-врачу по месту жительства – подозрение на опухоль гортани. Самостоятельно обратилась в Томский НИИ онкологии, госпитализирована в отделение опухолей головы и шеи.
По данным фиброларингоскопии выявлено, что на правой черпало-надгортанной связке визуализируется бугристая, тугоэластическая ткань. Голосовая щель при фонации смыкается полностью. Выполнена биопсия образования (рис. 3).
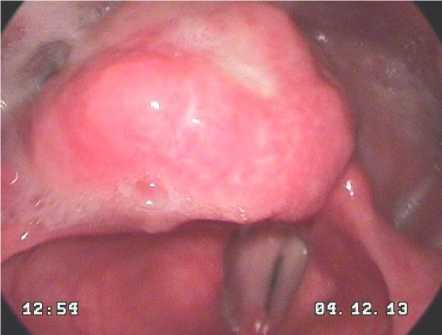
Рис. 3 . Данные видеоларингоскопии до начала лечения.
При ультразвуковом исследовании данных за mts-поражение лимфатических узлов не получено.
По данным спиральной компьютерной томографии (СКТ) гортани с болюсным контрастированием, отмечается утолщение и деформация правой черпало-надгортанной складки с признаками накопления контрастного вещества, а также в передней стенке и латеральной стенке правого грушевидного синуса, вплоть до вершины синуса, с сужением его просвета. Вестибулярные, голосовые складки не изменены. Гортанные желудочки при фонации раскрываются, не изменены. Подскладочное пространство свободно. Признаков вовлечения в опухолевый процесс хрящей гортани не отмечается. Заключение: опухоль гортаноглотки справа (рис. 4).
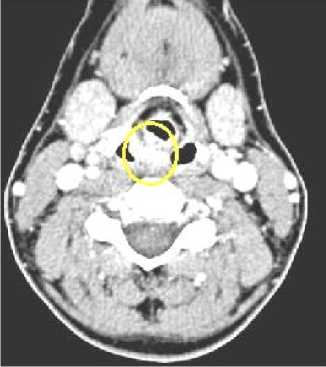
Рис. 4 . Данные СКТ гортани до лечения.
Первым этапом комбинированного лечения проведен предоперационный курс дистанционной лучевой терапии (ДЛТ) на фоне локальной гипертермии, с оценкой эффекта на суммарной очаговой дозе (СОД) 40 Гр. У больной наблюдалось осложнение – лучевой катаральный эпителиит. Для купирования острой лучевой реакции проводилась магнитолазерная терапия. По данным видеоларингоскопии (ВЛС) эффект расценен как частичная регрессия (рис. 5).
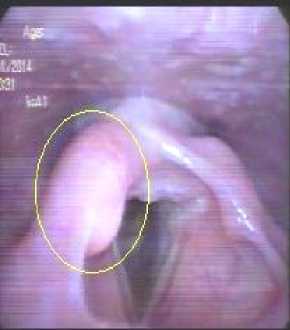
Рис. 5. Данные видеоларингоскопии, СОД 40 Гр + 8 сеансов локальной гипертермии.
Вторым этапом комбинированного лечения 13.02.2014 г. больной выполнено органосо- храняющее лечение в следующем объёме: Лимфодиссекция шеи справа (зоны II-V). Трахеостомия. Резекция гортаноглотки справа. Пластика лучевым лоскутом на микрососудистых ана- стомозах. Контрольная видеоларингоскопия проводилась через месяц после лечения (рис. 6).
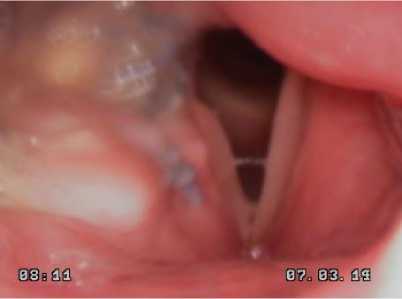
Рис. 6. Данные видеоларингоскопии через месяц после лечения.
По данным СКТ гортани, выполненной через 3 месяца, признаков рецидива опухоли не обнаружено (рис. 7).
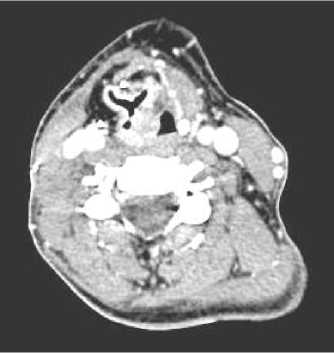
Рис. 7. Данные СКТ гортани через 3 месяца после лечения.
Больная находится под динамическим наблюдением в Томском НИИ онкологии, данных за прогрессирование опухолевого процесса в виде рецидива или регионального метастазирования не получено. Сохранила полную социальную и трудовую активность (рис. 8, 9).
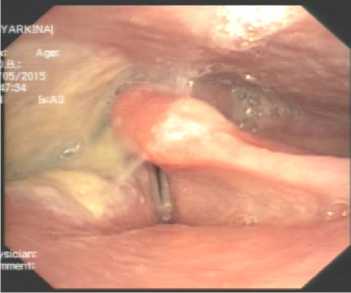
Рис. 8. Данные видеоларингоскопии через 1,5 года после лечения.
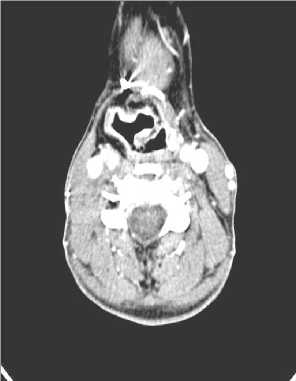
Рис. 9 . Данные СКТ гортани через 1,5 года после лечения.
Заключение
Таким образом, анализ полученных результатов свидетельствуют о перспективности применения локальной гипертермии в комбинированном лечении местнораспространённого рака гортани и гортаноглотки. Использованный метод переносится больными удовлетворительно, приводит к достоверному увеличению лечебного патоморфоза III-IV степени и снижению частоты рецидивов.
Список литературы Термолучевая терапия в комбинированном лечении местнораспространённого рака гортани и гортаноглотки
- Чойнзонов Е.Л., Мухамедов М. Р., Балацкая Л. Н. Рак гортани. Современные аспекты лечения и реабилитации. Томск, 2006. 276 с.
- Чойнзонов Е.Л., Писарева Л.Ф., Жуйкова Л.Д., Одинцова И.Н., Тюкалов Ю.И. Рак гортани: онкологическая помощь больным в городской и сельской местности Томской области//Российская оториноларингология. 2012. № 6. С. 147-153.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2014 году. М., 2015. 236 с.
- Подвязников С.О., Чойнзонов Е.Л., Кропотов М.А., Кожанов Л.Г., Пустынский И.Н., Письменный В.И., Алиева С.Б., Акетова Т.А., Таболиновская Т.Д. Диагностика и лечение рака гортаноглотки. Клинические рекомендации//Сибирский онкологический журнал. 2014. № 6. С. 71-75.
- Мухамедов М.Р. Новые технологии в лечении и реабилитации больных раком гортани: дис. … д-ра мед. наук. Томск, 2005. 293 с.
- Ткачев С.И., Матякин Е.Г., Любаев В.Л., Бойков В.П., Алиева С.Б., Алиев Б.М., Кондратьева А.П., Акетова Т.А., Пирогова Н.А., Логинова И.Н. Сравнительная оценка пятилетних результатов хирургического, комбинированного, лучевого и химиолучевого методов лечения рака гортани стадии T3N0M0//Вопросы онкологии. 2006. Т. 52, № 4. С. 404-407.
- Чижевская С.Ю., Чойнзонов Е.Л. Современные возможности и перспективы комбинированного лечения рака гортани и гортаноглотки//Сибирский онкологический журнал. 2007. № 4. С. 127-132.
- Lefebvre J.L., Ang K.K. Larynx preservation clinical trial design: key issue and recommendations -a consensus panel summary//Head & Neck. 2009. V. 31, N 4. P. 429-441.
- Williamson J.S., Ingrams D., Jones H. Quality of life after treatment of laryngeal carcinoma: a single centre cross-sectional study//Ann. R. Coll. Surg. Engl. 2011. V. 93, N 8. P. 591-595.
- Рожнов В.А., Андреев В.Г., Гулидов И.А., Панкратов В.А., Барышев В.В., Буякова М.Е., Вдовина С.Н. Паллиативное лечение больных с неоперабельным рецидивным раком гортани//Сибирский онкологический журнал. 2008. № 3. С. 29-33.
- Алферов В.С. Органосохраняющее лечение рака гортани//Материалы V Российской онкологической конференции. М., 2000. С. 80-81.
- Cosetti M., Yu G.P., Schantz S.P. Five-year survival rates and time trends of laryngeal cancer in the US population//Arch. Otolaryngol. Head Neck. Surg. 2008. V. 134, N 4. P. 370-379.
- Spriano G., Antognoni P., Sanguineti G., Sormani M., Richetti A., Ameli F. Laryngeal long-term morbi-dity after supraglottic laryngectomy and postoperative radiation therapy//Am. J. Otolaryngol. 2000. V. 21, N 1. Р. 14-21.
- Курпешев О.К., Бердов Б.А. Результаты локальной гипертермии в онкологии//Российский онкологический журнал. 1999. № 2. C. 48-52.
- Курпешев О.К., Цыб А.Ф., Мардынский Ю.С., Бердов Б.А., Курпешева А.К. Локальная гипертермия в лучевой терапии опухолей (экспериментально-клиническое исследование). Обнинск: МРНЦ РАМН, 2007. 219 с.
- Курпешев О.К., Мардынский Ю.С., Максимов С.А. Комбинированное лечение больных раком полости рта с использованием «условно-динамического» режима фракционирования лучевой терапии и локо-регионарной гипертермии//Сибирское медицинское обозрение. 2011. Т. 67, № 1. С. 80-84.
- Курпешев О.К., Павлов В.В., Шкляев С.С. Эффективность локальной гипертермии при химиотерапевтическом и/или лучевом лечении лимфомы Ходжкина//Сибирский онкологический журнал. 2013. T. 58, № 4. C. 28-30.
- Зубарев А.Л., Курильчик А.А., Курпешев О.К., Стародубцев А.Л., Иванов В.Е. Локальная гипертермия в комбинированном лечении местнораспространённых сарком мягких тканей//Сибирский онкологический журнал. 2015. № 3. С. 55-60.
- Van der Zee J., Vujaskovic Z., Kondo M., Sugahara T. Part I. Clinical Hyperthermia. The Kadota Fund International Forum 2004 -Clinical group consensus//Int. J. Hypert. 2008. V. 24, N 2. P. 111-122.
- Панкратов В.А., Андреев В.Г., Курпешев О.К., Гулидов И.А., Рожнов В.А., Барышев В.В., Буякова М.В., Литовкина Л.В. Применение термохимиолучевого лечения у больных с местно-распространённым раком гортани и гортаноглотки//Российский онкологический журнал. 2006. № 4. С. 20-23.
- Курпешев О.К., Андреев В.Г., Панкратов В.А., Гулидов И.А., Орлова А.В. Консервативное термохимиолучевое лечение местно-распространённого рака гортани//Вопросы онкологии. 2013. Т. 59, № 5. C. 571-574.
- Курпешев О.К., Андреев В.Г., Панкратов В.А., Гулидов И.А., Орлова А.В. Результаты комбинированного лечения местнораспространённого рака гортани с использованием предоперационной термохимиолучевой терапии//Вопросы онкологии. 2013. Т. 59, № 6. C. 721-724.
- Kouloulias V., Triantopolou S., Vrouvas J., Gennatas K., Ouzounoglou N., Kouvaris J., Karaiskos P., Aggelakis P., Antypas C., Zygogianni A., Papavasiliou K., Platoni K., Kelekis N. Combined chemoradiotherapy with local microwave hyperthermia for treatment of T3N0 laryngeal carcinoma: a retrospective study with long-term follow up//Acta Otorhinolaryngol. Ital. 2014. V. 34, N 3. P. 167-173.
- Ando K., Suzuki Y., Kaminuma T. Hyperthermia-induced tumor-specific T-cell immunity and its role in the therapeutic efficacy of hyperthermia//Thermal Medicine. 2014. V. 30, Suppl. P. 144.
- Курпешев О.К., Цыб А.Ф., Мардынский Ю.С., Бердов Б.А. Механизмы развития и пути преодоления химиорезистентности опухолей. Часть 3. Возможные пути преодоления химиорезистентности опухолей//Российский онкологический журнал. 2003. № 2. C. 50-53.
- Курпешев О.К., Цыб А.Ф., Мардынский Ю.С., Бердов Б.А. Механизмы развития и пути преодоления химиорезистентности опухолей. Часть 4. Экспериментальные основы и практические результаты применения общей гипертермии в лечении химиорезистентных опухолей//Российский. онкологический журнал. 2003. № 3. C. 50-53.
- Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz, L.H., Sargent, D., Ford R. New response evaluation criteria in solid tumours: Revised RECIST guideline (v. 1.1)//Eur. J. Cancer. 2009. V. 45(1), N 1. P. 228-247.
- Kaplan E.L., Meier P. Nonparametric estimation from incomplete observations//J. Amer. Stat. Ass. 1958. V. 53. P. 457-481.
- Лавникова Г.А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование//Вестник АМН СССР. 1976. № 6. С. 13-19.


