The influence of carbohydrate status and low temperature on the respiratory metabolism of mitochondria from etiolated leaves of winter wheat
Автор: Borovik Olga A., Grabelnych Olga I., Koroleva Nina A., Pobezhimova Tamara P., Voinikov Victor K.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
The separate and combined effect of sucrose (12%, 7 days) and low temperature (2 °С, 7 days) on the growth of plants, the content of carbohydrates in the leaves and oxidative activity of mitochondria isolated from them has been studied on the etiolated plants of winter wheat ( Triticum aestivum L.). It has been shown that sucrose and low temperature cause inhibition of the growth and increasing of the carbohydrates content. Using the different oxidation substrates (malate, malate + rotenone, succinate, NADH and NADPH) have been identified changes in the mitochondrial oxidative activity and the functioning of alternative oxidase and rotenone-insensitive NAD(P)H dehydrogenases. It has been determined that activity of the alternative oxidase and “external” rotenone-insensitive NAD(P)H dehydrogenases in the mitochondria of etiolated leaves depends on the carbohydrate status of the plant, regardless of the growth temperature.
Alternative oxidase, carbohydrates, low temperature, rotenone-insensitive nad(p)h dehydrogenases, winter wheat
Короткий адрес: https://sciup.org/14323903
IDR: 14323903
Текст научной статьи The influence of carbohydrate status and low temperature on the respiratory metabolism of mitochondria from etiolated leaves of winter wheat
Митохондрии играют центральную роль в выступают в качестве сигнальных органелл, углеродном и энергетическом метаболизме клеток, участвующих в регуляции экспрессии ядерных генов и обеспечении устойчивости растений к различным стрессорам биотической и абиотической природы (Jacoby et al., 2012; Cvetkovska and Vanlerberghe, 2013; Li et al., 2013; Vanlerberghe, 2013). В митохондриях осуществляются процессы клеточного дыхания, конечным этапом которого является высвобождение свободной энергии, которая может быть использована для синтеза АТФ (Jacoby et al., 2012; Vanlerberghe, 2013). Метаболизм дыхания зависит от действия различных факторов внешней среды, в том числе низкой температуры. Дыхание – температурно-зависимый процесс – изменение температуры приводит к быстрому изменению интенсивности дыхания (Armstrong et al., 2008). Интермедиаты дыхания находятся на стыке процессов синтеза и распада различных соединений и играют ключевую роль в жизнедеятельности растительного организма (Semikhatova, Chirkova, 2001). Основными субстратами дыхания являются сахара (Golovko, 1999). Углеводный статус влияет на скорость дыхания листьев и корней растений (Noguchi, 2005). В зеленых листьях пшеницы обнаружена прямая корреляция между содержанием сахаров и скоростью дыхания и вкладом в дыхание цианидрезистентного альтернативного пути (АП) при 22 °С (Azcon-Bieto et al., 1983). Наиболее сильное увеличение скорости дыхания наблюдается при инкубации срезов листьев с такими водорастворимыми углеводами, как сахароза, глюкоза и фруктоза (Azcon-Bieto et al., 1983). Выращивание зеленых растений озимой пшеницы на растворе сахарозы при температурах 22 и 2 °С приводило к активации АП в митохондриях, изолированных из листьев этих растений (Borovik et al., 2013; Borovik, 2014). Альтернативный путь дыхания связан с функционированием альтернативной оксидазы (АО), которая является одной из терминальных оксидаз в дыхательной цепи митохондрий растений. На альтернативный путь дыхания электроны поступают с убихинон/убихинолового пула, минуя протонтранслоцирующие комплексы III и IV дыхательной цепи (Finnegan et al., 2004). Известно, что АО принимает участие в термогенезе специализированных тканей некоторых ароидных и лотосовых (Grant et al., 2008; Wagner et al., 2008). Функционирование АО может предотвращать образование АФК дыхательной цепью митохондрий (Maxwell et al., 1999; Blokhina and Fagerstedt, 2010), а также вносит важный вклад в регуляцию энергетического метаболизма клетки (Vanlerberghe, 2013). Функционирование АО может быть сопряжено с активностью ротенон-нечувствительных «внешних» и «внутренних» НАД(Ф)∙Н-дегидрогеназ (Elhafez et al., 2006; Smith et al., 2011; Tan et al., 2012; Vanlerberghe, 2013), что приводит к возможности свободного от фосфорилирования окисления НАД∙Н и НАДФ∙Н (Finnegan et al., 2004; Smith et al., 2011; Vanlerberghe, 2013). Такой путь транспорта электронов, по-видимому, необходим для поддержания оптимальной работы ферментов гликолиза, пентозофосфатного пути и цикла Кребса. Вероятно, в условиях действия низких температур альтернативный путь дыхания через ротенон-нечувствительные НАД(Ф)∙Н- дегидрогеназы и АО может поддерживать дыхательный метаболизм в клетках растений и повышать их устойчивость к низкой температуре. В гетеротрофных тканях митохондрии являются основным источником энергии и одним из основных источников образования АФК (Møller, 2001). На 3-х суточных этиолированных проростках озимой пшеницы нами было показано, что при действии низких закаливающих температур возрастает вклад в дыхание АО при окислении митохондриями экзогенного НАД∙Н, и при этом повышается морозоустойчивость проростков (Grabelnych et al., 2014). Сохраняется ли способность к активации АО при действии низких температур в листьях этиолированных растений на более поздних стадиях развития, когда содержание сахаров истощается, неизвестно. В литературе отсутствуют сведения о связи углеводного статуса растений с функционированием ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ и АО в митохондриях при действии низкой температуры. В связи с этим целью работы явилось изучение влияния низкой температуры и различной обеспеченности сахарами на функционирование «внешних» и «внутренних» ротенон-нечувствительных
НАД(Ф)∙Н-дегидрогеназ и АО в митохондриях из этиолированных листьев озимой пшеницы.
MATERIALS AND METHODS
В работе использовали этиолированные растения озимой пшеницы ( Triticum aestivum L.)
морозоустойчивого сорта Иркутская. Растения выращивали в камере MIR-154 (“Sanyo”, Япония) на ½ раствора Кнопа при температуре 22±1 °С. Контрольные растения использовали в возрасте 7.5 суток (К). Для обогащения сахарами растения выращивали на 12%-ом растворе сахарозы, концентрация которой является оптимальной для эффективного закаливания озимой пшеницы при низкой температуре (Tumanov, 1979). На закаливание и обработку сахарами растения помещали в возрасте 7 суток (До обр). Растения выращивали при 22 °С в течение 7 суток на 12%ом растворе сахарозы (К+Сах) или закаливали в темноте при 2 °С в течение 7 суток в отсутствие (Зак) или в присутствии 12%-ой сахарозы (Зак+Сах). Растения в возрасте 7.5 суток соответствовали по ростовым параметрам закаленным 14-ти суточным растениям. В качестве дополнительного контроля (для анализа скорости роста и содержания углеводов) использовали 14-ти суточные растения (К,14), соответствующие по физиологическому возрасту закаленным растениям и растениям, выращенным на растворе сахарозы. Ингибирование роста определяли с помощью замера длины побегов 7-ми суточных растений до закаливания и обработки сахарозой и через 7 суток после закаливания при 2 °С и/или выращивания на растворе сахарозы. Контролем служили 14-ти суточные этиолированные растения, выращенные при 22±1 °С на ½ растворе Кнопа. Для определения угнетения ростовых процессов определяли степень ингибирования роста побегов (I, %) по формуле: (∆Lk - ΔLt)/ ΔLk×100%, где ΔLk – средний прирост побегов, не подвергнутых обработке; ΔLt – средний прирост побегов, подвергнутых обработке (Ivanov, 1974).
Содержание водорастворимых углеводов в этиолированных листьях определяли с использованием 0.2% антрона в концентрированной H2SO4 (Dishe, 1967). Для анализа содержания водорастворимых углеводов использовали калибровочную кривую, построенную по сахарозе.
Митохондрии из этиолированных листьев выделяли с помощью дифференциального центрифугирования и очищали в градиенте перколла по ранее описанной методике (Borovik et al., 2013) с изменением рН среды гомогенизации с 8.0 до 7.5. Для определения интактности выделенных митохондрий определяли проницаемость наружной мембраны митохондрий для экзогенного цитохрома с (Shugaev et al., 2012) в отсутствие и в присутствии детергента 0.04% Тритона Х-100.
Окислительную активность выделенных митохондрий регистрировали полярографически с платиновым электродом закрытого типа (электрод Кларка) в ячейке объемом 1.4 мл на полярографе ОН-105 (“Radelkis”, Венгрия) и Oxytherm system (“Hansatech Inst.”, Англия) при температуре 26 °С. Среда инкубации содержала 18 мМ КН2РО4 (рН 7.4), 300 мМ сахарозу, 125 мМ KCl, 5 мМ ЭДТА и 0.3% БСА. В качестве субстратов окисления использовали 10 мМ малат в присутствии 10 мМ глутамата, 8 мМ сукцинат в присутствии 5 мМ глутамата, 1 мМ НАД∙Н и 1 мМ НАДФ∙Н. Глутамат добавляли для устранения оксалоацетатного ингибирования. При окислении НАД∙Н и НАДФ∙Н из среды инкубации исключали ЭДТА и вносили 3 мкМ ротенон (ингибитор транспорта электронов через комплекс I дыхательной цепи) и 0.06 мМ Ca2+ (активатор ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ). Конечная концентрация АДФ в ячейке была 100 мкМ. Способность АО к транспорту электронов оценивали как скорость поглощения кислорода в состоянии 3, резистентную к 1.2 мМ цианиду калия (KCN) и ингибируемую 3 мМ бензгидроксамовой кислотой (БГК). Транспорт электронов через цитохромоксидазу (ЦО) оценивали как скорость поглощения кислорода в состоянии 3, ингибируемую 1.2 мМ KCN.
Проводили не менее трех независимых экспериментов. Представлены средние арифметические значения и их стандартные отклонения.
RESULTS AND DISCUSSION
Ингибирование роста
Выращивание растений на 12%-ом растворе сахарозы при 22 °С приводило к ингибированию роста побегов на 20% (Рис. 1). Холодовое закаливание, как в присутствии, так и в отсутствие сахарозы, приводило почти к полному ингибированию роста растений (на 96.4 и 93.8%, соответственно). При этом закаленные растения по длине побегов соответствовали 7.5 суточным контрольным растениям (Рис. 1). Торможение ростовых процессов у растений в условиях низких температур определяет успешность формирования устойчивости к низким температурам (Tumanov,
Trunova, 1958). Однако ингибирование роста происходит не только в результате понижения температуры, но и за счет накопления в тканях сахаров (Tumanov, Trunova, 1958).
Содержание водорастворимых углеводов
Содержание водорастворимых углеводов в листьях этиолированных растений озимой пшеницы при выращивании при 22 °С снижалось с возрастом растений (Рис. 2). Если у 7-ми суточных растений содержание сахаров в листьях составило 6.2%, то у 14-ти суточных всего 2.1%. Этиолированные растения в контрольных условиях выращивания обладали высокой способностью поглощать сахара из среды выращивания. Об этом свидетельствует повышение содержания водорастворимых углеводов в листьях при выращивании растений на растворе сахарозы (с 6.2% до 18%). Закаливание растений также характеризовалось увеличением содержания сахаров в листьях (Рис. 2). Наибольшее содержание водорастворимых углеводов наблюдали при закаливании на растворе сахарозы (18.4%), хотя при закаливании в отсутствие сахарозы также происходило накопление водорастворимых углеводов (до 10.6%), что вероятно, было связано с поступлением сахаров в листья в результате гидролиза крахмала эндосперма зерновки. Ранее было показано, что при закаливании на растворах сахарозы, рафинозы и мальтозы происходит их поглощение из наружного раствора, они проникают в клетки, превращаются в другие формы сахаров, благодаря чему общий пул сахаров возрастает (Trunova, 1972). Повышение содержания водорастворимых углеводов при закаливании является необходимым условием для эффективного повышения морозоустойчивости растений (Trunova, 1972).
Окислительная активность митохондрий и функционирование альтернативной оксидазы и ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ
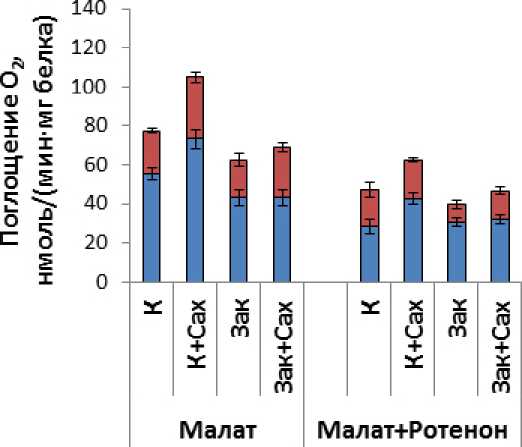
Окислительную активность митохондрий и функционирование альтернативной оксидазы и ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ изучали на очищенных в градиенте перколла митохондриях из этиолированных листьев озимой пшеницы. Выделенные митохондрии характеризовались высокой степенью интактности внешней митохондриальной мембраны (86-88%) и способностью окислять все используемые субстраты дыхания (малат, малат в присутствии ротенона, сукцинат, НАД∙Н и НАДФ∙Н) (Рис. 3). Наибольшая величина коэфициента дыхательного контроля по Чансу-Вильямсу (Chance and Williams, 1956) была характерна для митохондрий, изолированных из листьев контрольных растений, при окислении малата (1.90±0.04).
Как видно из Рис. 3, митохондрии из листьев контрольных растений с наибольшей скоростью окисляли малат и экзогенный НАД∙Н и с наименьшей – малат в присутствии ротенона. Способность митохондрий окислять малат в присутствии ингибитора комплекса I дыхательной цепи – ротенона, свидетельствует об активности ротенон-нечувствительных «внутренних»
НАД(Ф)∙Н-дегидрогеназ, а способность митохондрий окислять экзогенные НАД∙Н или НАДФ∙Н в присутствии ротенона и Ca2+ в отсутствие в среде инкубации хелатирующего агента – о функционировании «внешних» НАД∙Н- и НАДФ∙Н-дегидрогеназ (Møller, 2001). С использованием ингибиторов ЦО и АО – KCN и БГК, соответственно, показано, что в митохондриях из этиолированных листьев озимой пшеницы функционирует цианид-резистентное дыхание, которое ингибируется БГК – ингибитором АО. Как оказалось, наибольший вклад в дыхание АО вносит при окислении митохондриями малата и малата в присутствии ротенона (Рис. 3).
Выращивание растений на растворе сахарозы при 22 °С, а также закаливание при 2 °С в присутствии и в отсутствие сахарозы, влияло на дыхательную активность митохондрий и изменяло вклад АО и ЦО в дыхание (Рис. 3). Наиболее существенные изменения наблюдали при выращивании этиолированных растений на растворе сахарозы в контрольных условиях (22 °С). В этих условиях отмечено увеличение скоростей дыхания при окислении всех используемых субстратов и увеличение вклада в дыхание как ЦО, так и АО. Увеличение скорости дыхания при окислении малата (в 1.4 раза) происходило за счет увеличения (в равной степени) вклада в дыхание путей, связанных с функционированием ЦО и АО. При окислении малата в присутствии ротенона увеличение скорости дыхания (в 1.3 раза) происходило за счет вклада в дыхание ЦО. Увеличение скорости окисления сукцината (в 1.5 раза) было обусловлено увеличением вклада в дыхание АО (в 2.6 раза). При окислении НАД∙Н и НАДФ∙Н скорости дыхания митохондрий увеличивались в 1.7 и 1.9 раза, соответственно. Такое существенное увеличение скоростей окисления происходило за счет активации и ЦО и АО, однако в большей степени АО (если вклад в дыхание ЦО увеличивался в 1.3 и 1.7 раза, то вклад в дыхание АО – в 2.9 и 2.5 раза, при окислении НАД∙Н и НАДФ∙Н, соответственно). Как следует из полученных данных, функционирование «внутренних» НАД(Ф)∙Н-дегидрогеназ в митохондриях из листьев растений, выращенных в контрольных условиях на растворе сахарозы, было сопряжено с функционированием ЦО, а не АО. В то же время функционирование «внешних» ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ в митохондриях в этих условиях в большей степени сопряжено с активностью АО. Можно сделать вывод, что активность АО и «внешних» НАД(Ф)∙Н-дегидрогеназ в контрольных условиях выращивания растений озимой пшеницы определяется углеводным статусом. Полученные данные согласуются с имеющимися в литературе данными о положительной корреляции углеводного статуса растений и скорости дыхания и вклада в дыхание АО (Azcon-Bieto et al., 1983; Noguchi, 2005). В дальнейшем необходимо было выяснить сохраняется ли такая тенденция при действии на растения низких температур.
Длительное действие на растения низкой положительной температуры (2 °С, 7 суток)
(холодовое закаливание) приводило к значительным изменениям в скорости дыхания изолированных из листьев этих растений митохондрий. Закаливание растений в отсутствие сахарозы в среде выращивания снижало скорости дыхания изолированных митохондрий при окислении малата и малата в присутствии ротенона (на 19 и 16%, соответственно) (Рис. 3). Функционирование «внутренних» НАД(Ф)∙Н-дегидрогеназ в этих условиях снижалось за счет снижения активности АО (на 52%). Скорость окисления митохондриями сукцината, НАД∙Н и НАДФ∙Н не изменялась, однако при окислении сукцината было отмечено некоторое снижение вклада в дыхание ЦО (на 22%).
При закаливании растений на растворе сахарозы дыхательная активность изолированных из листьев митохондрий не изменялась при окислении всех изученных субстратов дыхания, за исключением экзогенного НАДФ∙Н, по сравнению с митохондриями из листьев контрольных растений (Рис. 3). Однако если сравнивать скорости дыхания митохондрий из листьев закаленных на растворе сахарозы и контрольных растений, выращенных на растворе сахарозы, то закаливание существенно снижало скорости дыхания митохондрий (Рис. 3). В то же время закаливание растений на растворе сахарозы сопровождалось перераспределением потока электронов между ЦО и АО в сторону увеличения их транспорта через АО. Такую ситуацию можно наблюдать при окислении митохондриями малата, сукцината и НАД∙Н (Рис. 3). Так, при окислении малата наблюдали увеличение дыхания через АО в 1.2 раза. При окислении сукцината увеличение скорости дыхания через АО (в 2.1 раза) было связано со снижением скорости дыхания через ЦО (на 31%), а при окислении НАД∙Н вклад ЦО в дыхание снижался на 25.6%, а вклад АО возрастал в 1.7 раза. Усиление дыхания при окислении НАДФ∙Н было связано с увеличением вклада в дыхание АО (в 1.8 раза). Таким образом, в условиях низких температур при высоком содержании водорастворимых углеводов активность «внешних» НАД(Ф)∙Н-дегидрогеназ сопряжена с активностью АО.
Известно, что гликолиз, цикл Кребса и цитохромный путь транспорта электронов – основной путь дыхания в листьях растений (Semikhatova, Chirkova, 2001). Показано, что при понижении внешней температуры снижается скорость транспорта электронов через цитохромный путь дыхания и активируется их транспорт по альтернативному пути (Ribas-Carbo et al ., 2000; Armstrong et al , 2008; Mizuno et al ., 2008). Как следует из наших данных, обеспеченность клеток сахарами – основными субстратами дыхания – влияет на дыхание митохондрий и транспорт электронов через цитохромный и альтернативный пути при низкой температуре. С использованием этиолированных растений озимой пшеницы нами выявлена зависимость функционирования АО и ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ в митохондриях листьев от содержания сахаров.
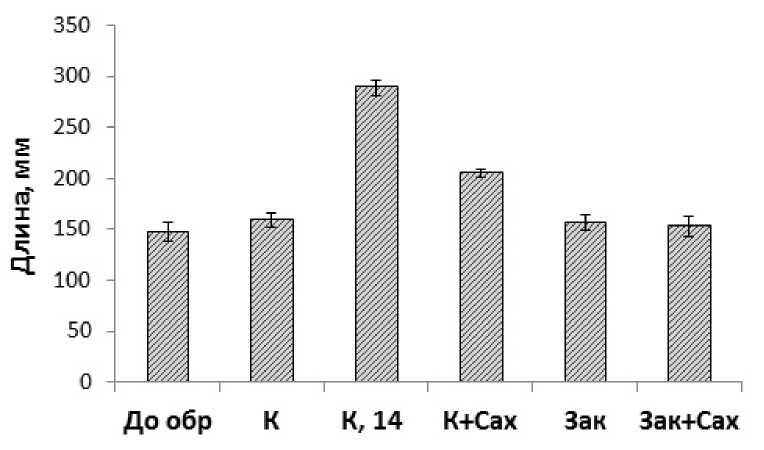
Рисунок 1. Влияние сахарозы и низкой температуры на рост этиолированных растений озимой пшеницы.
Обозначения: До обр – растения до закаливания и обработки сахарозой; К – контрольные растения, выращенные при 22 °С в течение 7.5 суток; К,14 – растения, выращенные при 22 °С в течение 14 суток; К+Сах –растения, выращенные при 22 °С на 12%-ом растворе сахарозы; Зак – растения, закаленные при 2 °С; Зак+Сах – растения, закаленные при 2 °С на 12%-ом растворе сахарозы. n=3-5. M±S.D.
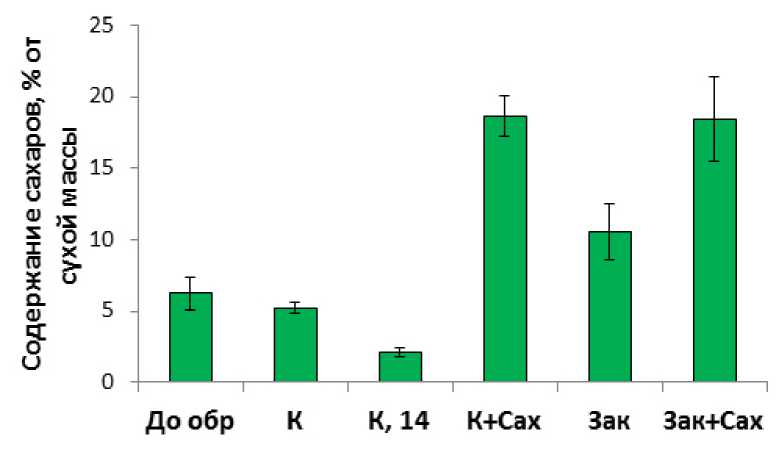
Рисунок 2. Влияние сахарозы и низкой температуры на содержание водорастворимых углеводов в листьях. n=3-8. M±S.D.
DAO
D ЦО
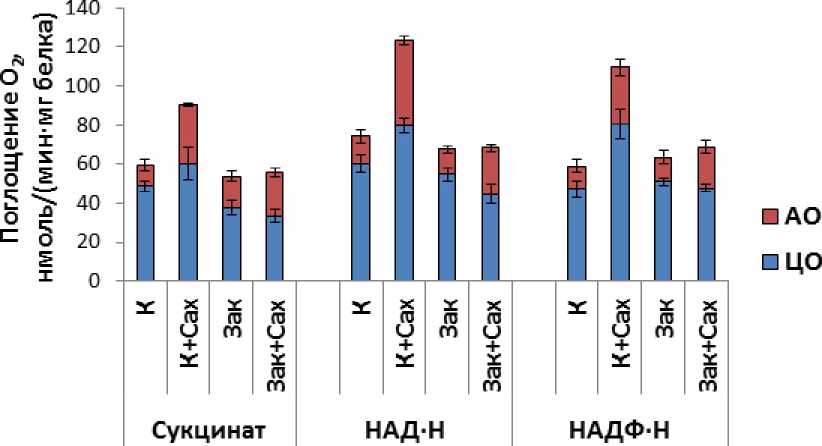
Рисунок 3. Влияние сахарозы и низкой температуры на скорость поглощения кислорода митохондриями в состоянии 3 и функционирование альтернативной оксидазы и ротенон-нечувствительных НАД(Ф)∙Н-дегидрогеназ.
Обозначения: Малат – 10 мМ малат в присутствии 10 мМ глутамата; Малат+Ротенон – 10 мМ малат в присутствии 10 мМ глутамата и 3 мкМ ротенона; Сукцинат – 8 мМ сукцинат в присутствии 5 мМ глутамата и 3 мкМ ротенона, НАД∙Н – 1 мМ НАД∙Н в присутствии 3 мкМ ротенона и 0.06 мМ Ca2+; НАДФ∙Н – 1 мМ НАДФ∙Н в присутствии 3 мкМ ротенона и 0.06 мМ Ca2+. n=3-6. M±S.D.
Содержание водорастворимых углеводов влияло на функционирование в митохондриях «внешних» НАД(Ф)∙Н-дегидрогеназ как в контрольных условиях выращивания, так и при закаливании растений в условиях низкой положительной температуры. Установлено, что благодаря высокому содержанию сахаров, активность «внешних» НАД(Ф)∙Н-дегидрогеназ и АО поддерживается на высоком уровне. Можно предположить, что в условиях доступности субстратов дыхания при действии на растения низкой температуры функционирование в митохондриях «внешних» НАД(Ф)∙Н-дегидрогеназ и АО способствует поддержанию необходимого уровня НАД(Ф)+ в цитозоле, что позволяет нормально функционировать НАД(Ф)+-зависимым дыхательным ферментам и обеспечивать необходимый уровень устойчивости растений к низкой температуре.
Список литературы The influence of carbohydrate status and low temperature on the respiratory metabolism of mitochondria from etiolated leaves of winter wheat
- Armstrong A.F., Badger M.R., Day D.A., Barthet M.M., Smith P.M., Millar A.H., Whelan J. and Atkin O.K. (2008) Dynamic changes in the mitochondrial electron transport chain underpinning cold acclimation of leaf respiration. Plant, Cell and Envir., 31, 1156-1169
- Azcon-Bieto J., Lambers H. and Day D.A. (1983) Effect of photosynthesis and carbohydrate status on respiratory rates and the involvement of the alternative pathway in leaf respiration. Plant Physiol., 72, 598-603
- Blokhina O. and Fagerstedt K.V. (2010) Reactive oxygen species and nitric oxide in plant mitochondria: origin and redundant regulatory systems. Physiol. Plant., 138, 447-462
- Borovik O.A. (2014) The alternative enzymes of the mitochondrial respiratory chain are involved in the development of winter wheat frost-resistance. In the World of Scientific Discoveries , 8(56), 7-21
- Borovik O.A., Grabelnych O.I., Koroleva N.A., Pobezhimova T.P., Voinikov V.K. (2013) The relationships among an activity of the alternative pathway respiratory flux, a content of carbohydrates and a frost-resistance of winter wheat. J. Stress Physiol. & Biochem. , 9, 241-250
- Chance B.W. and Williams V.R. (1956) The respiration chain and oxidative phosphorylation. Adv. Enzymol., 17, 65-152
- Cvetkovska M. and Vanlerberghe G.C. (2013) Alternative oxidase impacts the plant response to biotic stress by influencing the mitochondrial generation of reactive oxygen species. Plant Cell Envir., 36, 721-732
- Dishe Z. (1967) Obshhie cvetnye reakcii. pod red. Kochetkova N.K. Metodi himii uglevodov. M: Mir , S. 21-24
- Elhafez D., Murcha M.W., Clifton R., Soole K.L., Day D.A. and Whelan J. (2006) Characterization of mitochondrial alternative NAD(P)H dehydrogenases in Arabidopsis: interaorganelle location and expression. Plant Cell Physiol., 47, 43-54
- Finnegan P.M, Soole K.L. and Umbach A. (2004) Alternative mitochondrial electron transport proteins in the higher plants. In Day D.A., Millar A.H. and Whelan J. (ed.), Plant mitochondria: from genome to function. Dordrecht: Kluwer Academic Publishers, pp. 163-230
- Golovko T.K. (1999) Dykhanie rasteniy (fiziologicheskie aspekty). SPb.: Nauka , 204 s
- Grabelnych O.I., Borovik O.A., Tauson E.L., Pobezhimova T.P., Katyshev A.I., Pavlovskaya N.S., Koroleva N.A., Lyubushkina I.V., Bashmakov V.Yu., Popov V.N., Borovskii G.B. and Voinikov V.K. (2014) Mitochondrial energy dissipating systems (alternative oxidase, uncoupling proteins, and external NADH dehydrogenase) are involved in development of frost-resistance of winter wheat seedlings. Biochem. (Moscow), 79, 506-519
- Grant N.M., Miller R.E., Watling J.R. and Robinson S.A. (2008) Synchronicity of thermogenic activity, alternative pathway respiratory flux, AOX protein content, and carbohydrates in receptacle tissues of sacred lotus during floral development. J. Exp. Bot., 59, 705-714
- Ivanov V.B. (1974) Kletochnye osnovy rosta rasteniy. M.: Nauka , 223 s
- Jacoby R.P., Li L., Huang S., Lee C.P., Millar A.H. and Taylor N.L. (2012) Mitochondrial composition, function and stress response in plants. J. Int. Plant Biol., 54, 887-906
- Li C.-R., Liang D.-D., Li J., Duan Y.-B., Li H., Yang Y.-C., Qin R.-Y., Li L., Wei P.-C. and Yang J.-B. (2013) Unravelling mitochondrial retrograde regulation in the abiotic stress induction of rice alternative oxidase 1 genes. Plant, Cell and Envir., 36, 775-788
- Maxwell D.P., Wang Y. and McIntosh L. (1999) The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells. Proc. Natl. Acad. Sci. USA, 96, 8271-8276
- Mizuno N., Sugie A., Kobayashi F. and Takumi S. (2008) Mitochondrial alternative pathway is associated with development of freezing tolerance in common wheat. J. Plant Physiol., 165, 462-467
- Møller I.M. (2001) Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species. Annu. Rev. Plant Physiol. Plant Mol. Biol., 52, 561-591
- Noguchi K. (2005) Effects of light intensity and carbohydrate status on leaf and root respiration. Plant Respiration: From Cell to Ecosystem, Springer, Hamburg, pp. 63-83
- Ribas-Carbo M., Aroca R., Gonzalez-Meler M.A., Irigoyen J.J. and Sanchez-Dıaz M. (2000) The electron partitioning between the cytochrome and alternative respiratory pathways during chilling recovery in two cultivars of maize differing in chilling sensitivity. Plant Physiol., 122, 199-204
- Semikhatova O.A., Chirkova T.V. (2001) Fiziologiya dykhaniya rasteniy. SPb.: Izd-vo S.Peterb. un-ta , 224 s
- Shugaev A.G., Lashtabega D.A., Belozerova N.S., Generozova I.P. (2012) Metody vydeleniya mitokhondriy rasteniy i opredelenie ikh intaktnosti. Pod red. Vl.V. Kuznetsova, V.V. Kuznetsova, G.A. Romanova, Molekulyarno-geneticheskie i biokhimicheskie metody v sovremennoy biologii. M.: BINOM. Laboratoriya znaniy , S. 448-456
- Smith C., Barthet M., Melino V., Smith P., Day D. and Soole K. (2011) Alterations in the mitochondrial alternative NAD(P)H dehydrogenase NDB4 lead to changes in mitochondrial electron transport chain composition, plant growth and response to oxidative stress. Plant Cell Physiol., 52, 1222-1237
- Tan Y.-F., Millar A.H. and Taylor N.L. (2012) Components of mitochondrial oxidative phosphorylation vary in abundance following exposure to cold and chemical stresses. J. Proteome Res., 11, 3860-3879
- Trunova T.I. (1972) Sakhara kak odin iz faktorov, povyshayushchikh morozoustoychivost' rasteniy. Izvestiya Akademii nauk SSSR. Seriya biologicheskaya , 2, 185-196
- Tumanov I.I. (1979) Fiziologija zakalivanija i morozostojkosti rastenij. M: Nauka , 352 s
- Tumanov I.I., Trunova T.I. (1958) Vliyanie rostovykh protsessov na sposobnost' k zakalivaniyu tkaney ozimykh rasteniy. Fiziologiya rasteniy , 5, 112-122
- Vanlerberghe G.C. (2013) Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants. Int. Mol. Sci., 14, 6805-6847
- Wagner A.M., Krab K., Wagner M.J. and Moore A.L. (2008) Regulation of thermogenesis in flowering Araceae: The role of the alternative oxidase. Biochim. Biophys. Acta, 1777, 993-1000


