The method of increasing the thermostability of filled polymers
Автор: Prokopchuk Nikolay Romanovich, Lenartovich Liliya Alekseevna
Журнал: НБИ технологии @nbi-technologies
Рубрика: Технико-технологические инновации
Статья в выпуске: 3 (18), 2015 года.
Бесплатный доступ
The individual contribution of stabilizers and fillers into the increase of thermal stability of a polymer-matrix of composite materials at their joint presence in the composite is estimated in this paper. The increase of thermal stability of polypropylene composites in the process of pre-saturation of the surface of fillers by thermal stabilizers compared to their individual introduction into the polymer is determined. A method of saturation of the surface of fillers by stabilizers is proposed. The mechanism of a prolonged and direct action of stabilizers desorbing from the surface of the filler is explained. It leads to the increase of the thermal stability of stabilized filled polypropylene compositions obtained by the proposed method by 10-40 % in comparison with the traditional one. It simultaneously reduces the amount of used stabilizers in 1.25 times.
Stabilizer, filler, polymer composite material, adsorption, polypropylene composites
Короткий адрес: https://sciup.org/14968403
IDR: 14968403 | УДК: 678.074 | DOI: 10.15688/jvolsu10.2015.3.6
Текст научной статьи The method of increasing the thermostability of filled polymers
DOI:
Полимер фенилон (один из представителей ароматических полиамидов) получают путем поликонденсации м -фенилендиамина и изофталевой кислоты. Его полимерные цепи состоят из большого числа звеньев, строение которых характеризуется формулой:
Фенилон входит в число термостойких, трудно окисляемых в атмосфере воздуха полимеров. Это свойство при наличии хороших механических характеристик обеспечивает ему высокую перспективность для практического применения.
Между тем в работах [4; 5] с помощью метода ЭПР установлено наличие реакции фенилона с агрессивным диоксидом азота. Легко протекая при комнатной температуре, эта реакция приводит к образованию стабильных иминоксильных радикалов. Инициатором является нитрозил-нитратная форма димера (NO+ONO2–), находящаяся в химическом равновесии с неполярной формой димеров: N2O4.
Строение стабильных радикалов [4; 5]
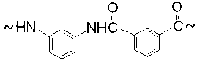
Первичным актом реакции является перенос электрона с NH-группы на катион NO+ с образованием оксида азота NO и полимерного катиона NH+. Катион отдает свой протон кислотному остатку NO3–, в результате чего образуется азотная кислота и свободный радикал (фениламидил I):
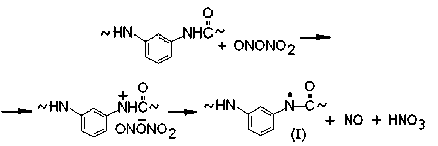
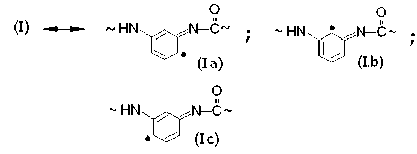
Для фениламидила характерно сопряжение p z-орбитали азота, несущей неспаренный электрон, с p z-орбиталями фенильного кольца. Это обеспечивает обратимую электронную таутомеризацию (I) ←→ (Ia) ←→ (Ib) ←→ (Ic) и появление свободных валентностей в орто-хиноидных структурах (Ia), (Ib) и в пара-хиноидной структуре (Iс):
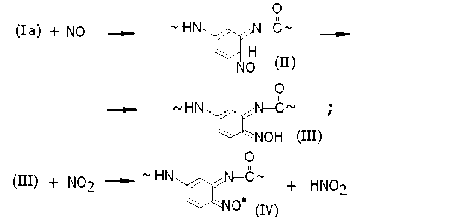
По этой причине оксид азота NO, образующийся одновременно с радикалами (I) – (Ic) (и тоже являющийся свободным радикалом) получает возможность вступать в акты «внутриклеточной» рекомбинации с каждым из указанных полимерных радикалов. Например, соответствующая радикалам (Ia) последовательность химических актов включает в себя промежуточное образование соединений (II), которые быстро изомеризуются в оксимы (III) со строением типа орто -бензохинона. Оксимы окисляются диоксидом азота с образованием полимерных иминоксильных радикалов (IV). Совокупность перечисленных актов соответствует химической схеме:
Радикалы (Ib) претерпевают сходные реакции рекомбинации с NO, последующего образования и окисления оксимов:
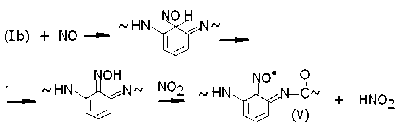
Эти иминоксилы тоже имеют строение типа орто -бензохинона.
Из радикалов (Ic) в результате сходных превращений образуются иминоксилы со строением типа пара -бензохинона:
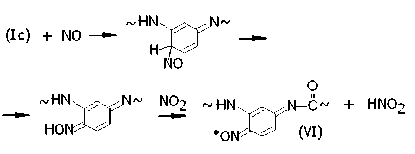
Согласно работам [4; 5], в процессе нитрования сначала наблюдается анизотропный триплетный сигнал радикалов (VI) с ЭПР-параметрами ANII = (4.8 ± 0. 1) мТл, gII = (2.0021 ± 0.0003) и AN ⊥ = (3.2 ± 0.1) мТ, g ⊥ = (2.0047 ± 0.0003). Этот сигнал постепенно исчезает вследствие образования непарамагнитного комплекса (VI ∙∙∙ NO2). Одновременно с этим растет анизотропный триплетный сигнал радикалов (IV), который становится превалирующим после 95 ч экспозиции. Ему соответствуют ЭПР-параметры: ANII = (4.1 ± ± 0.1) мТл, gII = (2.0024 ± 0.0003) и AN ⊥ = = (2.6 ± 0.1) мТ, g ⊥ = (2.0050 ± 0.0003).
Непарамагнитный комплекс (VI ∙∙∙ NO2) неустойчив и при вакуумировании образца до остаточного давления 10–3 мм Hg распадается с восстановлением сигнала радикалов (VI), который налагался на более интенсивный сигнал радикалов (IV).
После удаления газообразного диоксида азота из реакционной ампулы путем вакуумирования накопившиеся иминоксильные радикалы, среди которых превалируют (IV), сохраняют стабильность практически неограниченное время. То, что их спектры ЭПР представляют собой анизотропные триплеты, обусловлено затруднением в твердой фазе вращательных движений фрагментов полимерных цепей со свободными спинами [4; 5].
Рекомбинация макрорадикалов фени-ламидильного типа (I) с оксидом и диоксидом азота приводит к образованию валентно-насыщенных N-нитрозосоединений (VII) и N-нитритов (VIII):
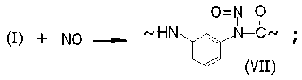
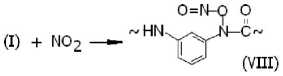
Накопление этих соединений в нитрованном фенилоне обнаруживается, во-первых, по изменению ИК-спектров (исчезает полоса при 3 340 см–1, принадлежащая валентным колебаниям NH-связей, и вырастают интенсивные полосы при 1 680 и 1 610 см–1, при- надлежащие нитритным группам в транс- и цис-структурах (VIII) соответственно [4; 5]). Во-вторых, их наличие обнаруживается по образованию стабильных радикалов иминок-сильного (IV) и арилациламиноксильного (IX) типов при нагревании (T = 100 oC) предварительно нитрованных образцов фенилона в вакууме.
В соответствии с ИК-спектрами [4; 5], интенсивность полос нитритного соединения (VIII) достаточно высока. Термический распад (100 oС) соединений (VII) и (VIII), как уже сказано, приводит к появлению интенсивного ЭПР-сигнала иминоксилов (IV) и значительно менее интенсивного сигнала полимерных арилациламиноксилов (IX):
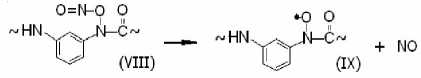
ЭПР-параметры радикалов (IX): ANII = = 1.94 мТл, gII = 2.003 ± 0.0003 [4].
Наличие слабых сигналов радикала (IX) свидетельствует о более высокой скорости распада соединения (VIII) по направлению к (I):
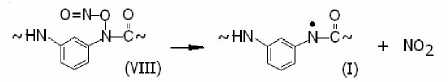
и низкой скорости распада по направлению к (IX).
Вслед за этими реакциями образующийся фениламидил (I) вступает в рассмотрен- ные выше реакции (через промежуточные электронные таутомеры (Ia), (Ib) , (Ic)) с оксидами азота NO и NO2, в результате которых в фенилоне происходит накопление стабильных радикалов, причем преимущественно иминоксилов (IV).
Экспериментальная часть
Использовали диоксид азота, полученный путем термического разложения нитрата свинца, и порошок коммерческого IT ёе- м -фениленизофталамида (фенилона), синтезированного путем поликонденсации м -фенилендиамина и изофталевой кислоты. Образцы (0.07 г) помещали в кварцевую ампулу с запорным краном для измерения спектров ЭПР. Ампулу присоединяли к колбе (объемом 0.5 л), встроенную в вакуумную установку, вакуумировали до ≈ 10–3 mm Hg и заполняли диоксидом азота до концентрации ≈ 10–3 моль/л. Концентрацию NO2 в газовой фазе определяли по оптической плотности при λ = 410 нм [4; 5], используя спектрометр «Specord UV-VIS». Методика ЭПР-измерений описана в исследованиях [4; 5]. Термогравиметрический анализ образцов исходного и нитрованного фенилона осуществляли на приборе «Perkin Elmer TGA-7» в атмосфере аргона в диапазоне температур 25–800 oС при скорости нагрева 20 K/мин.
Строение и свойства валентно-насыщенных продуктов нитрирования
Авторы работ [4; 5] не касались вопроса о природе каких-либо иных валентнонасыщенных продуктов нитрования фенилона, кроме соединений (VII) и (VIII). Между тем специфика реакций, установленных методом ЭПР и ведущих к радикалам (I) – (VI), позволяет схематически представить широкий набор продуктов нитрования, устойчивых при T комн. Так, взаимодействие макрорадикала (Iа) с NO2 должно сопровождаться реакциями образования ряда нитросоединений, которые в предельном случае соответствуют N-нитрозо- и N-нитритопроизводным тринитробензола:
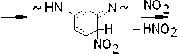
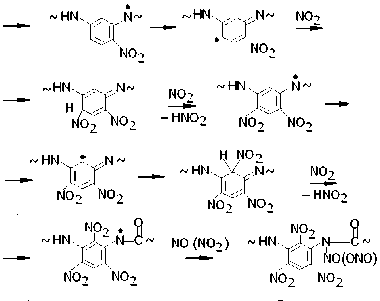
Аналогичные продукты образуются и в реакциях NO2 с макрорадикалами (Ib), (Ic).
Присоединение NO2 к фенильным кольцам может идти и через атом кислорода, приводя к производным пара - и орто -хиноними-нов, например:
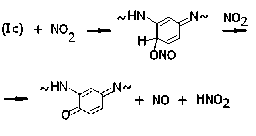
Кроме того, с образованием оксимов конкурирует реакция окисления их предшественников, в результате чего в пара- и ортоположениях фенильных колец появляются нитрозогруппы, например:
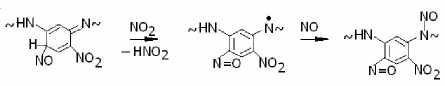
Накопление перечисленных продуктов нитрования весьма четко проявляется в изменении окраски фенилона. Изменение окраски наблюдали с использованием навесок порошкообразного фенилона массой ≈ 0.07 г (≈ 3 ∙ 10–4 моля). Соответствующие образцы помещали в кварцевые ампулы для ЭПР-спек-троскопии, которые заполняли газообразным диоксидом азота при объемной концентрации ≈ 10–3 моль/л.
Визуально уже в течение первого часа нитрования при Tкомн исходный порошок изменял окраску от белого шоколада до темно-коричневого шоколада. Это вполне соответствует суммарному спектру смеси образующихся продуктов реакции. Действительно, схематически рассмотренные продукты нитрования фенилона включают в себя фраг- менты замещенных производных нитро-, динитро-, тринитро-, нитрозо-бензолов, которые можно рассматривать как элементы полимерного раствора. Каждый из этих элементов имеет окраску. Так, сам по себе нитробензол окрашивает органические растворители в зеленый цвет, а нитрозогруппа придает органическому веществу сине-зеленую окраску [1; 2]. N-нитрозодифениламин (Ph)2N–NO существует в виде желто-зеленых кристаллов, а растворяясь в бензоле или спирте, окрашивает раствор в коричневый цвет [1].
Производные динитро- и тринитробензолов обладают сильными электроноакцепторными свойствами. Это обеспечивает им способность образовывать молекулярные аддукты с молекулами – донорами электрона (комплексы с переносом заряда, КПЗ). Образование КПЗ, например, между тринитропроизводными бензола и ароматическими молекулами – донорами электрона, сопровождается появлением полос поглощения света в видимой области спектра, отсутствующими в спектрах индивидуальных исходных молекул [3]. Естественно ожидать, что накопление электроноакцепторных нитрогрупп в фенилоне в ходе нитрования увеличивает вероятность образования КПЗ между тринитрофенильными группами и соседними фенильными группами, сохранившимися без нитрогрупп.
В итоге в ходе нитрования поверхность частиц фенилона принимает темную окраску вследствие наложения полос поглощения во всем видимом диапазоне спектра. Контрольный спектрофотометрический опыт провели с тонкими пленками, которые получили, окуная кварцевую пластинку в раствор фенилона в диэтилацетате. После высыхания пленки имели толщину ≈ 2 мкм. Их спектр регистрировали на спектрофотометре «Shimadzu UV mini–1240». В результате экспонирования в атмосфере NO2 оптическая плотность пленки выросла в интервале длин волн 200–700 нм, причем наиболее сильно в полосе поглощения нитропроизводных фенильных групп: 300–450 нм.
Наиболее важным последствием процесса образования валентно-насыщенных продуктов нитрования является то, что фенилон должен неизбежно потерять исходную высокую тер- мостойкость. Действительно, накапливающиеся в нем нитро- и нитрозогруппы должны рано или поздно исполнить роль локальных термически деструктивных (и даже способных к локальным взрывам) зон. (Отмечают, что и нитрозогруппы, по мере их накопления в молекуле вещества, придают ему свойство взрывчатости даже в большей мере, чем это характерно для полинитросоединений [2].)
Исходя из рассмотренного химизма нитрования, можно сделать заключение, что количество накапливающихся при T комн валентно-насыщенных фрагментов нитрования должно значительно превосходить количество стабильных радикалов, фиксируемых методом ЭПР. Действительно, согласно этому методу, при экспозиции образца фенилона с массой ≈ 0.07 г ( ≈ 3 ∙ 10–4 моля мономерных единиц) в атмосфере диоксида азота с концентрацией NO2, равной 3 ∙ 10–3 моль/л, в образце накопилось 0.6 ∙ 10–4 моль/кг иминокси-лов (IV). Нетрудно оценить, что в данном случае число свободных электронов в образце составляет 4.2 ∙ 10–9, или 1.4 ∙ 10–5 моль радикалов на моль звеньев.
При этом практически все стабильные радикалы образуются в реакциях с участием промежуточного продукта NO, концентрация которого существенно ниже концентрации исходного нитрующего агента “2NO2 ↔ O+N– ONO”, реагирующего и с цепными звеньями исходного фенилона, и с образующимися на цепях промежуточными соединениями. Поэтому естественно ожидать, что в фенилоне будут копиться преимущественно валентнонасыщенные продукты нитрования, причем в первую очередь в приповерхностных слоях твердых частиц по причине диффузионных ограничений. Именно об этом свидетельствуют данные термогравиметрии.
На рисунке приведены графики потери массы при нагревании образца фенилона, не подвергавшегося нитрованию (кривая 1 ), и претерпевшего нитрование при T комн в течение четырех суток (кривая 2 ). Перед термогравиметрическим анализом нитрованный образец был вакуумирован при давлении ≈ 10–3 мм Hg и прогрет при 98 oС в течение 5 часов. Потерю массы в ходе ТГА-анализа фиксировали в атмосфере аргона при скорости нагрева 20 K/мин.
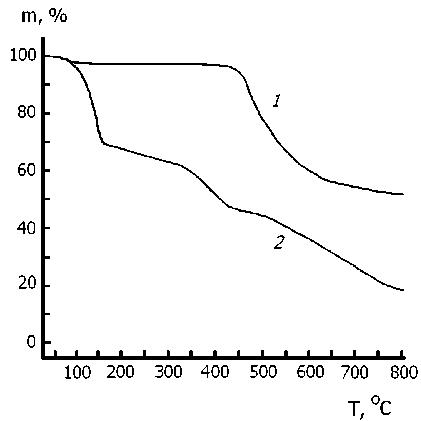
Потеря массы образцов фенилона по данным ТГА-анализа:
1 – исходный образец; 2 – нитрованный образец
Результат сопоставления кривых 1 и 2 (см. рисунок) весьма впечатляющий. Действительно, если исходный фенилон начинает разлагаться с потерей массы только при температуре 450 oС и теряет 30 % массы при 525 oС, то в результате нитрования в описанных выше условиях термическая деструкция начинается уже при 75 oС. При этом потеря массы образца на 30 % идет с большой скоростью, замедляясь при 150 oС. То, что замедление выражается в виде резкого изгиба на кинетической кривой, свидетельствует о накоплении термически неустойчивых групп в приповерхностных слоях частиц нитрованного фенилона. В температурном интервале 150–450 oС процесс термодеструкции исходного фенилона практически не детектируется (кривая 1 ). В том же интервале 150–450 oС (кривая 2 ) ТГА-анализ свидетельствует о потере массы еще на 30 %, то есть термодеструкция нитрованного фенилона захватывает и более глубокие слои нитрованных частиц.
Выводы
Теоретически и экспериментально показано, что под воздействием диоксида азота в полимере поли- м -фениленизофталами-де (фенилоне) накапливаются не только стабильные иминоксильные радикалы, но и
(главным образом) валентно-насыщенные нитро- и нитрозосоединения. Эти соединения являются причиной резкого снижения главной эксплуатационной характеристики фенилона, а именно его высокой термической устойчивости в тех средах, где нет окис-лов азота.
Список литературы The method of increasing the thermostability of filled polymers
- Babayan V.G., et al. The Accelerated Test Methods of Chemical Additives in Polymer Materials . Moscow, NIITEKHIM Publ., 1975. 31 p.
- Bulychev N.A. Study of Polymer Adsorption on the Surface of Inorganic Pigments by Infrared Spectroscopy. Materialovedenie, 2009, no. 10, pp. 2-9.
- Chatterjee A., Deopura B.L. Thermal Stability of Polypropylene/Carbon Nanofiber Composite. J. Appl. Polym. Sci., 2006, vol. 100, no. 5, pp. 3574-3578.
- Dzgaylis Ch. et al. Adsorption From Solutions on Solid Surfaces. Moscow, Mir Publ., 1986. 488 p.
- Greg C., Singh K. Adsorption. Specific Surface. Porosity. Moscow, Mir Publ., 1984. 306 p.
- Huang R., et al. High-Density Polyethylene Composites Reinforced With Hybrid Inorganic Fillers: Morphology, Mechanical and Thermal Expansion Performance. Materials, 2013, vol. 6, no. 9, pp. 4122-4413.
- Ivanova N.I. Adsorption of the Surfactant Mixture From the Aqueous Solutions on the Surface of Calcium Carbonate. Colloid Journal, 2000, vol. 62, no. 1, pp. 65-69.
- Kalinchev E.L., et al. Progressive Stabilization Technology of Polymer Products. Polym. mater., 2008, no. 7, pp. 3-14.
- Kandare E., et al. Probing Synergism, Antagonism, and Additive Effects in Poly(Vinyl Ester) (PVE) Composites With Fire Retardants. Polym. Degrad. and Stab., 2006, vol. 91, no. 6, pp. 1209-1218.
- Lenartovich L.A., et al. Mutual Influence of Fillers and Stabilizers in the Polymer Composite Materials. Trudy BSTU, 2011, no. 4, pp. 98-102.
- Malik J., Sidgi M. New Systems of Stabilizers in Polyolefin Water Pipes. Plastmassy, 2006, no. 10, pp. 36-39.
- Mashko T.L., Kalugin E.V. Impact of New Copper-Containing Supplements on the Thermal-Oxidative Stability of Polycaproamide. Plastmassy, 2006, no. 1, pp. 37-41.
- Pena J., et al. Interactions Between Carbon Black and Stabilizers in LDPE Thermal Oxidation. Polym. Degrad. and Stab., 2001, vol. 72, no. 1, pp. 163-174.
- Wilen C.E., Pfaendner R. Improving Weathering Resistance of Flame-Retarded Polymers. J. of Appl. Polym. Sci., 2013, vol. 129, no. 6, pp. 925-944.


