The role of sugar-related regulation in the light-dependent alterations of Arabidopsis glutamate dehydrogenase genes expression
Автор: Garnik E.Yu., Belkov V.I., Tarasenko V.I., Konstantinov Yu.M.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Expression of gdh1 and gdh2 genes of Arabidopsis thaliana increases in the dark and decreases in the light. The reason of such alteration seems to be a glucose rising in photosynthetic cell in the light, but this hypothesis needs to be confirmed. In this work we investigate the role of glucose and hexokinase 1 in the light-dependent regulation of the gdh1 and gdh2 expression. A comparison of expression profiles of apl3, gdh1, gdh2 genes in presenсe of exogenous sucrose in the dark and in the light has demonstrated that sugar-related repression of gdh1 and gdh2 genes is insufficient to provide the high decrease of their transcripts in the light. Using Arabidopsis mutant gin2-1 with a defect in hxk1 gene we demonstrated that such a decrease is not depended on the regulatory function of hexokinase 1. We presume that light- dependent alterations of gdh1 and gdh2 expression are mediated by some chloroplast-to-nucleus regulatory signals.
Arabidopsis thaliana, arabidopsis mutants, glutamate dehydrogenase, hexokinase 1, sugar sensing and signaling
Короткий адрес: https://sciup.org/14323912
IDR: 14323912
Текст научной статьи The role of sugar-related regulation in the light-dependent alterations of Arabidopsis glutamate dehydrogenase genes expression
Ядерные гены gdh1 и gdh2, кодирующие у арабидопсиса фермент митохондриальной локализации NAD-зависимую глутаматдегидрогеназу (GDH, EC 1.4.1.2), относятся к генам с циркадным типом регуляции. Количество их транскриптов возрастает в десятки раз в темное время суток и снижается в светлое (Turano et al., 2006). Механизмы, обусловливающие такой тип регуляции генов gdh1 и gdh2, не исследованы. В 2008 г. Miyashita с соавторами выдвинули версию, что GDH в растительной клетке играет роль «страховки» на случай углеводного голодания (Miyashita, Good, 2008). При этом предполагается, что посредником, обусловливающим репрессию данных генов на свету, является глюкоза, образующаяся в ходе фотосинтеза (Miyashita, Good, 2008). Единственным хорошо изученным посредником, передающим сигналы, возникающие при изменении уровня глюкозы в клетке растений, на сегодняшний день является гексокиназа 1 (HXK1). Однако ни роль HXK1, ни участие каких-либо иных известных регуляторных и сигнальных механизмов в регуляции экспрессии генов семейства gdh до сегодняшнего дня не исследовались.
Ранее нами было показано, что снижение уровня транскриптов генов gdh1 и gdh2 на свету требует присутствия функционально активных хлоропластов (Garnik et al ., 2013). Это может указывать на существование хлоропластноядерной регуляции экспрессии генов глутаматдегидрогеназы, однако не исключает и регуляторного влияния глюкозы как продукта фотосинтеза. В данной работе мы исследуем участие глюкозозависимой регуляции и роль HXK1 в светозависимых колебаниях экспрессии генов глутаматдегидрогеназы арабидопсиса.
MATERIALS AND METHODS
Растительный материал и условия выращивания. Семена Arabidopsis thaliana (L.) Heynh. экотип Columbia-0 (далее Col-0), экотип Landsberg erecta (далее Ler ), а также мутантной линии gin2-1 (CS6383) на основе экотипа
Landsberg erecta были получены из Arabidopsis Biological Resource Center (The Ohio State University, USA). Семена стерилизовали в растворе, cодержавшем 70 % этанола и 0,05% Triton X 100, в течение восьми минут, трижды промывали стерильной водой и раскладывали на стерильную плотную среду в чашках Петри, равномерно по всей поверхности среды либо только вдоль диаметра чашки (вертикальное выращивание). Среда для выращивания растений содержала: минеральные соли по Murasige, Skoog (Murasige, Skoog, 1962) – половинный состав, фитогель («Sigma-Aldrich», США) – 0,8%. В ряде экспериментов в среде присутствовала сахароза («Helicon», Россия) – 2%. После стратификации при +4 °С в течение трех суток чашки устанавливали в горизонтальном либо в вертикальном положении в ростовой камере, где проростки выращивали в течение 7 (горизонтальное выращивание) или 14 суток (вертикальное выращивание) при температуре 23 °С, освещенности 150 мкЕ и длине светового дня 16 ч.
Обработку растений 3% растворами маннитола («Sigma-Aldrich», США) и сахарозы («Helicon», Россия) проводили на 14-е сутки после окончания стратификации. Корни 14-суточных проростков, выращенных описанным способом и выдержанных в темноте в течение 24 ч до начала обработки, орошали 3% растворами сахарозы либо маннитола (контроль осмотических условий) и экспонировали на свету либо в темноте в течение четырех часов, после чего выделяли РНК из листовых пластинок.
Экстракция РНК. РНК экстрагировали из растительного материала при помощи TRI-Reagent («Sigma-Aldrich», США) согласно протоколу производителя. Гомогенизацию материала с TRIReagent проводили в гомогенизаторе TissueLyser («QIAGEN», США) в течение 2 мин при частоте 30 колебаний в секунду. Для денатурации белков использовали бромхлорпропанол («Sigma-Aldrich», США). Осаждение нуклеиновых кислот, растворение осадка РНК и анализ в агарозном геле проводили, как описано ранее (Tarasenko et al ., 2009).
Синтез первой цепи кДНК. Для удаления возможных примесей ДНК к 8 мкл препарата РНК добавляли 1 мкл 10х буфера ДНКазы («Fermentas», Литва) и 0.5 мкл (0.5 единиц) ДНКазы. Инкубировали 30 мин при 37 °С. Для инактивации ДНКазы добавляли в реакционную смесь 1 мкл ЭДТА (25 мкМ) и прогревали 10 мин при 65 °С. Добавляли 1 мкл праймера oligo-dT (80 рМ) и прогревали 5 мин при 70 °С, инкубировали 5 минут на льду. К смеси добавляли 4 мкл 5х буфера обратной транскриптазы («Fermentas», Литва), 0.5 мкл (20 единиц) ингибитора РНКаз («Fermentas», Литва), 2 мкл 10 мМ смеси dNTP. Инкубировали 5 мин при 37 °С. Добавляли 0.7 мкл (140 единиц) обратной транскриптазы Rever Aid H Minus M-MulV («Fermentas», Литва). Инкубировали 60 мин при 42 °С. Инактивировали фермент инкубацией 10 мин при 70 °С.
Обратно-транскриптазная ПЦР в реальном времени (ОТ-ПЦР-РВ). ОТ-ПЦР-РВ проводили с использованием готовой смеси реагентов SYBR
Select MasterMix («Applied Biosystems», США) и оборудования C1000 Thermal Cycler CFX96 RealTime System («Bio-Rad», США). Объем реакционной смеси составлял 10 мкл. ПЦР проводили по следующему протоколу: прогревание до 50 °С, 2 мин (согласно рекомендации производителя), один цикл денатурации (95 °С, 3 мин), 36 циклов амплификации (95 °С, 20 с -60 °С, 30 с - 72 °С, 30 с), после чего образцы подвергались нагреву до 95 °С для последующего анализа кривых плавления. Ген yls8 (AT5g08290) был использован как референсный (Hong et al ., 2010). Список всех использованных праймеров приведен в таблице 1 (табл. 1). Все праймеры были предварительно проверены путем анализа продуктов ПЦР-реакции в агарозном геле, каждая пара давала единственный продукт требуемого размера. Анализ результатов и построение графиков проводили при помощи программного обеспечения CFX ManagerTM Software Version 1.6 («Bio-Rad», США).
RESULTS
В первой серии экспериментов корни растений арабидопсиса линии дикого типа Col-0 обрабатывали 3% растворами сахарозы либо маннитола (контроль осмотических условий) на свету либо в темноте. Методом ОТ-ПЦР-РВ оценивали изменения экспрессии генов apl3 и gdh2. Выдерживание 14-суточных проростков в темноте в течение 24 ч приводило к снижению уровня транскриптов гена apl3 в 40-50 раз. Обработка корней выдержанных в темноте проростков 3% раствором сахарозы приводила к тому, что уровень транскриптов apl3 поднимался до уровня в необработанных растениях на свету и выше. Обработка раствором сахарозы корней проростков, экспонируемых на свету, приводила к повышению экспрессии apl3 в 20 раз и более (рис. 1А). Экспрессия гена gdh2 была наиболее низкой в проростках, экспонированных на свету. После выдерживания проростков в темноте уровень транскриптов gdh2 возрастал в 8-9 раз. Обработка корней таких проростков 3% раствором сахарозы приводила к снижению уровня транскриптов, оставаясь, однако, значительно выше уровня в необработанных проростках на свету (рис. 1Б).
Для следующей серии экспериментов использовали линию растений арабидопсиса gin2-1, мутантную по гену гексокиназы 1 hxk1. Уровень транскриптов гена hxk1 у 14-суточных проростков линии дикого типа Ler был выше на свету, чем в темноте (рис. 2). Выращивание проростков линии Ler в течение 7 суток на среде, содержащей 2% сахарозы, приводило к повышению уровня транскриптов гена hxk1 вдвое (рис. 3). У 14-суточных проростков линии gin2-1 не отмечали значимых изменений в экспрессии гена hxk1 при выдерживании в темноте и на свету. Присутствие в среде 2% сахарозы также не приводило к значимому изменению уровня экспрессии гена hxk1 у 7-суточных проростков линии gin2-1 (рис. 3).
Уровень транскриптов генов gdh1 и gdh2 у 14-суточных проростков обеих линий в темноте повышался в 10 и более раз по сравнению с образцами, экспонировавшимися на свету (рис. 4).
Таблица 1. Последовательности праймеров, использованных в работе.
|
Ген |
Локус |
Продукт |
Последовательность праймеров |
|
apl3 |
At4g39210 |
Большая субъединица АДФ-глюкозофосфорилазы |
Л: CGTGCGTCGGAGTATGGACTG П: AGATTTTGCTGCTTCTTGATGAGAC |
|
gdh1 |
At5g18170 |
альфа-субъединица NAD(H)-зависимой глутаматдегидрогеназы |
Л: CAGGGCAGCGTTTTGTCATCCA П: CGATACCATCCTTGTTCTTGATTGCT |
|
gdh2 |
At5g07440 |
бета-субъединица NAD(H)- зависимой глутаматдегидрогеназы |
Л: CGCTCTTGGTGGTGTCCTGAA П: CTCCTCCTGCGTTTGCGTAGA |
|
hxk1 |
At4g29130 |
гексокиназа 1 |
Л: ATGGATGGTGGATTGTTTGAGCAT П: AAGGTAGAGAGAGTGAGAAGCAGCA |
|
yls8 |
At5g08290 |
yellow-leaf-specific gene 8 (референсный ген) |
Л: GAGGTGCTTGCGTCTGTTGCT П: TGTCCTTGAGAGCCCAGTTGAT |
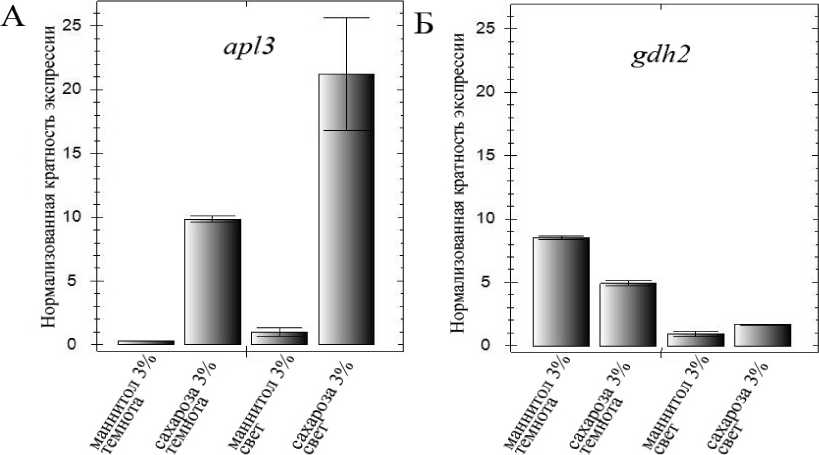
Рисунок 1 (А, Б). Уровень транскриптов генов apl3 и gdh2 в растениях линии дикого типа Col-0 в зависимости от условий освещения и присутствия экзогенной сахарозы.
Показаны результаты ОТ-ПЦР-РВ. Маннитол 3%, сахароза 3% - корни растений обработаны 3% раствором маннитола либо сахарозы за 4 часа до выделения РНК; темнота – в течение обработки маннитолом либо сахарозой растения экспонировали в темноте; свет – в течение обработки маннитолом либо сахарозой растения экспонировали на свету (освещенность 150 мкЕ). А – транскрипты гена apl3 , Б – транскрипты гена gdh2 .
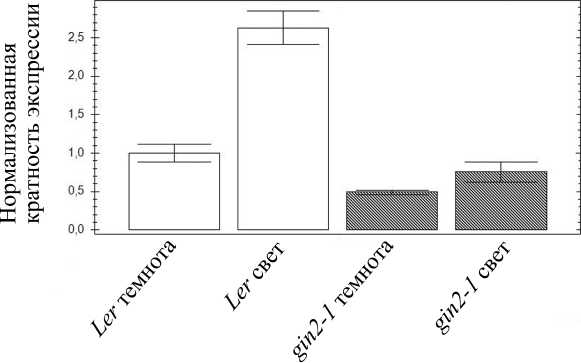
Рисунок 2. Уровень транскриптов гена hxk1 у растений линии дикого типа Ler и мутанта gin2-1 на свету и в темноте.
Показаны результаты ОТ-ПЦР-РВ. Время экспозиции на свету (освещенность 150 мкЕ) либо в темноте перед выделением РНК – 4 ч.
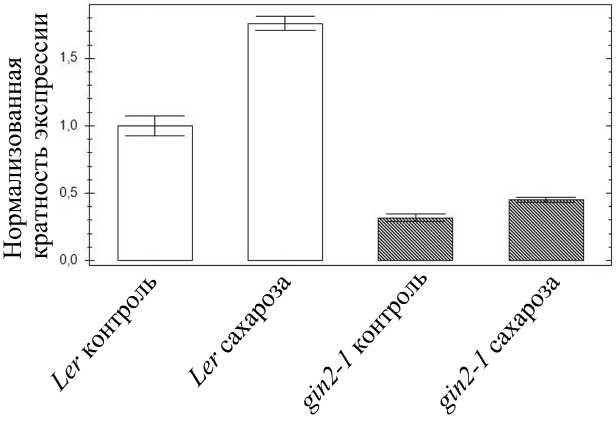
Рисунок 3. Уровень транскриптов гена hxk1 у растений линии дикого типа Ler и мутанта gin2-1 в отсутствие и в присутствии экзогенной сахарозы.
Показаны результаты ОТ-ПЦР-РВ. Растения выращивали на плотных питательных средах.
Контроль – сахароза в среде отсутствовала, сахароза 2% - среда содержала 2% сахарозы.
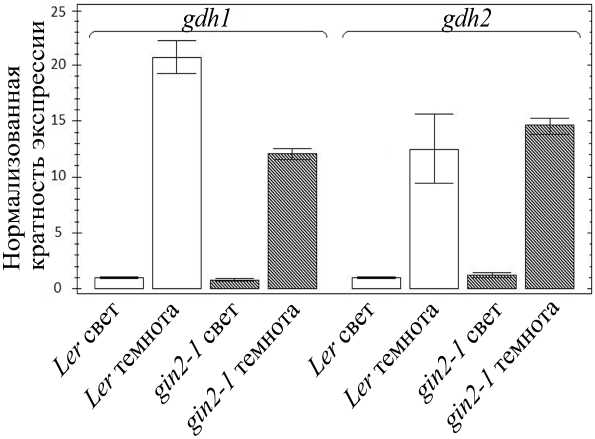
Рисунок 4. Уровень транскриптов генов gdh1 , gdh2 у растений линии дикого типа Ler и мутанта gin2-1 на свету и в темноте.
Показаны результаты ОТ-ПЦР-РВ. Растения экспонировали на свету (освещенность 150 мкЕ) либо в темноте в течение 4 ч перед выделением РНК.
DISCUSSION
На сегодняшний день единственным и общепринятым объяснением суточных изменений уровня транскриптов генов глутаматдегидрогеназы арабидопсиса является гипотеза сахарозависимой регуляции экспрессии этих генов. Хорошо известно, что причиной колебаний экспрессии этих генов в течение суток являются изменения освещенности (Turano et al., 1997). В 2008 г. Miyashita с соавторами провели серию экспериментов с нокаут-мутантами по генам gdh1 и gdh2 и установили, что двойной мутант gdh1-2/gdh2-1 значительно хуже переносил длительное выдерживание растений в темноте (6-12 суток) (Miyashita, Good, 2008). На этом основании, а также с учетом того, что продукт реакции, катализируемой GDH – 2-оксоглутарат – может быть введен в цикл трикарбоновых кислот и использован для получения энергии (Robinson et al., 1992), авторы выдвинули следующую версию: в темноте, при снижении уровня глюкозы в клетке гены GDH дерепрессируются (gdh2 в большей степени, gdh1 в меньшей), и повышение количества активного фермента GDH позволяет клетке использовать глутамат в катаболических реакциях (Miyashita, Good, 2008). Насколько нам известно, экспериментальная проверка этой гипотезы никогда не производилась. Единственным аргументом в пользу существования сахарозависимой репрессии генов глутаматдегидрогеназы арабидопсиса являются данные Li с соавторами, полученные при помощи ДНК-микрочипирования: в течение 2-6 часов после обработки 7-суточных проростков арабидопсиса 3% раствором глюкозы уровень транскриптов генов gdh1 и gdh2 снижался соответственно в 2 и 2,5 раза (Li et al., 2006).
В нашей работе обработка проростков арабидопсиса экзогенной сахарозой также приводила к некоторой репрессии генов gdh1 и gdh2. Однако достичь глубокой репрессии, сравнимой с репрессией этих генов на свету, не удалось. В качестве маркера уровня глюкозы в клетках растений мы использовали ген apl3. Он кодирует большую субъединицу АДФ-глюкозофосфорилазы, первого фермента пути биосинтеза крахмала, и его экспрессия индуцируется при повышении в клетке уровня глюкозы (Rook et al., 2006). Cоотнесение профилей экспрессии генов apl3 и gdh2 показало, что при обработке корней двухнедельных проростков линии дикого типа Col-0 3% раствором сахарозы сахарозависимая репрессия гена gdh2 действительно происходит, однако ее, по всей видимости, недостаточно для обеспечения колебаний уровня транскриптов генов глутаматдегидрогеназы в том масштабе, который имеет место при естественной смене светлого и темного времени суток (рис. 1А, 1Б).
Единственным хорошо изученным посредником, передающим сигналы, возникающие при изменении уровня глюкозы в клетке растений, на сегодняшний день является гексокиназа 1 (HXK1) (Hausler et al., 2014). После активирования глюкозой молекула HXK1 входит в состав высокомолекулярного ядерного комплекса, регулирующего транскрипцию через прямое связывание с промоторами соответствующих генов (Ramon et al., 2008). У растений арабидопсиса линии gin2-1 в результате мутации по гену hxk1 в большой степени или полностью отсутствует регуляторная функция HXK1. Это приводит к таким особенностям мутанта, как нечувствительность к высоким концентрациям глюкозы при прорастании семян и ослабленная репрессия ядерных генов, связанных с фотосинтезом, в присутствии экзогенной глюкозы (Moore et al., 2003). Поскольку HXK1 регулирует в том числе и транскрипцию своего собственного гена hxk1, активируя его при повышении уровня глюкозы в клетке (Price et al., 2004), отсутствие изменений уровня транскриптов hxk1 в присутствии сахарозы у растений gin2-1 в наших экспериментах подтверждает отсутствие у них регуляторной функции белка HXK1 (рис. 3). При этом совпадение профилей экспрессии генов глутаматдегидрогеназы у мутанта gin2-1 и растений дикого типа Ler на свету и в темноте свидетельствует о том, что светозависимые изменения экспрессии генов gdh1 и gdh2 происходят независимо от регуляторной активности HXK1. Поскольку в присутствии экзогенной сахарозы мы все же наблюдали частичное снижение уровня транскриптов gdh2 (рис. 1Б), нельзя исключить участие не связанных с HXK1 сахарозависимых регуляторных путей. Существование последних для растений известно (Price et al., 2004), однако механизмы подобной регуляции на сегодняшний день изучены слабо (Hausler et al., 2014).
Ранее нами было показано, что обработка клеток гетеротрофной суспензионной культуры либо растений арабидопсиса в темноте ингибитором митохондриального транспорта электронов антимицином А приводит к значительному повышению уровня транскриптов гена gdh2 (Tarasenko et al., 2009; Garnik et al., 2013). Из этого следует, что в регуляции экспрессии данного гена могут принимать участие ретроградные (в данном случае митохондриальноядерные) сигналы, однако пока нельзя сказать, имеет ли отношение обнаруженный нами ранее феномен митохондриально-ядерной регуляции гена gdh2 к регуляции светозависимых колебаний экспрессии генов глутаматдегидрогеназы.
Таким образом, в данной работе нами впервые показано, что светозависимая регуляция колебаний уровня транскриптов генов gdh1 и gdh2 арабидопсиса не опосредуется гексокиназой 1. Сахарозависимая репрессия данных генов, не связанная с HXK1, возможна, однако ее недостаточно для многократного снижения экспрессии, наблюдаемого при переносе растений из темноты на свет. Учитывая показанную нами ранее необходимость присутствия функциональных хлоропластов для снижения уровня транскриптов гена gdh2 на свету (Garnik et al., 2013), можно предполагать, что главную роль в обеспечении светозависимых изменений экспрессии данных генов играют регуляторные сигналы хлоропластно-ядерной природы.
ACKNOWLEDGMENT
Работа выполнена при финансовой поддержке грантов РФФИ 12-04-01148-а и 14-44-04001 р_сибирь_а. В работе использовано оборудование Байкальского аналитического центра (ЦКП) СО РАН при президиуме ИНЦ СО РАН.
Список литературы The role of sugar-related regulation in the light-dependent alterations of Arabidopsis glutamate dehydrogenase genes expression
- Garnik E.Yu., Belkov V.I., Tarasenko V.I., Potapova T.V., Korzun M.A., Konstantinov Yu.M. (2013) The expression of Arabidopsis glutamate dehydrogenase gene gdh2 is induced under the influence of tetrapyrrole synthesis inhibitor norflurazon. J. Stress Physiol. Biochem., 4, 299-309
- Hausler R., Heinrich L., Schmitz J., Flugge U.-I. (2014) How sugars might coordinate chloroplast and nuclear gene expression during acclimation to high light intensities. Molecular Plant, 7, 1121-1137
- Hong S.M., Bahn S.C., Lyu A., Jung H.S., Ahn J.H. (2010) Identification and testing of superior reference genes for starting pool of transcript normalization in Arabidopsis. Plant Cell Physiol., 51, 1694-1706
- Miyashita Y., Good A.G. (2008) NAD(H)-dependent glutamate dehydrogenase is essential for the survival of Arabidopsis thaliana during dark-induced carbon starvation. J. Exp. Bot., 59, 667-680
- Moore B., Zhou L., Rolland F., Hall Q., Cheng W.H., Liu Y.X., Hwang I., Jones T., Sheen J. (2003) Role of the Arabidopsis glucose sensor HXK1 in nutrient, light, and hormonal signaling. Science, 300(5617), 332-336
- Murashige T., Skoog F. (1962) Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant., 15, 473-497
- Price J., Laxmi A., St. Martin S.K., Jang J.-C. (2004) Global transcription profiling reveals multipler sugar signal transduction mechanisms in Arabidopsis. Plant Cell, 16, 2128-2150
- Ramon M., Rolland F., Sheen J. (2008) Sugar sensing and signaling. The Arabidopsis Book, 6:e0117 ( ) DOI: 10.1199/tab.0117
- Rook F., Handingham A., Li Y., Bevan M.W. (2006) Sugar and ABA response pathways and the control of gene expression. Plant Cell Environ., 29, 426-434
- Tarasenko V.I., Garnik E.Yu., Shmakov V.N., Konstantinov Yu.M. (2009) Induction of Arabidopsis gdh2 gene expression during changes in redox state of the mitochondrial respiratory chain. Biochemistry (Mosc.), 74(1), 47-53
- Turano F., Thakkar S., Fang T., Weisemann J. (1997) Characterization and expression of NAD(H)-dependent glutamate dehydrogenase genes in Arabidopsis. Plant Physiol., 113, 1329-1341


