Тимические эпителиальные опухоли
Автор: Барболина Т.Д., Аллахвердиев А.К., Владимирова Л.Ю., Деньгина Н.В., Козлов Н.А., Пикин О.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Тимома, рак тимуса, тимическая карцинома, опухоли средостения, опухоли вилочковой железы
Короткий адрес: https://sciup.org/140307384
IDR: 140307384 | DOI: 10.18027/2224-5057-2024-14-3s2-1.1-08
Текст статьи Тимические эпителиальные опухоли
Опухоль вилочковой железы — редкое заболевание, которое относится к опухолям средостения. Частота новообразований средостения в структуре онкологических заболеваний составляет не более 1%. Около 50% первичных опухолей переднего средостения являются тимомами. Это группа органоспецифичных эпителиальных опухолей вилочковой железы, обладающих сходным гистологическим строением, ИГХ профилем и вариабельной степенью злокачественности.
Опухоли тимуса подразделяются на 3 подгруппы: тимомы, тимические карциномы (син. — рак тимуса), нейроэндокринные новообразования. Этиология неизвестна. Клиническая картина неспецифична. Приблизительно от 30 до 50% пациентов с тимомами имеют симптомы миастении гравис.
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования наиболее широко используется классификация Masaoka–Koga, которая подходит как для тимом, так и для рака тимуса. Современная TNM система стадирования тимом и рака тимуса основана на объединенных данных Международной группы по изучению опухолей вилочковой железы (ITMIG — International Thymic Malignancy Interest Group) и Международной ассоциации по изучению рака легкого (IASLC–International Association for the study Lung Cancer). В клинической практике возможно использование обеих классификаций (табл. 1, 2, 3), но классификация по Masaoka–Koga более точно описывает микроскопическую инвазию опухоли, что определяет лечебную тактику.
Классификация TNM
Таблица 1. Применяется клиническая TNM классификация (8-е издание AJCC, 2018 г.) и послеоперационная классификация Masaoka–Koga
|
Первичная опухоль 1 |
|
|
Тх |
Первичная опухоль не может быть оценена |
|
Т0 |
Первичная опухоль не определяется |
|
Т1 |
Опухоль не вышла за пределы вилочковой железы или распространяется на медиастинальную клетчатку; может вовлекать медиастинальную плевру |
|
Т1а |
Медиастинальная плевра не вовлечена |
|
Т1b |
Медиастинальная плевра поражена |
|
Т2 |
Опухоль врастает в перикард (либо частично, либо на всю толщину) |
|
Т3 |
Опухоль вовлекает легкое, брахиоцефальную вену, верхнюю полую вену, диафрагмальный нерв, грудную клетку или распространяется экстраперикардиально на легочную артерию или вену |
|
Т4 |
Опухоль вовлекает аорту, интраперикардиально легочную артерию, миокард, трахею, пищевод |
|
Регионарные лимфатические узлы |
|
|
Nх |
Региональные лимфатические узлы не могут быть оценены |
|
N0 |
Нет метастазов в региональных лимфатических узлах |
|
N1 |
Наличие метастазов в передних (претимических) лимфатических узлах |
|
N2 |
Наличие метастазов в глубоких лимфатических узлах грудной клетки и шейных лимфатических узлах |
|
Отдаленные метастазы |
|
|
М0 |
Нет отдаленных метастазов |
|
М1 |
Есть отдаленные метастазы |
|
М1а |
Изолированное поражение плевры или перикарда |
|
М1b |
Внутрипаренхиматозные узлы в легком и отдаленные метастазы (печень, кости, головной мозг) |
1 Уровень инвазии для определения категории Т должен быть подтвержден микроскопически.
Таблица 2. Группировка тимом и рака тимуса по стадиям
|
Стадия |
T |
N |
M |
|
I |
Т1а, b |
N0 |
M0 |
|
II |
T2 |
N0 |
M0 |
|
IIIА |
T3 |
N0 |
M0 |
|
IIIВ |
T4 |
N0 |
M0 |
|
Стадия |
T |
N |
M |
|
IV А |
T любая |
N1 |
M0 |
|
T любая |
N0–1 |
M1a |
|
|
IV B |
T любая |
N2 |
M0-M1a |
|
T любая |
N любая |
M1b |
Таблица 3. Группировка тимом и рака тимуса по стадиям Masaoka–Koga
|
Стадия |
Критерий |
TNM стадия (эквивалент) |
|
I |
Микроскопически и макроскопически подтвержденное отсутствие выхода опухоли за капсулу железы, полностью инкапсулированная опухоль |
T1N0M0-I |
|
II |
(А) Микроскопическая транскапсулярная инвазия без вовлечения плевры и перикарда |
T1aN0M0-Ia |
|
(В) Макроскопическая инвазия в прилежащую жировую ткань без вовлечения медиастинальной плевры и перикарда |
T1aN0M0-Ia |
|
|
III |
(А) Макроскопическая инвазия в соседние органы: медиастинальная плевра, перикард, легкое, без инвазии в крупные сосуды |
T1bN0M0-Ib T2N0M0-II T3N0M0-IIIa |
|
(В) Макроскопическая инвазия в соседние органы: перикард, плевра, легкое, трахея, пищевод, миокард с инвазией в крупные сосуды |
T4N0M0-IIIb |
|
|
IV |
(А) Плевральная или перикардиальная диссеминация |
T любая N0–1M0–1a-IVa |
|
(В) Отдаленные лимфогенные и гематогенные метастазы |
T любая N любая M1b-IVb |
2. ДИАГНОСТИКА
Для определения тактики лечения необходимо проведение комплексного инструментального обследования с целью точного клинического стадирования болезни.
План обследования больных с тимомой или раком тимуса:
-
• сбор анамнеза и физикальный осмотр;
-
• определение ECOG;
-
• общий анализ крови (гемоглобин, общее число лейкоцитов, лейкоцитарная формула, тромбоциты);
-
• биохимический анализ крови (креатинин, мочевина, АЛТ, АСТ) и коагулограмма;
-
• антитела к антиацетилхолиновым рецепторам (АхР) в сыворотке крови для определения риска развития миастении гравис, даже в случае бессимптомного течения болезни;
-
• консультация невролога при подозрении или при наличии клиники миастении;
АФП, β-ХГЧ и ЛДГ — для исключения внегонадной герминогенной опухоли средостения;
КТ органов грудной клетки, брюшной полости и малого таза с в/в контрастированием; КТ органов грудной клетки с в/в контрастированием является стандартом уточняющей диагностики при опухолях средостения.
УЗИ шейно-надключичных, подключичных лимфатических узлов, органов брюшной полости и забрюшинного пространства для исключения отдаленных метастазов; радиоизотопное исследование скелета (при подозрении на поражение костей);
МРТ грудной клетки с контрастным усилением; выполнение МРТ позволяет дифференцировать сосудистые структуры средостения (в том числе сосудистые аномалии) от опухолевого поражения без применения дополнительных методик;
ЭКГ и Эхо-КГ — при поражении перикарда, миокарда;
ФБС даёт возможность выявить прорастание и обструкцию (сдавление, смещение) трахеи и бронхов; при наличии экзофитного компонента необходимо произвести биопсию тканей для морфологической верификации; при отсутствии прорастания стенки трахеи или бронха и при наличии деформаций возможна трансбронхиальная (трахеальная) пункционная биопсия;
трансторакальная биопсия опухоли средостения;
видеоторакоскопия проводится при невозможности выполнения и при неэффективности трасторакальной пункции, а также при необходимости исключить лимфому; ИГХ и/или ИЦХ исследование;
ПЭТ-КТ с ФДГ с целью первичного стадирования не рекомендуется, но является дополнительным методом в диагностике поражения плевры и в качестве контроля после проведенного лечения и перед планированием ЛТ;
МРТ с в/в усилением головного мозга — при подозрении на метастатическое поражение.
Послеоперационное морфологическое заключение имеет фундаментальное значение, так как на этом основывается выбор лечебной тактики. В морфологическом заключении рекомендуется отразить следующие параметры:
• гистологическое строение опухоли;
• размеры опухоли;
• расстояние до проксимального и дистального краёв резекции;
• степень дифференцировки опухоли;
• наличие/отсутствие поражения проксимального края резекции;
• наличие/отсутствие поражения дистального края резекции;
• наличие/отсутствие лимфоваскулярной, периневральной инвазии.
3. ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
Существовавшая в предыдущих версиях «тимома тип С» в настоящей классификации ВОЗ 2015 г. переименована в собирательную категорию «Рак тимуса». Гистологическая классификация представлена в табл. 4.
Таблица 4. Морфологическая классификация ВОЗ опухолей вилочковой железы (2015 г.)
|
Подтип |
Критерий (обязательный) |
Критерий (возможный) |
|
Тип А |
Веретеноклеточные или овальные клетки, без атипии или опухолевых лимфоцитов, соответствует медуллярному типу |
Эпителиальные клетки CD20+ |
|
Тип АВ |
Смешанный тип, схож с типом А, но отмечаются единичные очаги опухолевых лимфоцитов |
Эпителиальные клетки CD20+ |
|
Тип В1 |
Медуллярный тип, напоминает нормальный кортикальный слой тимуса с очагами включения клеток медуллярной дифференциации |
Тельца Хассала, периваскулярные пространства |
|
Тип В2 |
Кортикальный тип, содержит рассеянные опухолевые эпителиальные клетки с везикулярными включениями в ядре |
Медуллярные островки, тельца Хассала, периваскулярные пространства |
|
Тип В3 |
Эпителиальный тип, состоит преимущественно из эпителиальных клеток с умеренно выраженной атипией |
Тельца Хассала, периваскулярные пространства |
|
Карциномы тимуса |
Рак тимуса:
|
Плеоморфные эпителиальные клетки, актин, кератин |
|
Микронодулярная тимома |
Микронодулярная тимома с лимфоидной стромой |
Лимфоидные фолликулы, моноклональные В-клетки и/или плазматические клетки |
|
Метапластическая тимома |
Бифазная опухоль, состоящая из эпителиальных и веретенообразных клеток; отсутствуют Т-клетки |
Плейоморфизм эпителиальных клеток, актин-, кератин-или ЕМА-позитивные клетки |
|
Нейроэндокринные неоплазии |
• высокодифференцированный нейроэндокринный рак (карциноидные опухоли: типичный карциноид, атипический карциноид; низкодифференцированный нейроэндокринный рак: крупноклеточный нейроэндокринный рак, мелкоклеточный нейроэндокринный рак |
См. соответствующий раздел клинических рекомендаций |
К числу прогностических факторов относят гистологический тип, радикальность операции, интраоперационное нарушение целостности капсулы, стадию болезни, ответ на лечение, общесоматический статус по шкале ECOG.
Пятилетняя выживаемость у пациентов с опухолью тимуса достигается при локализованной стадии в 90–95% случаев. При поражении регионарных л/у — в 85–78%, а при наличии отдаленных метастазов — 25–35%.
Показатели 10-летней общей выживаемости в зависимости от стадии: I–II стадия 80–90%, III стадия — 30–40%. IV стадия — 0%.
При тимоме типа А, АВ и В1 показатели 5-летней ОВ составляют 100%. Эти же показатели при тимоме тип В2 и В3 составят 64–68%. Тогда как при тимической карциноме — 25–30%.
Радикальность операции значительно влияет на отдаленные результаты: 5-летняя ОВ при R0 I–II стадии составляет 90–100%, R0 III–IVa — 92%, при R1–2 III–IVa — 64%. При IVb стадии при отсутствии операции — 20–35%.
4. ЛЕЧЕНИЕ 4.1. I–II стадии по Masaoka–Koga (резектабельные) и местнораспространенная стадия IIIа 4.1.1. Хирургическое лечение
Абсолютным показанием к хирургическому лечению является I стадия. При II и более стадиях тактика лечения каждого пациента должна обсуждаться на междисциплинарном консилиуме. Принимая во внимание тот факт, что II стадия чаще устанавливается патоморфологом, то хирургический этап все же является приоритетным даже при наличии макроинвазии в окружающую клетчатку.
Гистологическая верификация опухоли до хирургического лечения не является обязательной, если по клинико-рентгенологическим данным опухоль абсолютно резек-табельна и имеется миастения гравис.
Лекарственное лечение миастении гравис должно начинаться как можно раньше, даже на предоперационном периоде, совместно с неврологом и соответствовать клиническим рекомендациям по диагностике и лечению миастении всероссийского общества неврологов.
Рекомендована дооперационная или интраоперационная (в случае выбора малоинвазивной методики оперирования) морфологическая диагностика для исключения лимфомы с поражением лимфатических узлов переднего средостение или тимуса. До начала хирургического лечения пациенты должны быть обследованы на предмет возможных симптомов миастении гравис с их медикаментозным контролем. Цель хирургического лечения — удаление опухолевой массы вместе с вилочковой железой. Может потребоваться резекция близлежащих структур: перикарда, плевры, легкого, диафрагмального нерва, крупных магистральных сосудов. Во время тимэктомии необходима ревизия плевры. Радикальная операция должна включать удаление опухоли с обязательным удалением окружающей клетчатки с лимфатическими узлами. В случае сомнений в отношении R0 необходима маркировка краев резекции хирургическими клипсами для последующей возможной ЛТ.
Минимально инвазивная торакоскопическая операция менее травматична, но не рекомендуется широко в рутинной практике. Однако она может использоваться при I–II стадиях в крупных многопрофильных центрах опытным хирургом (при неинвазивной тимоме). При местнораспространенном опухолевом процессе оптимальным доступом является полная продольная стернотомия, которая может быть дополнена торакотомией. Торакотомный доступ не позволяет выполнить радикальное удаление опухоли, характеризуется высокой частотой местных рецидивов, поэтому не рекомендуется.
Алгоритм диагностики и лечения ранних стадий опухолей вилочковой железы представлен на рис. 1.
-
4.1.2. Послеоперационное лечение
Решение вопроса о послеоперационном лечении зависит от радикальности и сроков после операции, гистологического типа опухоли и стадии заболевания по Masaoka–Koga. Адъювантно используют ЛТ, ХТ или их сочетание.
При I инкапсулированной стадии после операции R0 независимо от гистологического типа адъювантное лечение не рекомендуется.
ЛТ при II стадии вызывает большие споры. При радикальной операции с подтвержденной микроинвазией стадии IIА (типах А, АВ, В1, В2) и макроинвазией за капсулу железы, стадии IIB (типах А, АВ, В1) вопрос о проведении адъювантной лучевой терапии остается открытым. В настоящее время убедительных данных о необходимости проведения ЛТ после радикальной операции при II стадии нет.
Более агрессивный гистологический подтип тимомы в случае IIA стадии типа В3 и при IIB стадии типов В2-В3 также должен обсуждаться на консилиуме о целесообразности адъювантной ЛТ. На основе базы данных ITMIG, которая может предоставить самые надежные доказательства для послеоперационной ЛТ на сегодняшний день, и в единственном проспективном исследовании Basse et al. (2016 г.) при тимоме II стадии даже при полной резекции наибольшее преимущество наблюдалось для гистологических подтипов B2-В3.
При III стадии тимомы после R0-резекции послеоперационная ЛТ также должна решаться индивидуально на междисциплинарном консилиуме с учетом всех неблагоприятных факторов. Ретроспективное исследование ITMIG и объединенный мета-анализ 13 ретроспективных исследований имеют противоречивые результаты.
Однозначно, что при неполных резекциях в послеоперационном периоде рекомендована адъювантная ЛТ. Используется 3D конформная ЛТ, IMRT, VMAT с ограничением доз на критические органы. В объем облучение включается область исходного распространения опухоли, переднее, верхнее и среднее средостение. Профилактическое облучение регионарных лимфоузлов (медиастинальные и надключичные лимфоузлы с двух сторон), медиастинальной и костальной плевры не рекомендуется.
ЛТ должна быть начата не позднее 3 мес. после операции. В иных случаях целесообразность ее применения необходимо обсуждать на консилиуме.
Адъювантную химиотерапию можно рассматривать на междисциплинарном консилиуме после радикальной операции при II/III/IVa стадиях тимической карциномы, особенно если не проводилась индукционная ХТ. Также адъювантная ХТ необходима при операциях R1 при тимической карциноме и R2 независимо от гистологического типа.
Адъювантная химиотерапия не показана после радикальной операции I–III стадиях независимо от гистологического типа и при резекции R1 тимомы.
При олигометастатической болезни после R0-резекции метастаза проведение адъювантной ХТ и ЛТ необходимо обсуждать на междисциплинарном консилиуме.
Оптимальный срок проведения адъювантной химиотерапии через 4–6 недель после операции. Режим адъювантной ХТ однозначно не определен.
Могут использоваться те же режимы, что и для I линии.
Алгоритм послеоперационного лечения представлен на рис. 2.
-
4.1.3. Комбинированное лечение
-
4.2. III–IVа стадии по Masaoka–Koga или рецидив заболевания
-
4.2.1. Лучевая терапия
-
4.3. IVb стадия
-
4.3.1. Химиотерапия
-
Предоперационная ХТ может проводиться у пациентов с потенциально резектабель-ной опухолью в случае инвазии в органы средостения при IIIa — IIIb стадиях (например, при Т3 — Т4). При достижении резектабельности тактика лечения вновь должна быть обсуждена на междисциплинарном консилиуме для планирования оперативного вмешательства и последующей ЛТ. В среднем проводится 2–4 курса до операции с оценкой эффективности лечения по критериям RECIST1.1. Неоадъювантная и адъювантная терапия более предпочтительна при тимической карциноме.
Послеоперационная последовательная ХЛТ (этопозид + цисплатин с ЛТ СОД-60 Гр) может быть использована при резекции R2 как при тимоме, так и при раке тимуса.
Несмотря на местнораспространенный опухолевый процесс при III–IVа стадиях, в случае рецидива, который встречается в 10–15% случаев при тимомах и до 30% при тимической карциноме и тимических нейроэндокринных опухолях, или при прогрессировании заболевания, целесообразно вновь оценить возможности хирургического лечения. Тактика ведения зависит от характера ранее проведенного лечения и зон метастазирования. Следует помнить, что ранее проведенная ЛТ органов средостения повышает риск развития кардиотоксичности ХТ. Алгоритм лечения данной категории пациентов представлен на рис. 3.
Объем лучевого воздействия на здоровые ткани должен быть минимальным. Предпочтительно 3D- или 4D-планирование с регуляцией по дыханию. Для адъювантного облучения крайне желательно использовать совмещение полученных изображений с границами опухоли до операции. СОД в случае полной резекции тимомы составляет 50 Гр; при неполных резекциях (R1, R2) — СОД 54 Гр. В случае неполной резекции рака тимуса целесообразна СОД 60 Гр в виде буста на область высокого риска локального рецидива. Технология IMRT обеспечивает лучшее распределение дозы на критические органы. Доза и кратность фракций облучения зависят от цели, объема ранее проведенного оперативного лечения и радикальности операции. Рекомендуемые дозы лучевой терапии указаны в табл. 5.
Таблица 5. Рекомендуемые дозы ЛТ при тимоме и раке тимуса
|
Назначение |
СОД |
РОД |
Длительность лечения |
|
После операции |
|||
|
Резекция R0 |
45–50 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
Микроскопически позитивный край резекции R1 |
54 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
R2 резекция или ЛТ с радикальной целью |
60–70 Гр |
1,8 Гр |
Ежедневно 5 дней в неделю |
|
Карцинома тимуса |
> 60 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
При диссеминированной тимоме |
|||
|
С паллиативной целью для купирования симптомов |
8 Гр |
8 Гр |
Однократно |
|
20 Гр |
4 Гр |
5 сеансов |
|
|
30 Гр |
3 Гр |
10 сеансов |
|
Системное лекарственное лечение пациентов с диссеминированной опухолью носит паллиативный характер. Для них ХТ является единственной опцией. К сожалению, карцинома тимуса плохо поддаётся ХТ.
При тимоме IVb стадии в случае ответа на лечение и появления признаков резек-табельности опухоли вновь необходимо обсуждать вопросы хирургического и постоперационного лучевого лечения.
Предпочтительными являются цисплатин-содержащие режимы. Для лечения тимом предпочительны режимы с антрациклинами, а для тимической карциномы — с такса-нами. Эффективность 1 линии составляет не более 35% — 44% с лучшими показателями для тимом, а II линии — от 4% до 21% для рака тимуса и 15–39% для тимом.
Выбор II и последующих линий зависит от эффективности предшествующего лечения и времени до прогрессирования. При ремиссии ≥ 6 мес. Возможно повторное назначение режима I линии, с учетом кумулятивной дозы антрациклинов.
Основные и альтернативные режимы лекарственного лечения представлены в табл. 6.
Таблица 6. Режимы химиотерапии, рекомендуемые при тимоме и раке тимуса
|
Режимы I линии |
|
|
Тимома |
Рак тимуса |
|
CAP Цисплатин 50 мг/м 2 в/в в 1-й день Доксорубицин 50 мг/м 2 в/в в 1-й день Циклофосфамид 500 мг/м 2 в/в в 1-й день Цикл каждый 21 день максимально до 8 курсов |
ТС Паклитаксел 200 мг/м 2 в/в в 1-й день Карбоплатин AUC5–6 в/в в 1-й день Цикл каждый 21 день максимально до 6 курсов |
|
ADOC Доксорубицин 40 мг/м 2 в/в в 1-й день Цисплатин 50 мг/м 2 в/в в 1-й день Винкристин 0,6 мг/м 2 в/в в 3-й день Циклофосфамид 700 мг/м 2 в/в в 4-й день Цикл каждые 21–28 дней максимально до 5 курсов |
|
|
EP Этопозид 120 мг/м 2 в/в в 1–3-й дни Цисплатин 60 мг/м 2 в/в в 1-й день Цикл каждый 21 день максимально до 6–8 курсов Возможна замена цисплатина на карбоплатин AUC5–6 |
|
|
CAP + преднизолон Цисплатин 30 мг/м 2 в/в в 1–3-й день Доксорубицин 20 мг/м 2 в/в в 1–3-й день Циклофосфамид 500 мг/м 2 в/в в 1-й день Преднизолон 100 мг в день внутрь в 1–5-й дни Цикл каждый 21 день максимально до 3–4 курсов |
|
|
VIP Цисплатин по 20 мг/м 2 с 1-го по 4-й дни; Ифосфамид 1200 мг/м 2 с 1-го по 4-й дни; Этопозид по 75 мг/м 2 с 1-го по 4-й дни, каждые 3 нед Обязательное добавление препарата уромитексан 240 мг/м 2 в/в за 15 мин до инфузии ифосфамида Цикл каждые 21 день максимально до 4 курсов |
|
|
Режимы II линии и последующих линий |
|
|
Тимома |
Рак тимуса |
|
EP Этопозид 120 мг/м 2 в/в в 1–3-й дни Цисплатин 60 мг/м 2 в/в в 1-й день Цикл каждые 21 день максимально до 6–8 курсов (возможно назначение этопозида в монорежиме) |
ТС Паклитаксел 200 мг/м 2 в/в в 1-й день Карбоплатин AUC5–6 в/в в 1-й день Цикл каждый 21 день максимально до 6 курсов (если этот режим ранее не применялся или период ремиссии более 6 мес.) |
|
GEM–CAP Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни (возможно использование гемцитабина 1000мг/м 2 в 1-й, 8-й, 15-й дни в монорежиме до прогрессирования) Капецитабин 1300мг/м 2 /сут. (650 мг/м 2 × 2 раза в день) внутрь в 1–14-й дни Цикл каждый 21 день максимально до 6 курсов (возможно использование гемцитабина в монорежиме до прогрессирования) |
|
|
ПЕМЕТРЕКСЕД Пеметрексед 500 мг/м 2 в/в в 1-й день Цикл каждый 21 день максимально до 6 курсов |
|
ОКТРЕОТИД ± преднизолон
Начиная с октреотида короткого действия по 100 мкг 3 р/сут. п/к, 14 дней
Далее пролонгированная форма по 20–30 мг в/м каждые 28 дней до 1 года
При комбинации: октреотид 0,5 мг п/к 3 раза в день ежедневно + преднизолон 0,6 мг/кг внутрь 4 раза в день.
При непереносимости или противопоказаниях к ХТ, для пациентов с октреоскан-позитивной тимомой и при карциноидном синдроме. Рецепторы к соматостатину определяются методом ИГХ.
VIP
Цисплатин по 20 мг/м 2 с 1-го по 4-й дни;
Ифосфамид 1200 мг/м 2 с 1-го по 4-й дни;
Этопозид по 75 мг/м 2 с 1-го по 4-й дни, каждые 3 нед
Обязательное добавление препарата уромитексана 240 мг/м 2 в/в за 15 мин до инфузии ифосфамида
Цикл каждые 21 день максимально до 4 курсов
CODE
Цисплатин 25 мг/м 2 в/в в 1-й день цикл каждые 7 дней
Винкристин 1 мг/м 2 в/в в 1-й день, неделя 1,2,4,6 и 8
Доксорубицин 40 мг/м 2 в/в в 1-й день, неделя 1,3,5,7 и 9
Этопозид 80 мг/м 2 в/в в 1–3-й дни, неделя 1,3,5,7 и 9
необходима поддержка ГКСФ с 3 по 5 дни цикла
5. ТАРГЕТНАЯ И ИММУНОТЕРАПИЯ
Пембролизумаб эффективен во II линии при карциноме с частотой объективных эффектов 22,5%, контролем роста опухоли 75%, мОВ 24,9 мес. Высок риск аутоиммунных осложнений (15%). Аутоиммунный миокардит 3–4 ст. встречался в 5–9% случаев. При тимомах пембролизумаб не рекомендуется.
Сунитиниб назначается независимо от c-KIT мутации во II линии терапии рака тимуса и не показан при тимоме. ЧОО достигается в 21,7–32%, мОВ 15,5–27,8 мес.
Эверолимус может использоваться как при рефрактерной тимоме, так и при раке тимуса с частотой объективных эффектов 11% и контролем роста опухоли в 88% случаев.
Режимы иммунной и таргетной терапии представлены в табл. 7.
Таблица 7. Режимы таргетной и иммунотерапии при тимоме и раке тимуса
|
Тимомы |
Рак тимуса |
|
Эверолимус 10 мг внутрь ежедневно до прогрессирования или непереносимой токсичности |
Эверолимус 10 мг внутрь ежедневно до прогрессирования или непереносимой токсичности |
|
Пембролизумаб 200 мг в/в в 1-й день Цикл каждый 21 день Максимально до 2-х лет до прогрессирования или непереносимой токсичности |
|
Тимомы |
Рак тимуса |
|
Сунитиниб 50 мг/сут. внутрь ежедневно 4 недели с 2-х недельным перерывом до прогрессирования или непереносимой токсичности Максимальная доза — 87,5 мг/сут. Минимальная доза — 25 мг/сут. |
6. ПРОФИЛАКТИКА
Профилактика заболевания отсутствует.
7. НАБЛЮДЕНИЕ
После завершения лечения динамическое наблюдение проводится каждые 6 мес. в течение первых 2 лет, далее — 1 раз в год до продолжительности 5 лет при раке тимуса и 10 лет— при тимоме. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращено 3 мес. Обязательными диагностическими процедурами являются КТ органов грудной клетки с контрастированием, УЗИ шейно-надключичных зон, органов брюшной полости, забрюшинного пространства и малого таза. При исходном позитивном анализе на антитела к ацетилхолиновым рецепторам их контроль повторять каждые 3 мес. У больных с миастенией обязательно наблюдение у невролога для коррекции терапии.
К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть опухолями средостения или риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом. В связи с этим не требуются какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого).
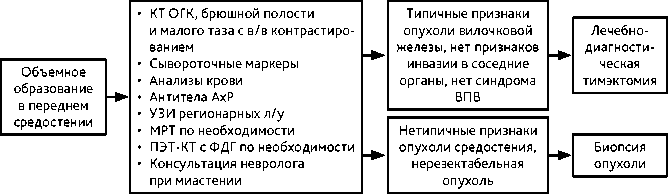
Рисунок 1. Алгоритм первичной диагностики при подозрении на опухоль вилочковой железы
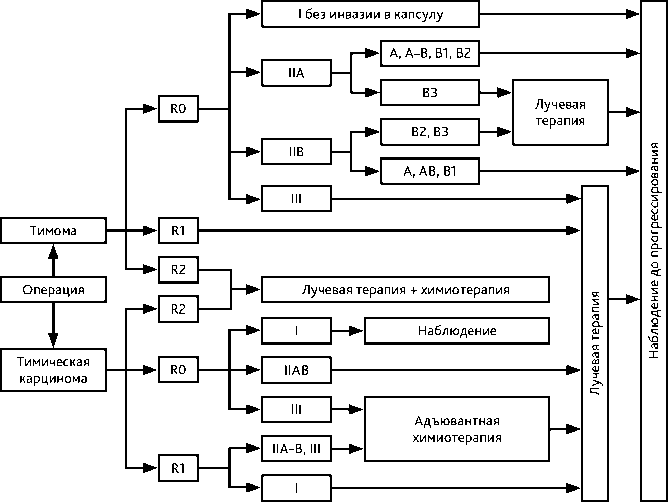
Рисунок 2. Алгоритм лечения резектабельной опухоли (стадия соответствует классификации Masaoka – Koga)
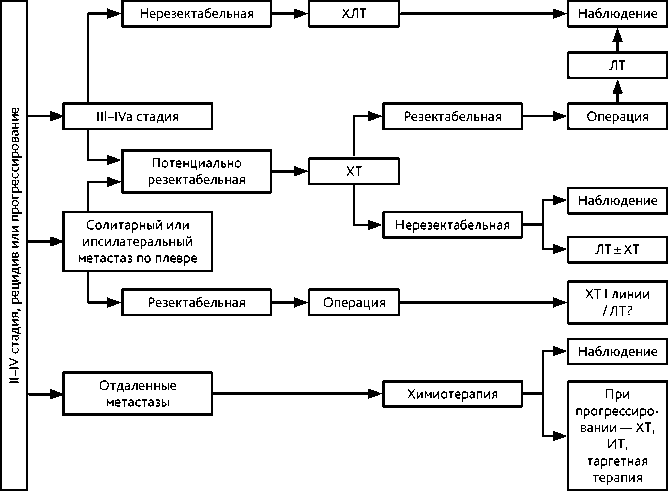
Рисунок 3. Алгоритм лечения нерезектабельной опухоли том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


