Тип тканевой организации опухоли в определении активности антиоксидантных ферментов
Автор: Смирнова Л.П., Кондакова И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (1), 2002 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14053880
IDR: 14053880
Текст статьи Тип тканевой организации опухоли в определении активности антиоксидантных ферментов
Способность опухолей генерировать супероксидный радикал была продемонстрирована на различных линиях клеток [6]. Кроме того, популяция опухолевых клеток подвергается естественному отбору со стороны опухолетоксических и ростстимулирующих факторов организма-опухоленосителя. Скорость клеточной пролиферации зависит от структурной организации опухоли и фазы ее роста.
В настоящей работе мы исследовали зависимость активности АОФ от пролиферативной активности, которая определялась типом тканевой организации и фазами роста опухолей. Способность асцитной карциномы Эрлиха расти в двух формах тканевой организации сделала ее удобной моделью для решения наших задач.
Методы исследования . Эксперименты проводились на половозрелых мышах линии С7В1/6J массой 18–22 г разводки питомника Научноисследовательской лаборатории экспериментального биомоделирования Томского научного центра Сибирского отделения РАМН. Клетки асцитной карциномы Эрлиха поддерживались путем еженедельной внутрибрюшинной перевивки (5х106 клеток в 0,5 мл среды 199) мышам линии СВА. Для индукции солидных опухолей мышам вводили клеточную суспензию подкожно на бедро. Каждая экспериментальная группа состояла из 18 животных. Фазы роста солидных опухолей определялись по их объему асцитных – по расчету числа клеток на 1 мл среды. Объём опухоли вычисляли по формуле:
V = а × b ×π/6, где а – короткий; b – длинный диаметр опухоли.
Исследуемый материал гомогенизировали в фосфатном буфере рН 7,4 с детергентом Тритон Х-100. Определение активности ферментов проводили в супернатанте после центрифугирования гомогената при 4°С, 30000 g, в течение 40 мин. Кинетика ферментативных реакций изучалась с использованием спектрофотометра "Весктап – ОЦВВ" (США). Активность каталазы измеряли по скорости утилизации гидропероксида водорода, активность супероксиддисмутазы – по скорости ингибирования восстановления нитросинего тетразолия в ксантиноксидазной системе, активность ксантиноксидазы – по скорости восстановления нитросинего тетразолия гомогенатом опухоли в системе, содержащей ксантин. Активность глутатионпероксидазы измеряли в сопряженной глутатионредуктазной реакции по замедлению скорости окисления НАДФН гидропероксидом третичного бутила, активность глутатионтранс-феразы – по образованию конъюгатов глутатиона с 1-хлор-2,4-динитробензолом, активность глута-тионредуктазы – по окислению НАДФН в при- сутствии окисленного глутатиона. Содержание белка в исследуемой ткани определялось по методу Лоури. Активность АОФ представлена в молярной концентрации субстрата на 1 мг белка. Статистическую обработку результатов проводили с использованием непараметрического критерия Вилкоксона–Мана–Уитни.
Результаты исследования. На рис. 1 приведена динамика роста опухолей карциномы Эрлиха в асцитной и солидной формах. Гистологический контроль показал, что развившиеся солидные опухоли были представлены аденокарциномами скиррозного типа и низкодифференцированными аденокарциномами. В фазе логарифмического роста (9-е сут для солидных и 4-е – для асцитных опухолей) средний объём солидной карциномы составлял 2,07 см3 , а асцит содержал 17×106 клеток/мл. Фаза стационарного роста (7-е сут для асцитной формы и 15-е сут для солидной) характеризовалась средним объёмом солидной опухоли 4,41 см и содержанием 32×106 клеток в 1 мл асцитной опухоли. Терминальная фаза достигалась солидной опухолью на 25-е сут при объёме 2,41 см3. Гистологически были видны обширные зоны некроза, строма выражена крайне скудно. Асцитная опухоль в терминальной фазе роста (14-е сут) содержала 29×106 клеток в 1 мл. Как видно на рис. 1, асцитная опухоль характеризуется более высокой скоростью клеточной репродукции, чем солидная. Известно, что асцитная опухоль также более однородна по степени пролиферативной активности.
Дни
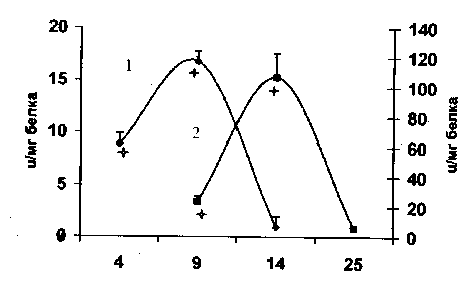
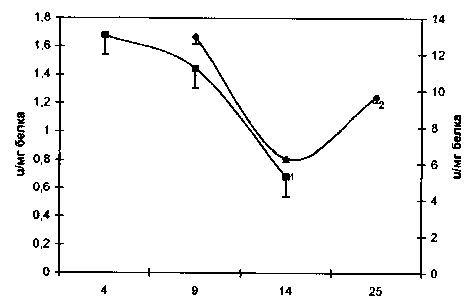
Рис. 1. Скорость роста карциномы Эрлиха: 1 – асцитная форма; 2 – солидная форма разложения пероксида водорода выражены в значительно большей степени по сравнению с асцитом. Солидная карцинома Эрлиха характеризуется более высокой степенью оксигенации. Молекулярный кислород можно рассматривать как источник супероксидного радикала, поэтому низкая активность СОД в асците по сравнению с солидной опухолью, возможно, связана с низким содержанием О2, которое также меняется в зависимости от сроков развития опухолей. Увеличение возраста солидных опухолей сопровождается снижением напряжения кислорода в 1,5 раза, а асцитных – в 2–2,5 раза, что, возможно, являлось одной из причин вариабельности активностей СОД и каталазы на протяжении эксперимента. Наблюдалось значительное повышение активности СОД при переходе клеток из логарифмической фазы в стационарную в солидной форме и ингибирование активности фермента в терминальной фазе как в солидной, так и в асцитной форме. Снижение активности СОД скорее всего может быть обусловлено увеличением концентрации H2О2, что наблюдается в терминальной фазе роста опухолей [6]. Изменение активности каталазы в солидной форме имеет динамику, противоположную супероксиддисмутазной, и, возможно, объясняется скоростью индуцибельности фермента.
Изменения в активности супероксиддисмута-зы (СОД) и каталазы в процессе роста опухоли в солидной и асцитной формах представлены на рис. 2 и 3 соответственно. По характеру кривых можно заключить, что в солидной опухоли процессы дисмутации супероксидного радикала и
Дни
Рис. 2. Активность супероксиддисмутазы в процессе роста карциномы Эрлиха: 1 – асцитная форма; 2 – солидная форма;
* – достоверность отличий (р<0,05, р<0,01) значений активности фермента между различными фазами роста (на рис. 3–7 – обозначения те же)
Дни
Рис. 3. Активность каталазы в процессе роста карциномы Эрлиха
Возможным объяснением снижения активности СОД в активно пролиферирующих клетках является гипотеза, предполагающая участие супероксидного радикала в регуляции пролиферации клеток [10]. Имеется значительное число данных относительно регуляции Cu–Zn СОД и Мп–СОД митотического цикла и скорости пролиферации опухолевых клеток. В опытах на культурах клеток гепатом с различной скоростью роста выявлена антибатная зависимость между скоростью пролиферации клеток и активностью в них Cu–Zn СОД [9]. Обнаружено снижение активности СОД в ряду: нормальная печень, регенерирующая печень и гепатома [8]. Широкий спектр опухолевых клеток содержит низкие количества Мп–СОД и м–РНК для Мп–СОД по сравнению с нормальными клетками, причем наблюдается обратная корреляция между степенью дифференцировки опухолевых клеток и активностью в них фермента [15]. Снижение СОД активности связывается с накоплением супероксидного радикала на ранних стадиях опухолевого роста, что способствует повреждению ДНК, росту числа мутаций и малигнизации клеток. Наиболее низкая активность СОД отмечалась в быстрорастущих опухолях [7]. Линии опухолевых клеток, обладающие способностью к контактному торможению, характеризуются индукцией СОД в точке остановки пролиферации [15]. Эти факты согласуются с представленными результатами и объясняют низкую активность СОД, наблюдаемую в логарифмической фазе роста как в солидной, так и в асцитной форме карциномы Эрлиха, и повышение активности фермента в стационарной фазе роста.
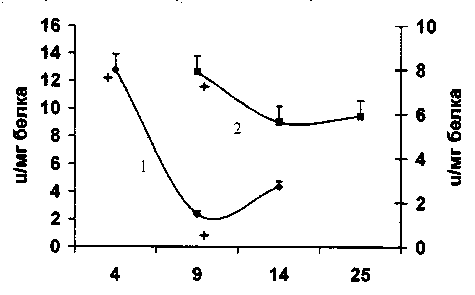
Ранее было показано, что скорость генерации радикалов О2 достигает максимума в логарифмическую фазу роста клеток, тогда как активность СОД повышается на более поздних сроках разви- тия клеточной культуры [1]. Возможно, что низкие концентрации супероксидного радикала необходимы для активной пролиферации клеток. Косвенным подтверждением данного предположения может служить высокая активность ксан-тиноксидазы в логарифмической фазе роста асцитной опухоли (рис. 4). Этот фермент катализирует окисление пуринов с образованием О2. Супероксидный радикал может участвовать в экспрессии некоторых генов, а также в разборке и обновлении ядерной мембраны. Всплеск СОД активности в солидной форме рака в фазе стационарного роста, вероятно, связан с необходимостью убрать один из пролиферативных стимулов, которым является радикал кислорода.
Дни
Рис. 4. Активность ксантиноксидазы в процессе роста карциномы Эрлиха
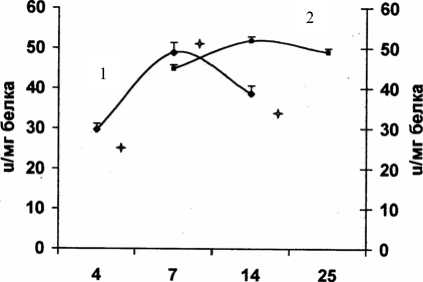
Активность глутатионзависимых ферментов утилизации гидропероксидов – глутатионпероксидазы (ГП) и глутатионтрансферазы (ГТ) в клетках асцитной опухоли в логарифмической фазе роста была значительно ниже по сравнению с другими фазами роста и активностью ферментов в солидной опухоли (рис. 5, 6). В противоположность этому активность глютатионредуктазы (рис. 7) была минимальной в фазе стационарного
Дни
Рис. 5. Активность глутатионпероксидазы в процессе роста карциномы Эрлиха
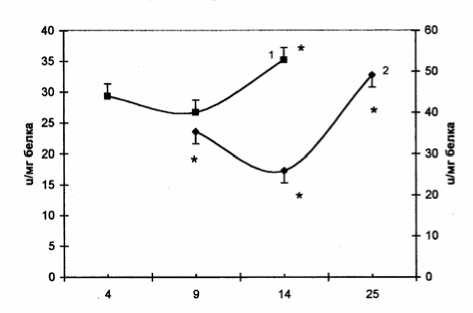
Дни
Рис. 7. Активность глутатионредуктазы в процессе роста карциномы Эрлиха
роста. Пул глютатиона более активно восстанавливается в фазе логарифмического роста в солидной форме. Это, вероятно, обусловливает более высокую активность глутатионпероксидазы и глутатионтрансферазы в фазе стационарного роста. Увеличение активности глутатионредуктазы в терминальной фазе, возможно, вызвано компенсаторной реакцией на снижение активности глутатионпероксидазы, вследствие чего содержание восстановленного глутатиона возрастает.
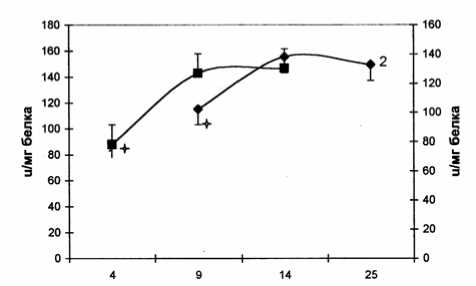
Дни
Рис. 6. Активность глутатионтрансферазы в процессе роста карциномы Эрлиха
Полученные данные свидетельствуют о том, что условия роста опухолей отражаются на активности глутатионзависимых ферментов. Зависимость между пролиферативной активностью клеток и активностью ГП и ГТ продемонстрирована на асцитной форме карциномы Эрлиха.
Вследствие низкого парциального давления кислорода ведущую роль в стимуляции пролиферации в асците играет, по-видимому, гидропероксид водорода или липопероксиды. Возможно, что супероксидный радикал, генерированный асцитными клетками в фазе логарифмического роста, переходит в гидропероксид водорода не только ферментативно, но и путем спонтанной дисмута-ции. В фазе стационарного роста возрастает активность глутатионпероксидазы, что может свидетельствовать о повышенной утилизации пероксидов. Вероятно, в активно пролиферирующих опухолях липидные пероксиды, наряду с супероксидным радикалом, играют определенную роль на некоторых этапах клеточного цикла, а ферменты метаболизма липопероксидов, так же как и СОД, могут являться регуляторами пролиферации.
Таким образом, полученные данные, свидетельствующие о низкой активности ферментов утилизации АФК и липидных пероксидов в опухолевых клетках, которые находятся в фазе логарифмического роста, и о повышении ферментативной активности при переходе в стационарную фазу роста, подтверждают участие свободных радикалов в регуляции пролиферации клеток. Активность антиоксидантных ферментов также существенно зависит от типа тканевой организации опухолей, определяющего их пролиферативный потенциал.
В литературе широко обсуждается возможность участия как ферментативных, так и неферментативных антиоксидантов в таких важнейших физиологических функциях клеток, как пролиферация и дифференцировка. Активность СОД воз- растала в несколько раз при стимуляции дифференцировки клеток. Данные о способности АОФ ингибировать пролиферацию клеток послужили основой для первых опытов применения СОД и миметиков СОД в качестве противоопухолевых средств. В эксперименте была показана регрессия опухолевых культур [10, 15] при транслокации в них фрагментов ДНК – генов Мп–СОД. Таким образом, возможность ингибирования пролиферации опухолевых клеток антиоксидантными ферментами открывает перспективу их использования как противоопухолевых средств.


