То, что скрыто от глаз. Проблема хронической и отсроченной токсичности на фоне иммунотерапии на примере клинических случаев и обзора литературы
Автор: Соболев М.М., Покатаев И.А., Кузьмина Е.С., Галкин В.Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинические случаи
Статья в выпуске: 3 т.14, 2024 года.
Бесплатный доступ
Появление иммунотерапии изменило подход к лечению ряда онкологических заболеваний. Пациенты, которые ранее были обречены на смерть в течение нескольких месяцев, в настоящий момент могут жить в течение многих лет. Тем не менее, у иммунотерапии есть свой спектр нежелательных явлений. Проблема токсичности на фоне иммунотерапии с каждым годом становится все более значимой. Особенностью нежелательных явлений иммунотерапии является то, что около 40% из них приобретают хронический характер, а часть может развиться через долгое время после завершения иммунотерапии. Учитывая то, что в последние годы в клинических рекомендациях появились опции с адъювантными режимами иммунотерапии, необходимо привлечь большее внимание к проблеме хронической и отсроченной иммуноопосредованной токсичности. В данной статье мы представляем клинические случаи, а также обзор литературы, посвященные данному типу нежелательных явлений.
Иммунотерапия, токсичность, онкология, нежелательные явления, качество жизни, надпочечниковая недостаточность, тиреоидит
Короткий адрес: https://sciup.org/140310097
IDR: 140310097 | DOI: 10.18027/2224-5057-2024-023
Текст научной статьи То, что скрыто от глаз. Проблема хронической и отсроченной токсичности на фоне иммунотерапии на примере клинических случаев и обзора литературы
Иммунотерапия (ИТ) применяется при лечении многих видов злокачественных опухолей. Область применения увеличивается с каждым годом. Часто иммунотерапия является единственной лекарственной опцией, позволяющей продлить жизнь пациенту. Долгое время иммунотерапия применялась только для лечения метастатических заболеваний. Однако за последние несколько лет вышли клинические исследования [1–3], которые позволяют нам применять ее и в адъювантном режиме, то есть у людей, на момент лечения не имеющих признаков заболевания. В связи с этим еще более актуальным становится вопрос мониторинга и управления иммуноопосредованными нежелательными явлениями (иоНЯ).
Как известно, иммуноопосредованная (ИО) токсичность может развиваться как на фоне терапии ингибиторами контрольных точек, так и после ее завершения [4]. Она может развиваться остро и затем разрешаться, как правило, при применении глюкокортикостероидов (ГКС), но также может развиться и хроническая токсичность, которая будет сохраняться месяцы и годы, и для ее купирования пациенту, возможно, постоянно будет требоваться медикаментозная поддержка.
Хроническая иммуноопосредованная токсичность — токсичность, которая сохраняется в течение не менее чем 12 недель после отмены иммунотерапии [5]. Она возникает примерно у 43 % пациентов, получающих иммунотерапию, а разрешается в последствии только у 15% больных [5].
Отсроченная иммуноопосредованная токсичность — токсичность, которая развивается не менее чем через 3 месяца после отмены иммунотерапии [6]. Истинную частоту развития данных осложнений сложно оценить, поскольку в ряде случаев пациенты после завершения терапии нерегулярно наблюдаются у онколога, а неспецифичность симптомов затрудняет диагностику.
Занимаясь противоопухолевым лекарственным лечением, каждый врач сталкивается с нежелательными явлениями. Существуют утвержденные рекомендации по управлению иоНЯ [7]. Чаще всего они возникают остро на фоне лечения, и при отмене терапии или перерыве в лечении разрешаются, крайне редко переходя в хронические формы. Появление иммунотерапии и все более активное ее применение поставило перед врачами новые задачи, связанные с безопасностью лечения. Дело в том, что около 40 % иоНЯ переходят в хроническую форму. Для купирования иоНЯ, как правило, применяются ГКС, пожизненный прием которых даже в минимальных дозах может ухудшать качество жизни пациента. Однако токсичность может развиться и через несколько месяцев после отмены лечения. Таким образом, возможна недооценка истинной частоты иоНЯ, так как некоторые осложнения, например, надпочечниковая недостаточность, имеют неспецифические симптомы, такие как тошнота, низкое давление, ухудшение аппетита и потеря массы тела. Развитие этих симптомов на фоне терапии наверняка заставит химиотерапевта заподозрить надпочечниковую недостаточность, но если лечение завершено, и пациент не посещает онколога каждый месяц, установление причины и начало правильной терапии может быть значительно отложено.
Мы представили 2 клинических случая, характеризующих проблему хронической и отсроченной токсичности на фоне ИТ.
СЛУЧАЙ №1
Пациент Л., 65 лет, получал лечение по поводу мелкоклеточного рака правого легкого сТ4N2M1b IVB стадии с метастазами в правое легкое, лимфоузлы средостения, плевру, лимфоузлы ворот печени и кости.
В феврале 2022 года установлен и подтвержден гистологически метастатический мелкоклеточный рак легкого.
С марта по май 2022 проведено 4 курса химио-иммунотерапии этопозид + карбоплатин + атезолизумаб. Перед началом терапии пациенту был взят анализ на ТТГ, электролиты, клинически значимых отклонений выявлено не было.
По данным КТ от 05.2022 зафиксировано прогрессирование заболевания, принято решение о смене терапии на режим CAV (циклофосфамид + доксорубицин + винкри-стин) и далее доцетаксел. На обоих режимах зафиксировано прогрессирование при первом рентгенологическом контроле после 3 курсов.
На фоне химиотерапии 3 линии пациент начал отмечать жалобы на гипотонию, тошноту, выраженную общую слабость, при контроле анализов выявлены электролитные нарушения — Na+ — 110 ммоль / л (135,00–145,00), K+ — 3,10 ммоль/ л (3,50–5,10), Ca2+ — 1,07 ммоль/л (1,13– 1,32), Cl- — 83,00 ммоль/л (95,00–110,00). В связи жалобами и изменениями, выявленными в крови, консультирован эндокринологом, дополнительно выполнены анализы: ТТГ— 76 мкМЕ/мл (0,27–4,2), АТ к ТПО — более 1300 МЕ/мл (0– 34), кортизол 1,36 мкг /дл (3,7–19,4), АКТГ — менее 1 пг /мл (7,2–63,3). Больной повторно консультирован эндокринологом, с учетом данных клинической картины и полученных анализов у пациента диагностирована вторичная надпочечниковая недостаточность (ВНН), аутоимунный тиреоидит, гипотиреоз. Назначена терапия L-тироксином, гидрокортизоном с значительным клинико-лабораторным улучшением, восстановлением качества жизни.
В дальнейшем пациент получил еще несколько линий лечения по поводу основного заболевания, продолжая принимать заместительную гормонотерапию по поводу тиреоидита и надпочечниковой недостаточности.
Таким образом, нежелательные явления появились через 5 месяцев после завершения иммунотерапии. Учитывая то, что химиотерапия крайне редко вызывает подобные явления, мы расцениваем это проявлением отсроченной иммуноопосредованной токсичности.
СЛУЧАЙ №2
Пациент И., 67 лет, получал лечение по поводу множественной меланомы кожи.
В октябре 2016 года пациенту проведено радикальное удаление первичной опухоли, в адъювантном режиме проводилась терапия интерфероном-альфа до февраля 2017 года.
В феврале 2017 года выявлено прогрессирование в виде появления метастазов в подмышечных лимфоузлах и появления образования волосистой части головы. Про- ведено лечение в объеме удаление меланомы волосистой части головы, подмышечная лимфаденэктомия справа.
Динамическое наблюдение продолжалось до сентября 2017 года, когда было выявлено прогрессирование болезни — метастазы в мягких тканях туловища и ретро-круральных лимфоузлах. В декабре 2017 года пациент начал получать ИТ анти-PD-1 препаратом в рамках клинического исследования.
В декабре 2018 года пациент отметил появление жалоб на слабость 2 степени, тошноту 2 степени (CTCAE 5.0) и гипотонию. В анализах крови выявлены следующие отклонения: кортизол — < 0,8 мкг / дл (норма 3,7–19,4). На основании клинико-лабораторной картины пациенту установлен диагноз вторичной надпочечниковой недостаточности (ВНН). Начата поддерживающая терапия преднизолоном 5 мг/сут., которая в дальнейшем была заменена на гидрокортизон. В последующем ИТ была продолжена до достижения полной клинической регрессии, подтвержденной несколькими КТ. Несмотря на отмену иммунотерапии на фоне полного ответа на лечение, у пациента на момент написания статьи сохраняется ВНН и необходимость заместительной эндокринной терапии.
Таким образом, иммунотерапия индуцировала развитие перманентной надпочечниковой недостаточности Grade 2 (CTCAE 5.0), которая имеет весьма неспецифические симптомы, и требует многолетней коррекции при помощи ГКС.
Поскольку каждый их представленных случаев затрагивает эндокринную систему, мы видим необходимость представить схему строения гипофиза с регуляцией работы органов-мишеней (рис. 1).
В первом случае иммуноопосредованная токсичность затронула как базофильные клетки гипофиза, так и клетки щитовидной железы и надпочечников. Важно, что при иммуноопосредованном воздействии поражается лишь отдельная часть клеток гипофиза, и в зависимости от этого может нарушиться работа разных органов, контролируемых им.
Во втором случае в результате воздействия иммунотерапии был поражен корковый слой надпочечников, что привело к развитию вторичной надпочечниковой недостаточности.
ОБСУЖДЕНИЕ
Учитывая растущую с каждым годом область применения иммунотерапии, кажется странным малое количество публикаций по поводу иоНЯ. Между тем, данная проблема становится все более актуальной. Применение адъювантных режимов иммунотерапии без полного понимания возможных осложнений лечения весьма рискованно. Приведенные выше клинические случаи демонстрируют долгосрочные последствия применения ИТ, те, что могут быть скрыты от глаз онкологов в виду неспецифичности симптомов или развития через долгое время после завершения лечения.
Согласно определению, данному в журнале JAMA Oncology [5], хроническая иммуноопосредованная токсичность — это токсичность, которая сохраняется в течение не менее чем 12 недель после отмены иммунотерапии. Она возникают примерно у 43% пациентов, получающих иммунотерапию. Это может быть последствием острых, жизнеугрожающих осложнений и осложнений, которые не приводили к жизнеугрожающим состояниям. Большая часть хронических иоНЯ не превышала вторую степень тяжести и не приводила к отмене терапии. Наиболее часто встречались тиреоидиты, артриты/артралгии, дерматиты, надпочечниковая недостаточность и нейротоксичность, гипофизиты и ксеростомия. Около 30% пациентов нужда-
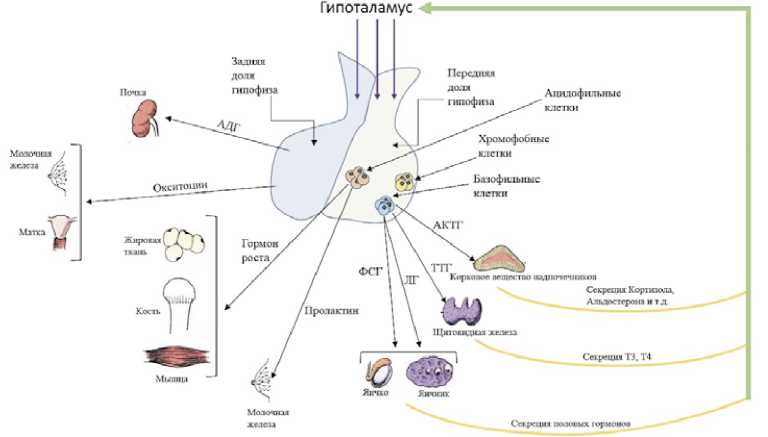
Рисунок 1. Строение гипофиза с регуляцией работы органов-мишеней
Figure 1. The structure of thepituitary gland with its regulation of the target organsfunctioning
лись в постоянном приеме глюкокортикостероидов. Стоит отметить, что в случае развития хронической токсичности на фоне ИТ, только у 15% пациентов в последствии наблюдалось разрешение этих побочных явлений. Примерно в половине случаев иоНЯ носили симптомный характер. Данный вид токсичности не зависел от пола и возраста пациента.
Интересен механизм развития хронических НЯ. В журнале Nature Reviews предполагают 2 механизма — «выгорание» или «тлеющее воспаление». Выгорание ведет к необратимому повреждению клеток, тем самым препятствуя их физиологическому восстановлению. Эндокринопатии — типичный пример данного механизма. В этом случае гормон-секре-тирующие клетки безвозвратно повреждаются или уничтожаются воспалительным процессом. Другие НЯ тоже могут попадать в эту категорию, например, нейропатия, когда необратимо повреждаются периферические нервы, или ксеростомия, с хроническим рубцеванием слюнных желез, приводящим к невозможности оттока и снижению выработки слюны. Другой механизм — «тлеющее воспаление» — может напоминать развитие классических аутоиммунных реакций, при котором иммунотерапевтический агент запускает острое или хроническое воспаление. Иммуноопосредованный артрит — пример данного механизма НЯ. Он очень похож по течению на ревматоидный артрит и переходит в хроническое состояние примерно в половине случаев [8,с.258].
В обоих описанных нами случаях, вероятнее всего, имел место первый механизм развития токсичности — выгорание, что потребовало добавления заместительной гормональной терапии для купирования развившихся иоНЯ.
Ghisoni E. et al. [9] в 2021 году провели анализ данных 437 пациентов с меланомой и раком легкого. У них было зафиксировано 318 случае ИО токсичности. Согласно полученным данным, 35% побочных явлений, выявленных у этих пациентов, продолжались не менее 6 месяцев при медиане наблюдения 369 дней (194–695 дней), 40% фиксировались на момент прекращения наблюдения или смерти пациента. Большинство из них составили эндокринологические (53,9%), кожные (15,6%), ревматологические (10,9 %) НЯ, а также пневмониты (8,6 %). Исследователи не выявили связи между частотой и длительностью НЯ и общей выживаемостью пациентов.
В 2022 году Justin Tong et al. [10] опубликовали свое исследование, в которое включили 116 пациентов с меланомой. У 66 пациентов (41,0%) развились постоянные иоНЯ у 15 (9,3%) — долгосрочные иоНЯ как их самая продолжительная токсичность, у 34 (21,1 %) развились только преходящие иоНЯ, а у 46 (28,6%) иоНЯ не было. Постоянные НЯ возникали у 21 пациента (65,6%), получавших двойную иммунотерапию, и у 45 пациентов (34,9%), получавших монотерапию. Большинство постоянных иоНЯ были эндокринными (36,0 %) или кожными (32,4%).
Оба описанных случая подтверждают факт того, что эндокринные нарушения, как проявление иоНЯ встречаются наиболее часто. Что касается отсроченной токсичности, это вероятно более редкое явление, которое меньше описано в литературе.
В 2018 году был опубликован кейс-репорт [11], в котором у пациента через 8 месяцев после отмены ниволумаба развился иммуноопосредованный гепатит, купированный в итоге высокими дозами преднизолона. Этот случай интересен тем, что исследователи попытались объяснить механизм отсроченных иоНЯ. По мнению исследователей, то, что даже через 2 месяца после однократного введения ниволумаба сохраняется блок рецептора PD-1 на циркулирующих Т-клетках, позволяет предположить, что активация иммунитета тоже может сохраняться в течение месяцев после отмены терапии.
В 2019 году вышла статья [6], в которой было дано определение отсроченным иммунонопосредованным событиям (delayed immune-related evеnts — DIRE), определены их критерии и проанализирована база клинических случаев, большая часть которых пришлась на 2018 год. Исследователи определили, что медиана развития DIRE составила 6 месяцев (3–28 мес.). Ими были выявлены 23 подтвержденных случая DIRE. Преобладающим видом которых была надпочечниковая недостаточность (6 случаев), но также были подтверждены тиреоидит, нейросаркоматоз, перикардит, пневмонит, витилиго и алопеция (по 2 случая), увеит, эозинофильный фасциит, колит, гепатит, пемфигоид, саркоидоз, миокардит и синдром Гийена–Барре (по 1 случаю). У троих пациентов развилось 2 и более проявлений DIRE. Так же исследователи отмечают, что примерно у половины пациентов (12/23) была токсичность и во время лечения, что часто и приводило к отмене иммунотерапии, но большая часть ее была купированы приемом ГКС, или инфликсимаба в случае с колитом.
В 2021 году на сайте ESMO вышла большая статья, посвященная отсроченной токсичности иммунотерапии [12] у пациентов с меланомой кожи. Большая часть ее посвящена позднему началу токсичности именно на фоне терапии, но также указано, что у части наблюдаемых пациентов токсичность развивалась после отмены терапии. Подходящих под критерии DIRE в этом исследовании было 16 пациентов (из 118 с поздним началом токсичности). В их числе один пациент, у которого развился ИО колит 4 ст. (CTCAE 5.0) через 26 месяцев после последнего введения иммунотерапии и пациент с фатальной полиорганной недостаточностью спустя 11 месяцев после прекращения ИТ.
На ASCO 2023 были опубликованы данные исследования отсроченной иммуноопосредованной токсичности для пациенток с раком молочной железы. Были выбраны 100 пациенток, из которых у 11 развилась отсроченная токсичность. Стоит указать, что критерием отсроченной токсичности были прошедшие 60 дней с момента последней дозы ИТ, а не 84 дня, как в предыдущем исследовании. Надпочечниковая недостаточность преобладала и в данном случае — 5 случаев, так же были выявлены тирео-дит (3), колит (3), повышение трансаминаз (3), артралгия и нейтропения (по 2). У 9 из 11 пациентов токсичность была и на фоне лечения [13].
В недавно опубликованном обзоре [14] группы Chen et al. исследуют достаточно редкие проявления токсичности на фоне иммунотерапии, а именно кардиотоксичность и ней- ротоксичность. Исследователи отмечают, что количество случаев этих видов НЯ тоже растет вместе с показаниями для применения ИТ. Так же они акцентируют внимание на том, что зачастую мы мало что можем предложить этим пациентам, кроме стероидов. Авторы касаются опций купирования токсичности в случае стероид-рефрактерных проявлений, призывают не медлить и использовать возможные иммуносупрессоры в случае подозрения на ре-фрактерность к стероидам. В заключении они напоминают, что в настоящий момент польза от адъювантных режимов анти-PD-1 ингибиторов это только доказанный выигрыш в безрецидивной выживаемости, без существенного снижения риска смерти, и важно тщательно подходить к выбору терапии, учитывая не только прогноз пациента, но и возможные осложнения.
Anupam Kotwal et al. [15] в журнале JCO Oncology Practice в 2023 пишут, что эндокринопатии являются наиболее часто встречающимися НЯ на фоне ИТ, могут значительно ухудшать результаты лечения, проявляться неспецифическими симптомами, что затрудняет диагностику, многие из них необратимы и требуют постоянной гормон-заместительной терапии; могут развиваться в разное время на фоне и после завершения иммунотерапии. Так же авторы предлагают использовать алгоритм ABCDEF для повышения выявляемости НЯ:
-
• Anticipate — предвидение, врач должен быть готов к тому, что у пациента может развиться токсичность на фоне ИТ;
-
• Baseline Testing — нужны начальные данные: ТТГ, гликированный гемоглобин, кортизол, кальций, электролиты;
-
• Clinical evaluation — клиническая оценка, умение соотнести симптомы и анализы;
-
• Diagnosis — постановка верного диагноза;
-
• Education — обучение и подготовка мультидисци-плинарной команды, а так же пациентов. В команду
должны входить онколог, терапевт, эндокринолог, дерматолог, гастроэнтеролог, невролог и кардиолог;
-
• Follow-up — наблюдение: после завершения ИТ пациент должен наблюдаться и сдавать анализы каждые 3 месяца в первый год, каждые 6 месяцев в течение следующих лет.
В первом клиническом случае приведенный выше алгоритм был частично реализован, начиная со второго пункта: пациенту был перед началом иммунотерапии были взяты анализы на ТТГ, электролиты. Повторно анализы были взяты уже после развития симптомов токсичности. Во втором случае предвидение и информированность лечащего врача о возможных НЯ стала причиной своевременного выявления и купирования токсичности, до развития тяжелой формы нежелательного явления. Представленные случаи иллюстрируют. в первую очередь, возможность развития токсичности даже после завершения лечения, а также риск того, что развившееся осложнение будет сопровождать пациента в течение всей последующей жизни после завершения курса лечения.
ЗАКЛЮЧЕНИЕ
Таким образом, проблема хронических и отсроченных иоНЯ заслуживает внимания практикующих онкологов, а также терапевтов и специалистов других профилей, требует дальнейшего изучения. Актуальность ее возрастает в связи с расширением показаний к адъювантному применению иммунотерапевтических препаратов. Для своевременного выявления и управления данными НЯ необходима информированность и настороженность пациента и врачей, его наблюдающих. Большое значение сохраняет полнота обследования перед стартом терапии, в процессе лечения и после его завершения.


